忍冬属植物中环烯醚萜苷类化合物的研究进展
2015-01-09杜芳黎姚彩云宋志军
杜芳黎,姚彩云,宋志军
广西壮族自治区药用植物园 西南濒危药材资源开发国家工程实验室,南宁 530023
环烯醚萜苷类化合物(Iridoids)是一类特殊的具有缩醛或半缩醛结构的单萜化合物,因此其苷元不稳定,常常以糖苷的形式存在。环烯醚萜类化合物在植物中的分布很有特征性,主要存在于茜草科等双子叶植物中,因此该类化合物在植物化学分类学中也有重要意义[4]。比较有意思的是环烯醚萜类化合物是忍冬属植物的主要水溶性成分。而金银花不管是传统的方剂中,还是近年来新兴的凉茶用药,均为水煎剂。结合文献报道环烯醚萜萜类化合物具有保肝利胆、抗炎镇痛、抗氧化、抗肿瘤、抗动脉粥样硬化、抗焦虑等多种药理活性,我们可以断定环烯醚萜类化合物在金银花等忍冬属植物的药效中,有着不可或缺的重要意义。为了更好地开发利用忍冬属植物资源,进一步了解环烯醚萜类化合物在忍冬属植物中的研究状况,探索环烯醚萜类化学成分在忍冬属植物的药理活性中扮演的角色,本文对国内外有关忍冬属中环烯醚萜的化学结构类型及其药理作用研究做一综述,以期为该类化合物和相关植物的开发利用提供参考。
1 忍冬属植物中环烯醚萜类化合物的结构研究
1.1 环烯醚萜类化合物的结构简介
因分子结构中有环烯醚键,又是单萜衍生物,所以称为环烯醚萜,环烯醚萜往往由一个五元环和一个六元的烯醚环组成,五元环的C-6,C-7,C-8 位可以有取代基,其中6,7 位、7,8 位、8,9 或8,10 位之间均易形成碳-碳双键,其1-OH 易与葡萄糖结合形成苷键,天然存在的环烯醚萜多为苷。如果环戊烷的C-7、C-8 位之间的共价键断裂,则形成裂环式环烯醚萜。据此,该类化合物的结构主要可分为环烯醚萜苷类和裂环式环烯醚萜苷类。
1.2 忍冬属植物中环烯醚萜的结构类型
根据对以往国内外文献进行研究分析和总结,我们将忍冬属植物中分离鉴定出的环烯醚萜类化合物主要分为以下三类来介绍。
1.2.1 闭环环烯醚萜苷类
从忍冬属植物中分离得到的闭环环烯醚萜苷类化合物均为C-4 位有取代基的化合物,常见的取代基主要有-COOCH3和-COOH 两种。
比较图2的蜂窝夹芯胞元结构可知,当传统的六边形蜂窝特征角θ=0°时,六边形蜂窝夹芯可演变成类方形蜂窝夹芯。类方形蜂窝夹芯胞元结构中的直壁板是斜壁板的2倍,即h=2l。因此可在传统六边形蜂窝夹芯等效弹性参数的基础上,推导得到类方形蜂窝夹芯的等效弹性参数。
迄今为止从忍冬属植物中分离得到的闭环环烯醚萜苷类化合物其来源见表1;忍冬属中闭环环烯醚萜化合物的结构如图1。

表1 闭环环烯醚萜类化合物来源Table 1 Sources of general iridoids
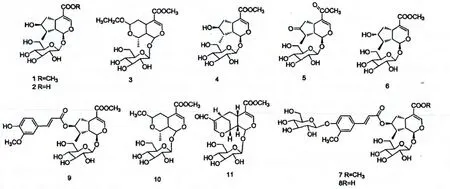
图1 闭环环烯醚萜类化合物结构Fig.1 Chemical structures of general oridoids
1.2.2 裂环环烯醚萜苷类
裂环环烯醚萜苷类化合物是由闭环环烯醚萜苷的C-7-C-8 键断裂而产生的,从忍冬属植物中分离得到的环烯醚萜苷多数属于此类化合物。
例如,Tomassini L[20]等从金银花正丁醇萃取部位中分离得到七个裂环环烯醚萜苷类化合物,并证明其中的5 个可能是在分离过程中由secologanin 和secologanic acid 与作为溶剂或萃取剂的醇类物质反应而得,由此说明环烯醚萜化合物不稳定。Kashiwada Y[33]等从金银花的甲醇提取物种共分离鉴定出11 个裂环环烯醚萜类化合物,有意思的是其报道的化合物1 和化合物2 分别与酚性葡萄苷偶联,化合物3 和4 分别与尼克酸偶联;Wei XS[32]等从金银花的水溶性部分分离得到3 个新的偶联裂环环烯醚萜化合物,这些化合物由N-取代烟酸骨架的C-5 位与裂环环烯醚萜苷的C-7 位偶联形成。Yang Y[31]等从金银花花蕾的水溶性部位中分离得到15 个新的环烯醚萜和裂环环烯醚萜类衍生物,其中的四个为苯丙酮酸衍生物与环烯醚萜或裂环环烯醚萜偶联,剩余的11 个为N-取代烟酸骨架的C-5 位与裂环环烯醚萜苷的C-7 位偶联形成;
历年来从忍冬属植物中分离得到的裂环环烯醚萜苷类化合物来源见表2;裂环环烯醚萜类化合物的主要结构如图2,本文在之前报道[56]的基础上又新增了若干个结构。

表2 裂环环烯醚萜类化合物的来源Table 2 Sources of secoiridoids

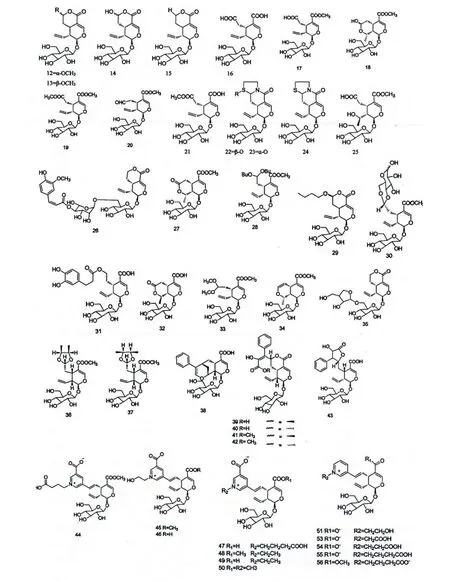
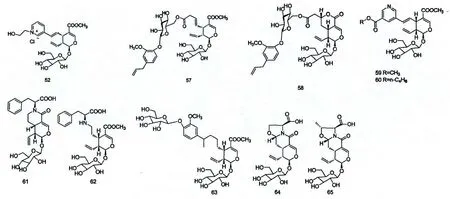
图2 裂环环烯醚萜类化合物结构Fig.2 Chemical structures of secoiridoids
1.2.3 聚合环烯醚萜苷类
聚合环烯醚萜是由若干分子的环烯醚萜经酯键、C-C 键或其他键连接而成的,忍冬属植物中发现的聚合环烯醚萜类化合物多为二聚体。
Wang YL[42]等从金银花忍冬中首次分离得到一个裂环马钱素二聚体,并命名为金花忍冬素(chrysathain);Koichi M[40]等从金银花忍冬的茎和叶中分离得到(Z)-aldosecologanin 和6'-O-(7α-hygroxyswerosyloxy)loganin;Bi YF[14]等从金银花水提物中分离并鉴定出7 个裂环环烯醚萜类化合物中,化合物(E)-aldosecologanin 是通过C-C 键相连的二聚体环烯醚萜苷。Machida K[44]等从蓝果忍冬(L.caerulea)中分离并鉴定出2 个新的二聚环烯醚萜,并分别命名为caeruleosides A and B;Kita M[45]等从L.korolkovii 中首次分离并鉴定出一个新的由两个secologanin 单元组成的二聚环烯醚萜苷,并命名为korolkoside;聚合环烯醚萜类化合物的主要结构如图3。

表3 聚合环烯醚萜化合物的来源Table 3 Sources of polymeric iridoids
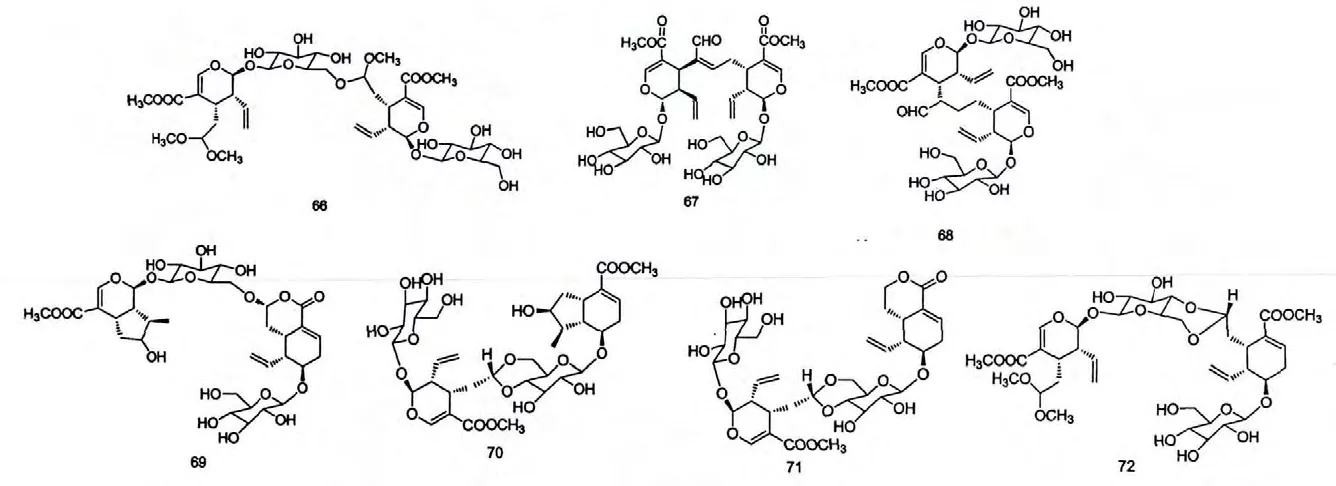
图3 聚合环烯醚萜化合物结构Fig.3 Chemical structures of polymeric iridoids
2 忍冬属植物中环烯醚萜类化合物的生物合成途径
从忍冬属植物中分离得到的环烯醚萜苷类化合物结构多样,因此其生成途径也各具特色,但是目前为止对此类化合物的生成途径研究却鲜有报道,仅有学者Wei XS[32]对部分从忍冬属植物中分离得到的环烯醚萜类化合物的生物合成途径进行了探索研究。
从忍冬属植物中分离得到的闭环环烯醚萜苷类化合物,其C-3 与C-4 间形成双键,C-4 位的取代甲基被氧化成羧基并可以继续成酯,C-7 位为有羟基取代基,并可继续成酯或酮,C-8 位有甲基取代基。不同结构的闭环环烯醚萜类化合物可能的生物合成途径总结如下:
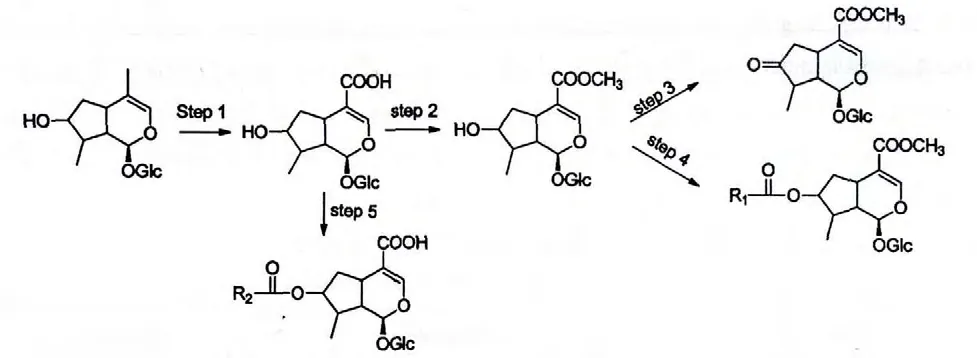
图4 环烯醚萜类化合物的合成途径Fig.4 The synthesis path of iridoids
第一步是C-4 位甲基被氧化为羧基的过程,形成化合物Loganic acid 所示的结构;第二步是C-4 位羧基酯化的过程,形成如化合物Loganin,8-Epiloganin 和7-epi-loganin 所示的结构;第三步是C-7 位羟基被氧化的过程,形成如化合物7-oxologanin 所示的结构;第四步是C-7 位羟基与酸酯化的过程,形成化合物periclymenoside、7-Feruloylloganin 所示的结构;第五步机理同第四步,形成化合物peric-lymenosidic acid 所示的结构。
从忍冬属植物中分离鉴定出的裂环环烯醚萜,是由闭环环烯醚萜的C-7-C-8 键断裂而产生的,并且C-8-C-10 间形成双键。不同结构的裂环环烯醚萜,其生化合成途径不同。
第一步是C-7 位氧化为醛的过程,形成的结构如化合物Secologanin 所示的结构;第二步是C-7 位氧化为酸的过程,形成如化合物secologanoside,secoxyloganin 所示的结构;第四步是C-7 位羧基继续酯化的过程,形成如化合物Dimethyl-Secologanoside,Secologanoside 7-methyl ester 所示的结构。第五步是C-8 位氧化为羟基的过程,形成化合物alPigenoside 所示的结构;化合物alPigenoside 的C-7,C-8 位取代基发生缩合反应,形成化合物kingiside 和8-ePikingiside(第六步),kingiside 和8-ePikingiside 的构象不同。第七步是形成化合物dehydromorroniside所示结构的过程。
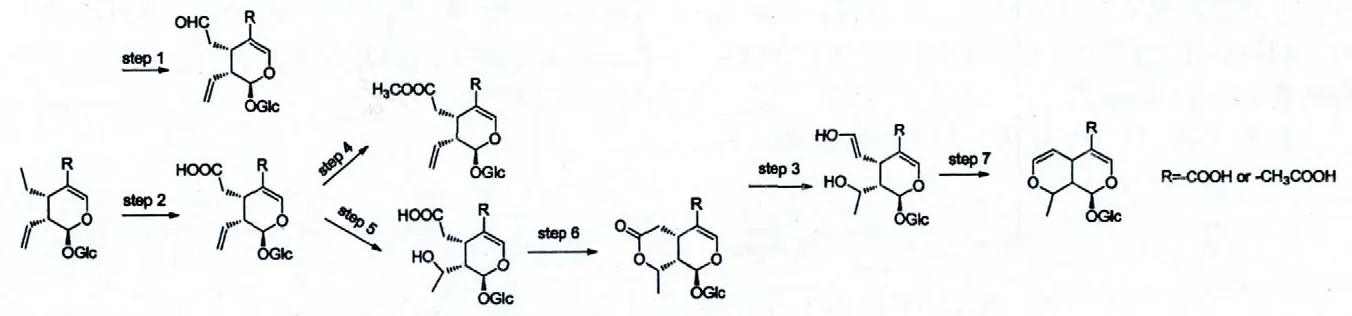
图5 环烯醚萜类化合物的合成途径Fig.5 The synthesis path of iridoids

图6 环烯醚萜类化合物的合成途径Fig.6 The synthesis path of iridoids
化 合 物 7-O-(4-β-D-glucopyranosyloxy-3-methoxybenzoyl)secologanolic acid 和grandifloroside 所示结构的形成过程如上所示,C-7 位首先被氧化为羟基,而后与不同的酸进行酯化反应而得。
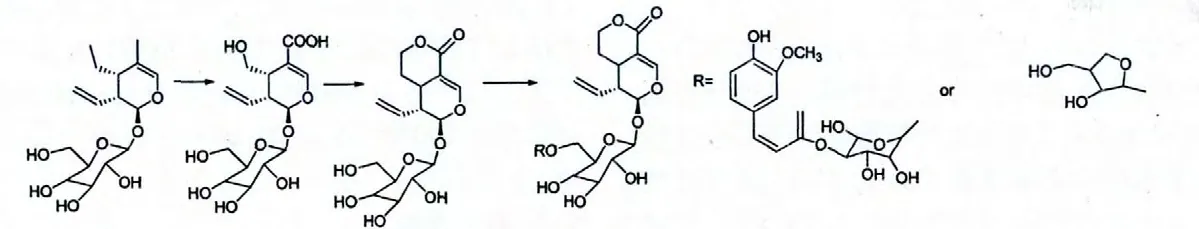
图7 环烯醚萜类化合物的合成途径Fig.7 The synthesis path of iridoids
上图是化合物sweroside,Kinginoside,6'-O-β-apiofuranosylsweroside 所示结构的可能合成途径,首先C-4 位与C-7 位分别氧化成羧基和羟基,而后发生缩合形成内酯,即化合物sweroside 所示的结构,化合物sweroside 葡萄糖基的羟乙基部分与另一分子的羟基缩合成醚,形成的结构如化合物Kinginoside和6'-O-β-apiofuranosylsweroside 所示的结构。
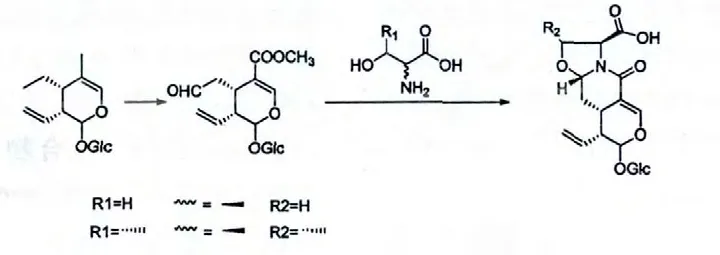
图8 环烯醚萜类化合物的合成途径Fig.8 The synthesis path of iridoids
上图中,裂环环烯醚萜的C-4 位甲基和C-7 位甲基分别被氧化成羧基和醛基,C-4 位羧基继续成酯,而后与不同构型的氨基酸反应,得到如化合物金银花苷I,J 所示的结构。
学者Yang Y[31]等对化合物loniphenyruviridoside A(38)、loniphenyruviridoside B(39)、loniphenyruviridoside C(40)、loniphenyruviridoside D(43)的生物合成途径进行了探讨,认为该四个化合物的主要生物合成途径如下所示:
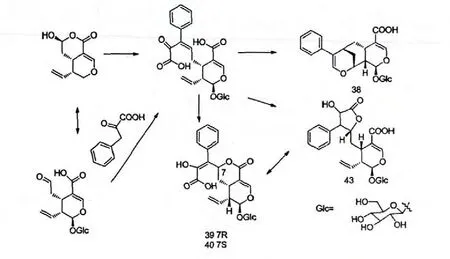
图9 环烯醚萜类化合物的合成途径Fig.9 The synthesis path of iridoids
3 忍冬属植物中环烯醚萜类化合物的生物活性研究
3.1 抗炎作用
韩国学者Song JL[46]等通过小鼠耳壳肿胀急性炎症模型和佐剂诱导性关节炎(AIA)慢性炎症模型,以阿司匹林和泼尼松龙为阳性对照,证明从金银花水溶性部位分离得到的loniceroside A 等化合物具有抗炎止痛的作用;通过与的抗炎活性相比,发现loniceroside A 的抗炎活性虽弱于泼尼松龙,却与等剂量的阿司匹林相当;100 mg/kg·d 剂量的loniceroside A 也可抑制小鼠佐剂性关节炎,而作为对照药的泼尼松龙在20 mg/kg·d 计量时就表现出强有效的活性。由此也可以说明loniceroside A 等化合物为金银花抗炎活性的有效成分。Kwak WJ[47]等通过小鼠耳肿胀模型研究了从金银花忍冬茎中分离鉴定得獐牙菜苷(swerosid)的抗炎作用,实验证明口服或静脉注射的獐牙菜苷对巴豆油或花生四烯酸诱发的小鼠耳肿胀均具有显著抑制作用。
3.2 保肝作用
Li HJ[8]等对从忍冬花蕾中分离鉴定出的5 个环烯醚萜苷类化合物进行保肝活性测试,结果表明化合物马钱素、secoxyloganin、7-epi-1oganin 在20 mg/kg 剂量下有明显的保肝活性(P<0.01)。Su H[48]从金银忍冬果实中提取得到环烯醚萜总苷,用CCl4诱导小鼠急性肝损伤模型对其保肝作用进行了实验研究,结果表明:与正常组血清比较,模型组血清ALT 和AST 水平显著升高,给药后血清中升高的ALT 和AST 显著降低,且低剂量给药效果更佳。说明忍冬属植物中的环烯醚萜类化合物具有保肝作用。
3.3 解热作用
An YW[49]等学者从金银花中分离鉴定出其主要成分裂环马钱子苷酸,并通过药理实验观察裂环马钱子苷酸和以环烯醚萜苷类为主要成分的金银花提取物对酵母菌悬液所致大鼠体温的影响,以研究它们的解热作用。实验结果表明,裂环马钱子苷酸和金银花提取物对酵母所致大鼠发热模型均具有明显的抑制作用,说明它们具有一定的解热作用,并且裂环马钱子苷酸作用效果强于金银花提取物。
3.4 镇痛作用
Kwak WJ[47],An YW[49]等通过小鼠疼痛扭体模型对从金银花忍冬茎中分离鉴定的獐牙菜苷、裂环马钱子苷酸和以环烯醚萜苷类为主要成分的金银花提取物的镇痛作用进行了研究,发现獐牙菜苷、裂环马钱子苷酸和以环烯醚萜苷类为主要成分的金银花提取物具有明显的镇痛作用,且金银花提取物的作用效果略强。
3.5 抗病毒作用
Ma SC[6]等从金银花中共分离鉴定出10 种环烯醚萜类化合物,并采用细胞病变发对化合物的抗呼吸道病毒感染作用进行了研究,包括抗RSV、PIV 3 和Flu A 感染,结果表明,化合物均具有中等强度的抗RSV 和PIV 3 活性,且裂环马钱子苷活性最强,其抗RSV 和抗PIV 3 的SI 分别为10.4 和32.0,抗PIV3 的SI 高于阳性对照药病毒唑(ribavirin)。
4 忍冬属植物中环烯醚萜类化合物的提取与分离
根据对以往报道的环烯醚萜类化合物的分析发现,该类化合物大多是白色结晶或粉末,且化学性质活泼,易与在分离过程中使用的醇类或者其他类溶剂发生化学反应形成新的衍生物[38]。
因环烯醚萜类化合物极性较大,水溶性较好,已有的研究中,对此类化合物的分离一般大极性采用溶剂提取法,如醇(如甲醇、乙醇、水)来作为提取剂。环烯醚萜苷类化合物多数存在于正丁醇部位、苷元存在于乙酸乙酯部位。对于一些量大的环烯醚萜苷,初步柱层析后,通过重结晶即可获得单体化合物,如忍冬中的马钱子苷。对结构相似的成分分离,则需通过进一步的色谱分离,最后通过重结晶等方法纯化后得环烯醚萜苷类纯品。也有文献报道对用有机溶剂或水提取后得到的粗提物,直接经各色谱柱进行分离纯化[32,42]。
例如,Chen J[50]等从忍冬藤中分离环烯醚萜类化合物时,先采用甲醇回流提取,后合并提取液减压浓缩后得到浸膏,对所得浸膏分别用乙酸乙酯和正丁醇进行萃取,正丁醇萃取液合并浓缩加水分散后经D-101 大孔吸附树脂、硅胶柱色谱进行分离,从而得到马钱素和当药苷俩个环烯醚萜类化合物。He QH[39]等对红腺忍冬干燥腾茎用不同浓度的乙醇依次回流提取后,合并提取液浓缩后得浸膏,浸膏用水分散后依次用石油醚、乙酸乙酯和正丁醇分别萃取,并对正丁醇萃取部位通过硅胶柱色谱、高效液相色谱、Sephadex LH-20 凝胶柱分离,再经重结晶,最后得到马钱子、獐牙菜苷等共5 个环烯醚萜类化合物;
Qin SJ[51]对毛花柱忍冬地上部分10 kg 分别用不同浓度的乙醇进行提取,合并提取液并减压浓缩得浸膏,浸膏用水分散后分别用石油醚、乙酸乙酯、正丁醇萃取,取乙酸乙酯萃取液经硅胶柱色谱、聚酰胺柱色谱,及Sephadex LH-20、制备HPLC 分离纯化后得到马钱子苷(200 mg),獐牙菜苷(300 mg),裂环马钱子苷(78 mg)。Kashiwada Y[33]等对金银花蕾用甲醇提取5 次,合并提取液并浓缩,依次用乙酸乙酯和正丁醇萃取,得乙酸乙酯部位、正丁醇部位和水相,水相过HP-20 色谱柱后,再依次经过Sephadex LH-20,MCI gel CHP-20P 等色谱柱及HPLC 分离纯化后,得到Lonicerjaponin A,lonicerjaponin B 等共11个环烯醚萜化合物。
5 忍冬属植物中环烯醚萜类化合物的测定
对忍冬属植物中环烯醚萜类化合物的测定目前主要采用的方法是HPLC 法。Ji RF[52]等用HPLC法对忍冬藤中4 种环烯醚萜苷进行了测定,色谱柱采用Diamonsil C18色谱柱(250 mm×4.6 mm),乙腈(A)-0.05%磷酸水(B)梯度洗脱,0~10 min,10%~14% A;10~35 min,14% A;体积流量1.0 mL/min,检测波长236 nm 柱温30 ℃。Xu D[53]等用HPLC 法对忍冬不同部位的马钱苷含量进行了比较,色谱柱采用Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(16∶84);体积流量:1.0 mL/min;柱温∶室温;检测波长:240 nm。结果发现:忍冬不同部位马钱苷含量相差很大,根>藤>叶>花。Xu TT[54]等对忍冬藤中马钱子苷及当药苷的含量进行了分析研究,采用的HPLC 色谱条件为:色谱柱:Diamonsil C18(250.0 mm ×4.6 mm,5 μm),流动相为乙腈-水(15∶85),流速1 mL/min,柱温:30 ℃,检测波长240 nm,进样量15 μL。结果显示,马钱子苷和当药苷的平均回收率分别为100.6%、99.8%,含量分别为1.5%、2.6%,且不同产地含量会有区别。
环烯醚萜类化合物的分析方法目前已有长足的发展,如液质联用技术、串联质谱分析等,以后在忍冬属植物环烯醚萜类成分的分析中,加强应用这些较先进技术。
6 小结与展望
忍冬属的多种植物在中医中药中有着广泛的应用,从忍冬属植物的根、茎、叶、果实或者花蕾中分离得到的化合物主要有有机酸、黄酮类、皂苷类或者环烯醚萜类,研究表明忍冬属植物具有多种药理药性,但其主要药效成分及其作用机制尚不明确;近年来的研究表明,环烯醚萜类化合物生物活性广泛,并且随着新型结构不断被分离出来,环烯醚萜类化合物新的药理作用也逐渐显现出来。
本文对从忍冬属植物中分离得到的环烯醚萜类化合物结构和可能的生成途径进行了分类总结,并归纳了其药理活性,为忍冬属植物药效成分的进一步研究和开发提供了依据和保障;同时,鉴于目前对忍冬属植物质量标准的争议,在今后的研究中,我们也可将环烯醚萜类化合物放入忍冬属植物的质量标准体系中,通过定性、定量、指纹图谱或者HPLC-MS等多种手段对其进行深入研究,完善忍冬属植物的质量标准。
Yu G[55]等对环烯醚萜类化合物的药理活性研究进展做了系统的分析报道,由其报道可以看出,从其他属植物中分离得到的环烯醚萜类化合物还具有抗肿瘤、增强免疫、舒张冠状血管等作用,而对于从忍冬属植物中分离得到的环烯醚萜类化合物这方面药理活性尚不够,因此,在今后的研究中,我们也可对从忍冬属植物中分离得到的环烯醚萜化合物开展更加广泛和深入的药理活性研究,并明确其构效关系。另外,对于忍冬属植物根、茎、叶、花的疗效中,环烯醚萜类化合物扮演何种角色?作为水溶性成分,它们与忍冬属植物中的黄酮类或皂苷类等化合物的在药理药效方面关系如何?在清热抗炎活性中,环烯醚萜类化合物与木犀草苷等黄酮类成分是否具有协同作用等都值得继续探讨,以期丰富忍冬属植物中环烯醚萜类化合物的药理作用研究。
1 Yu SJ(余守军),Zhu Y(朱英).Advance in studies on chemical constituents of Lonicera.Strait Pharm J(海峡药学),2008,20:1-7.
2 Delectis Florae Reipublicae Popularis Sinicae Agendae,Academiae Sinicae Edita.Beijing:Flora of China,Science Press,Missouri Botanical Garden Press,2011.Vol 19.
3 Yao ZY(姚正阳).Study on physiological and biochemical indies of drounght resisitance of two species in Lonicera L.Huhehaote:Inner Mongolia Agrucultural University(内蒙古农业大学),MSc.2009.
4 Zeng LJ(曾令杰),et al.Preliminary studies on chemotaxonomy of Laprifoliaceae L.Chin Med J(中国中药杂志),2000,25:184-187.
5 Sun MY(孙梦颖),et al.Studies on the chemical constituents from stems and leaves of Lonicera macranthoides.J Chin Med Mater(中药材),2011,34:218-220.
6 Ma S(马双),et al.Antiviral activities of iridoids isolated from Lonicera japonica Thunb.Chin J Pharm Anal,2006,26:1039-1042.
7 Anikina EV,et al.A bitter iridiod glucoside from the fruit of Lonicera caerulea.Khimiya Prirodnykh Soedinenii,1988,4:598-660.
8 Li HJ(李会军),Li P(李萍).Chemical constituents in flower buds of Lonicera japonica thunb.Chem Ind Forest Prod(林产化学与工业),2005,25:29-32.
9 Calis I,et al.Loganin,loganic acid and periclymenoside,a new biosidic ester iridoid glucoside from Loniceva peviclymenum L.(Capvifoliaceae).Helv Chim Acta,1984,67:160-165.
10 Calis I,Sticher O.Periclymenosidic acid,a new biosidic ester iridoid glucoside from Lonicera Coerulea.Helv Chim Acta,1985,48:108-110.
11 Lee JS,et al.7-Feruloylloganin:An iridoid glucoside from stems of Lonicera insularis.Planta Med,2001,67:99-102.
12 Yuan SJ(袁升洁).The isolation and structure elucidation of iridiod compounds from the fruit of Lonicera macckii(Rupr.)Maxim.Jilin:Jilin University(吉林大学),MSc.2007.
13 Wang GS(王广树),et al.Iridoid compounds in the buds of Lonicera Ruprechtiana Regel.Chin J Med Chem(中国药物化学杂志),2009,19:206-208.
14 Bi YF(毕跃峰),et al.Secoiridoid glycosides from Flos Lonicerae.Chi Tradit Herb Drugs(中草药),2008,39:18-21.
15 Chen Y(陈雨),et al.Water-soluble chemical constituents in flower buds of Lonicera macranthoides.Chin Med Mat (中药材),2012,35:231-234.
16 Chaudhuri RK,et al.Structures of two novel monoterpene alkaloid glucosides from Lonicera xylosteum.Tetrahedron Lett,1981,22:559-562.
17 Chaudhuri RK,et al.Xylostosidine:the first of a new class of monoterpene alkaloid glyeosides from Lonicera xylosteum.Helv Chim Acta,1980,63:1045-1047.
18 Bailleul F,et al.Nouvel iridoide des fruits de Lonicera alpigena.J Nat Prod,1981,44:573-575.
19 Aimi N,et al.Kinginoside,a new acyl group carrying iridoid bioside from Lonicera morrowii.Chem Pharm Bull,1993,41:1882-1884.
20 Tomassini L,et al.Isolation of secoiridoid artifacts from Lonicera japonica.J Nat Prod,1995,58:1756-1758.
21 Koichi M,Masao K.An iridoid glucoside from Lonicera caeruea.Phytochemistry,1995,40:603-604.
22 Matsuda N,Kikuchi M.Studies on the constituents Lonicera species IX.Iridiod and secoiridiod glycosides from the leaves of Lonicera gracilipes var.Glandulosa Maxim.Ann.Rep.Tohoku Coll.Pharm,1995,42:109-112.
23 Flamini G,et al.Three new flavonoids and other constituents from Lonicera implexa.J Nat Prod,1997,60:449-452.
24 Qin SJ(秦素娟),et al.Studies on chemical constituents of aerial parts of Lonicera dasystyla Rehd.Chin Pharm J(中国药学杂志),2008,43:662-664.
25 Wang YL,et al.Iridoid glucosides from Chinese herb Lonicera chrysatha and their antitumor activity.J Chem Res,2003:676-677.
26 Kawai H,et al.Iridoid Glucosides from Lonicera japonica Thunb.Chem Pharm Bull,1988,36:3664-3666.
27 Li HJ,et al.A new secoiridoid glucoside from Lonicera japonica.Chin J Nat Med,2003,1:131-133.
28 Prasad D,et al.A new secoiridoid glyco-side from Lonicera angustifolia.Fitoterapia,2000,71:420-424.
29 Kumar S,et al.Iridoid glycosides from Lonicera quinquelocularis.Phytochemistry,2000,53:499-501.
30 Kakuda R,et al.Secoiridoid glycosides from the flower buds of Lonicera japonica.Phytochemistry,2000,55:879-881.
31 Yang Y,et al.Homosecoiridoids from the flower buds of Lonicera japonica.J Nat Prod,2011,74:2151-2160.
32 Wei XS,et al.Pyridinium alkaloid-coupled secoiridoids from the flower buds of Lonicera japonica.J Nat Prod,2008,71:922-925.
33 Kashiwada Y,et al.Conjugates of a secoiridoid glucoside with a phenolic glucoside from the ?ower buds of Lonicera japonica Thunb.Phytochemistry,2013,96:423-429.
34 Ma R(马荣),et al.Chemical constituents from n-butanl extract of the stems of Lonicera japonica.J Chin Pharm Univ(中国药科大学学报),2010,41:333-336.
35 Wang GS(王广树),et al.Chemical constituents in the fruit of Lonicera macckii.Chin J Med Chem (中国药物化学杂志).2010,20:211-213.
36 Ma JL(马俊利),Li JS(李金双).Chemical constituents from leaves of Lonicera macckii.Drugs Clinic(现代药物与临床),2013,28:476-478.
37 Ma JL(马俊利),et al.Studies on iridoid glycosides from leaves of Lonicera japonia.Chin J Exp Tradit Med Form (中国实验方剂学杂志).2011,17:121-123.
38 Whitehead SR,Bowers MD.Iridoid and secoiridoid glycosides in a hybrid complex of bush honeysuckles (Lonicera spp.,Caprifolicaceae):Implications for evolutionary ecology and invasion biology.Phytochemistry,2013,86:57-63.
39 He QH(贺清辉).et al.Study on iridoid glueosides in stems of Lonicera hypoglauca.Chin Pharm J(中国药学杂志),2006,41:656-658.
40 Koichi M,et al.Studies on the constituents of Lonicera species.XVII.new iridoid,glycosides of the stems and leaves of Lonicera japonica Thunb.Chem Pharm Bull,2002,50:1041-1044.
41 Song WX(宋卫霞).Study on the water-soluble chemical constituents of the flower buds of Lonieera japonic.Berjing:Peking Union Medical College(中国协和医科大学),PhD.2008.
42 Wang YL(王玉莉),et al.A 2D NMR study of chrysathain,A new dimeric iridoid glucoside isolated from Lonicera chrysatha.Chin J Magn Reson(波普学杂志),2003,20:137-140.
43 Li HJ(李会军),Li P(李萍).Study on a rare bis-secoiridoid glucoside from flower buds of Lonicera japonica.Chin Pharm J(中国药学杂志),2006,41:817-819.
44 Machida K,et al.Caeruleosides A and B,bis-iridoid glucosides from Lonicera caerulea.Phytochemistry,1995,39:111-114.
45 Kita M,et al.Isolation and structure of korolkoside,a bis-iridoid glucoside from Lonicera Korolkovii.J Nat Prod,2001,64:1090-1092.
46 Song JL,Eun JS.Anti-inflammatory activity of the major constituents of Lonicera japonica.Arch Pharm Res,1995,18:133-135.
47 Kwak WJ,et al.Extraction and purifiction method of active constituents from stem of Lonicera japonic Thunb,Its usage forant-inflamatory and analgesic drug.KR:Wo/ 2004/024172.
48 Su H(苏慧).The studies of active iridoid constituents in the fruit of Lonicera macckii (Rupl.)Maxim.Jilin:Jilin University(吉林大学),MSc.2008.
49 An YW(安玉伟),et al.Honeysuckle extract,its preparation method and application(金银花提取物,其制备方法和应用).CN100575358 C,2009-12-30.
50 Chen J(陈军),Ma SC(马双成).Extraction,separation and identification of loganin and sweroside from Caulis Lonicerae Japonicae.Chin JMAP(中国现代应用药学杂志),2006,23:199-200.
51 Qin SJ(秦素娟),et al.Studies on chemical constituents of aerial parts of Lonicera dasystyla Rehd.Chin Pharm J(中国药学杂志),2008,43:662-664.
52 Ji RF(纪瑞锋),et al.Determination of four iridoid glycosides in Lonicera Japonicae Caulis from different habitat.Drug Eval Res(药物评价研究),2013,36:289-292.
53 Xu D(许丹),Sun WJ(孙文基).The comparison of loganic in the different parts of Lonicera japonic thunb.Chin Med Mat(中药材),2006,29:1138-1139.
54 Xu TT(徐婷婷),Yin L(尹莲).Study on content determination and preparation method of iridoid glycosides in Caulis Lonicerae.Chin med Herald(中国医药导报),2012,9:144-146.
55 Yu G(余鸽),et al.Research progress concerning biological activities of iridoids.Shaanxi Forest Sci Tech (陕西林业科技),2009,69-70.
56 Ji RF(纪瑞锋),et al.Research advances in iridoids from plants of Lonicera Linn.Chin Ttradit Herb Drugs(中草药),2012,43:1226-1232.
