黄芩等三味具有抑菌活性中药的最佳提取工艺研究
2015-01-11彭练慈殷中琼刘明辉
彭练慈,殷中琼,康 帅,曲 径,刘明辉,陈 萍
四川农业大学动物医学院,雅安 625014
无乳链球菌又称B 群链球菌,可引起奶牛乳房炎。目前对于奶牛乳房炎的治疗主要依赖于抗生素,但抗生素容易造成乳汁残留,而且耐药菌株也不断出现[1,2]。中草药具有抗菌、消炎、低毒和细菌不易产生耐药性等特点,从传统中草药中筛选出有效的抗无乳链球菌药物符合食品安全和公共卫生需要。本实验室前期试验结果表明,黄连(Coptidis Rhizoma)、黄芩(Radix Scutellariae)和虎杖(PoLygonum cuspidatum)三味中药的提取物对无乳链球菌有很好的抑菌效果,其抑菌效果明显优于某些抗菌的中药材。为了提高三味中药对无乳链球菌的抑菌活性,本研究对其有效物质的提取工艺进行优化,以便提高各味中药有效物质的产量达到更好的抑菌效果。
黄连为毛茛科植物黄连、三角叶黄连或云连的干燥根茎,具有清热燥湿,泻火解毒等功效[3]。其中主要有效成分是以小檗碱为代表的季铵型生物碱[4],具有抗病毒、抗炎、抗菌、降血糖及免疫调节等作用[5]。因此黄连小檗碱的提取工艺研究对抗菌抗病毒及临床研究有着重大的意义。
黄芩是唇形科植物黄芩的干燥根,具有清热燥湿、泻火解毒、止血、安胎等功效。主要成分是黄酮类化合物,其中黄芩苷、汉黄芩苷[6]、黄芩素等具有抑菌、利尿、抗炎、抗变态作用以及较强的抗癌反应等生理效应[7]。黄芩苷是从黄芩根中分离的一种黄酮类化合物,具有显著的生物活性,如抗氧化、抗菌、抗病毒、抗过敏、调节免疫、降血糖等药理活性[8]。
虎杖为蓼科植物虎杖的干燥根茎及根,具有祛风利湿、散瘀定痛、止咳化痰等功效。虎杖中主要含有蒽醌类和芪类化合物,其中芪类成分白藜芦醇具有抗菌、抗炎、抗癌、抗过敏、降血脂和抗氧化等多方面的药理活性[9]。
目前,在对黄连、黄芩和虎杖三味药的提取工艺研究中,以测定黄连的盐酸小檗碱的含量[10]、黄芩的黄芩苷含量[11]、虎杖的白藜芦醇含量[12]为指标的研究较多,以浸膏得率为指标的提取工艺研究较少,综合文献资料,本研究以提取溶剂浓度、料液比、提取次数、提取时间、提取温度为影响因素,采用正交设计试验,以浸膏得率及对无乳链球菌的最低抑菌浓度(MIC)值和最低杀菌浓度(MBC)为指标,对三味中药提取工艺条件进行优选研究。
1 材料与方法
1.1 材料
1.1.1 中药材
黄连(产地四川,批次:080406)、黄芩(产地陕西,批次:040824)、虎杖(产地四川,批次:081102)3味中药均购于四川雅安惠民堂药业连锁有限责任公司,由四川农业大学药学系副教授范巧佳鉴定为正品。
1.1.2 菌株及培养基
无乳链球菌编号为CVCC1886,购自中国兽药监察所。
加有5% 小牛血清的胰蛋白胨大豆肉汤(TSB),加有5% 小牛血清的胰蛋白胨大豆琼脂(TSA)培养基按照常规方法制作,用于无乳链球菌的培养。
1.1.3 仪器设备和试剂
电热恒温培养箱、超净工作台、旋转蒸发仪、索氏提取器、微量加样器、二甲亚砜、无水乙醇、T 型涂布棒、90mm 玻璃培养皿。
1.2 方法
1.2.1 虎杖、黄芩有效成分提取工艺的正交实验设计
以料液比(A)、乙醇浓度(B)、提取时间(C)及提取温度(D)为考察对象,并根据相关文献[13,14],拟定各因素的三水平(见表1),以提取有效物质的浸膏得率,MIC 值和MBC 值为综合考察指标,选用L9(34)正交试验表进行试验(见表2),从而筛选出最佳的提取工艺。
按规定量称取药物9 份,每份约30 g,分别粉碎并编号1、2、3、4、5、6、7、8、9,精确称量9 份药物粉末,将精确称量后的各药物粉末于溶媒中加热回流提取,为充分提取,每组都提取3 次,合并滤液并浓缩滤液至糊状,放入55 ℃烘箱中3 d,直至烘干到恒重浸膏状态,称重并计算得率,封存备用,分别重复9 次。
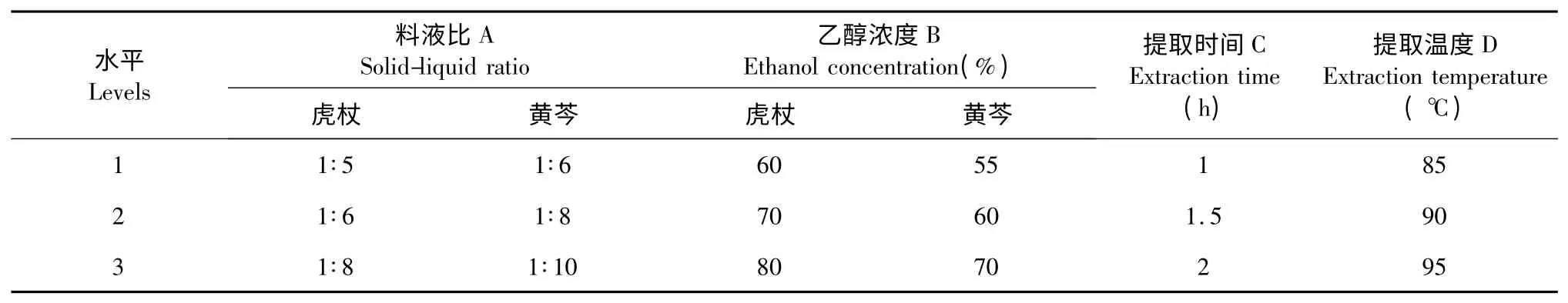
表1 虎杖、黄芩因素水平表Table 1 Factors and levels of the extraction conditions in extracting P.cuspidatum and Radix Scutellariae
1.2.2 黄连有效成分提取工艺的正交实验设计
以料液比(A)、乙醇浓度(B)、提取时间(C)及提取次数(D)为考察对象,并根据相关文献[15],拟定各因素的三水平(见表2),以提取有效物质的浸膏得率,MIC 值和MBC 值为综合考察指标,选用L9(34)正交试验表进行试验(见表2),从而筛选出最佳的提取工艺。
按规定量称取药物9 份,每份约30 g,分别粉碎并编号1、2、3、4、5、6、7、8、9,精确称量9 份药物粉末,将精确称量后的各药物粉末于溶媒中加热回流提取,合并滤液并浓缩滤液至糊状,放入55 ℃烘箱中3 d,直至烘干到恒重浸膏状态,称重并计算得率,封存备用,分别重复9 次。

表2 黄连因素水平表Table 2 Factors and levels of the extraction conditions in extracting Coptidis Rhizoma
1.2.3 正交试验中药有效成分的体外抑菌活性实验
1.2.3.1 细菌菌悬液的制备
挑取新鲜培养无乳链球菌的单个典型菌落接种于3 mL 的TSB 肉汤培养基中,置于37 ℃恒温摇床中培养18~24 h 后取出。吸取菌液0.5mL,用生理盐水作10-1梯度稀释,取10-7、10-8、10-9三个梯度的菌液0.1 mL 分别在6 个TSA 培养基上均匀摊开,放入37 ℃恒温培养箱中培养18~24 h。计算出原液的细菌个数为1.60×1011CFU/mL。
临用前将菌液用液体培养基稀释成菌液浓度为1.60×107CFU/mL。
1.2.3.2 药液的制备
精确称取各正交试验的中药有效部位提取物浸膏溶于蒸馏水中,配制成生药浓度为1 g/mL 的溶液,100 ℃流通蒸汽灭菌30 min,置于4 ℃冰箱备用。
1.2.3.3 药敏实验
采用试管2 倍稀释法,取20 支灭菌试管,分为第一组和第二组,每组9 支。20 管分别加TSB 肉汤1 mL。在两组的第1 管分别加1 mL 药液,混匀后吸取1 mL 至第2 管中,依次类推,直至第9 管,第9 管吸取1 mL 弃去。向第一组的9 支试管加0.1 mL 的稀释菌液,另一组9 支试管不加细菌,加0.1 mL 生理盐水作为阴性对照组。第19 管不加药液加0.1 mL 细菌作为阳性对照,第20 管不加药液和细菌作为空白对照。则两组的第1 管至第9 管的药液浓度依次为500.00、250.00、125.00、62.50、31.25、15.60 mg/mL、7.80、3.90、1.95 mg/mL。置于37 ℃恒温摇床中培养18~24 h。以无菌生长的最低稀释度为最小抑菌浓度(MIC)。
观察药物MIC 以上未见细菌生长的各管培养物,分别各取0.1 mL 移至不含药的TSA 琼脂平皿上,轻轻推开药液,置37 ℃培养过夜,观察有无细菌生长。按一般规定,平皿培养基中,计数少于5 个菌落者作为该药的最低杀菌浓度(MBC)。
1.2.4 最佳提取工艺下各味中药提取物的体外抑菌活性试验
按照“1.2.3”中的试验方法,将筛选出的各味中药在最佳提取工艺下的有效物质进行体外抑菌活性的验证。
2 实验结果
2.1 虎杖最佳提取工艺的优选
按照正交实验设计的提取方法对虎杖进行有效物质的提取,得到9 份虎杖有效提取物。通过对虎杖提取物各浸膏得率的计算及提取物对无乳链球菌MIC 值和MBC 值的测试,结果见表3 和表4。
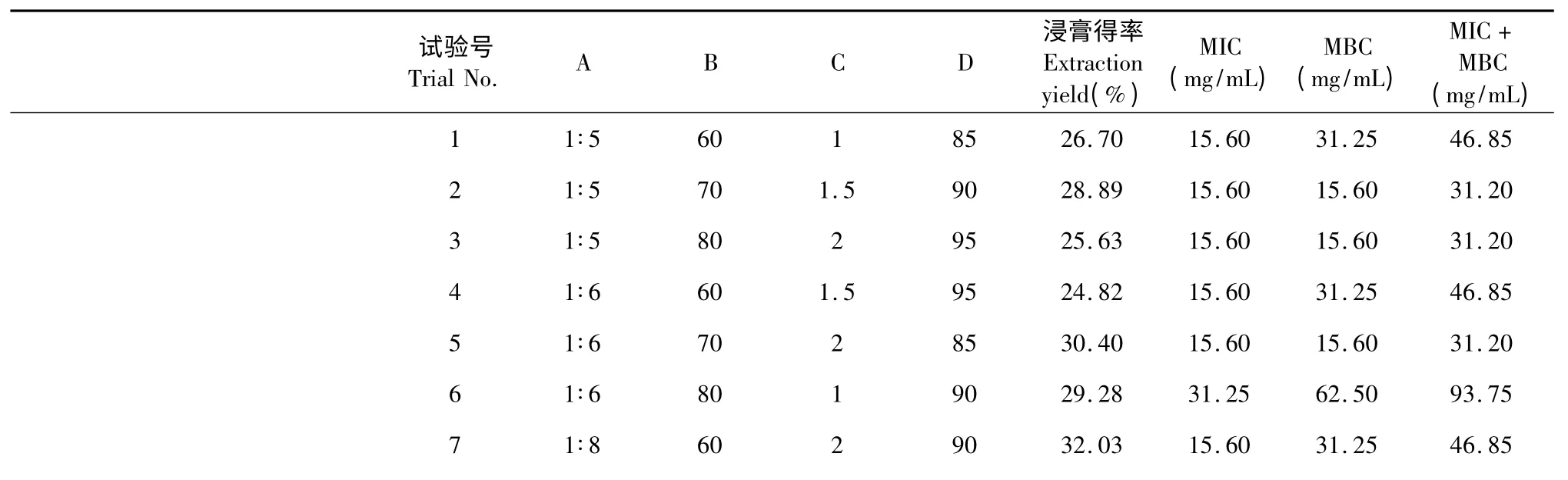
表3 以浸膏得率和MIC 值与MBC 值之和为指标的试验L9(34)直观分析Table 3 The results of L9(34)tests by taking extraction yield and the sum of MIC and MBC as indexes

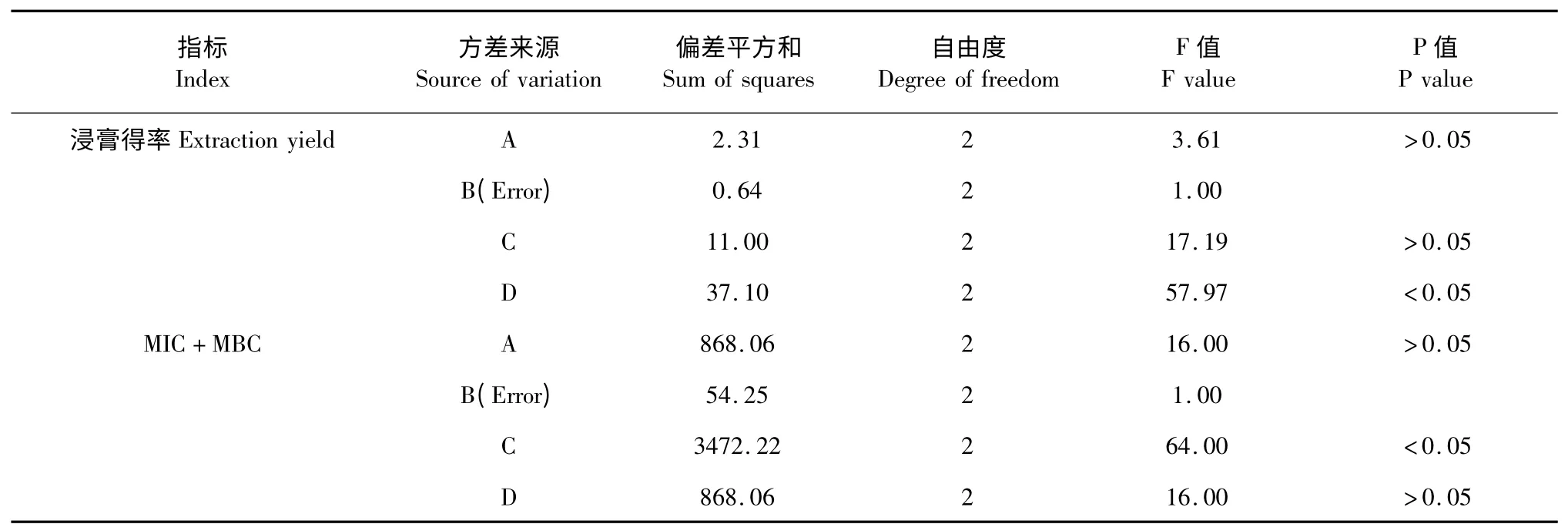
表4 以浸膏得率和MIC 值与MBC 值之和为指标的试验L9(34)的方差分析Table 4 The variance analysis results of L9(34)tests by taking extraction yield and the sum of MIC and MBC as indexes
4 个因素对虎杖提取物浸膏得率的影响大小顺序为D>C>A>B,最优水平组合为A2B2C3D2,即料液比为1∶6,乙醇浓度为70%,提取温度95 ℃,一次2 h,提取3 次。对MIC、MBC 之和的影响顺序为C>A=D>B,使MIC、MBC 之和最小的最优水平为A1B1C2,3D1,即料液比为1∶5,乙醇浓度为60%,提取温度85 ℃,一次提取1.5 或2 h,共提取3 次。
温度对提取物浸膏得率的影响显著,提取时间对MIC、MBC 之和的影响显著。以浸膏得率,MIC、MBC 之和为指标时所得工艺的差异因素都是乙醇浓度,且料液比、乙醇浓度对其影响都不大,为节约成本,将料液比设定为1∶5,乙醇浓度为60%。温度对浸膏得率的影响显著,对MIC、MBC 之和的影响不大,所以设定温度为95 ℃。为提取充分,将时间设定为2 h。所以筛选虎杖的最优水平为A1B1C3D3,即料液比为1∶5,乙醇浓度为60%,提取温度为95 ℃,一次2 h,共提取3 次。
2.2 黄芩最佳提取工艺的优选
按照正交实验设计的提取方法对黄芩进行有效物质的提取,得到9 份黄芩有效提取物。通过对黄芩提取物各浸膏得率的计算及提取物对无乳链球菌MIC 值和MBC 值的研究,结果见表5 和表6。

表5 以浸膏得率和MIC 值与MBC 值之和为指标的试验L9(34)直观分析Table 5 The results of L9(34)tests by taking extraction yield and the sum of MIC and MBC as indexes
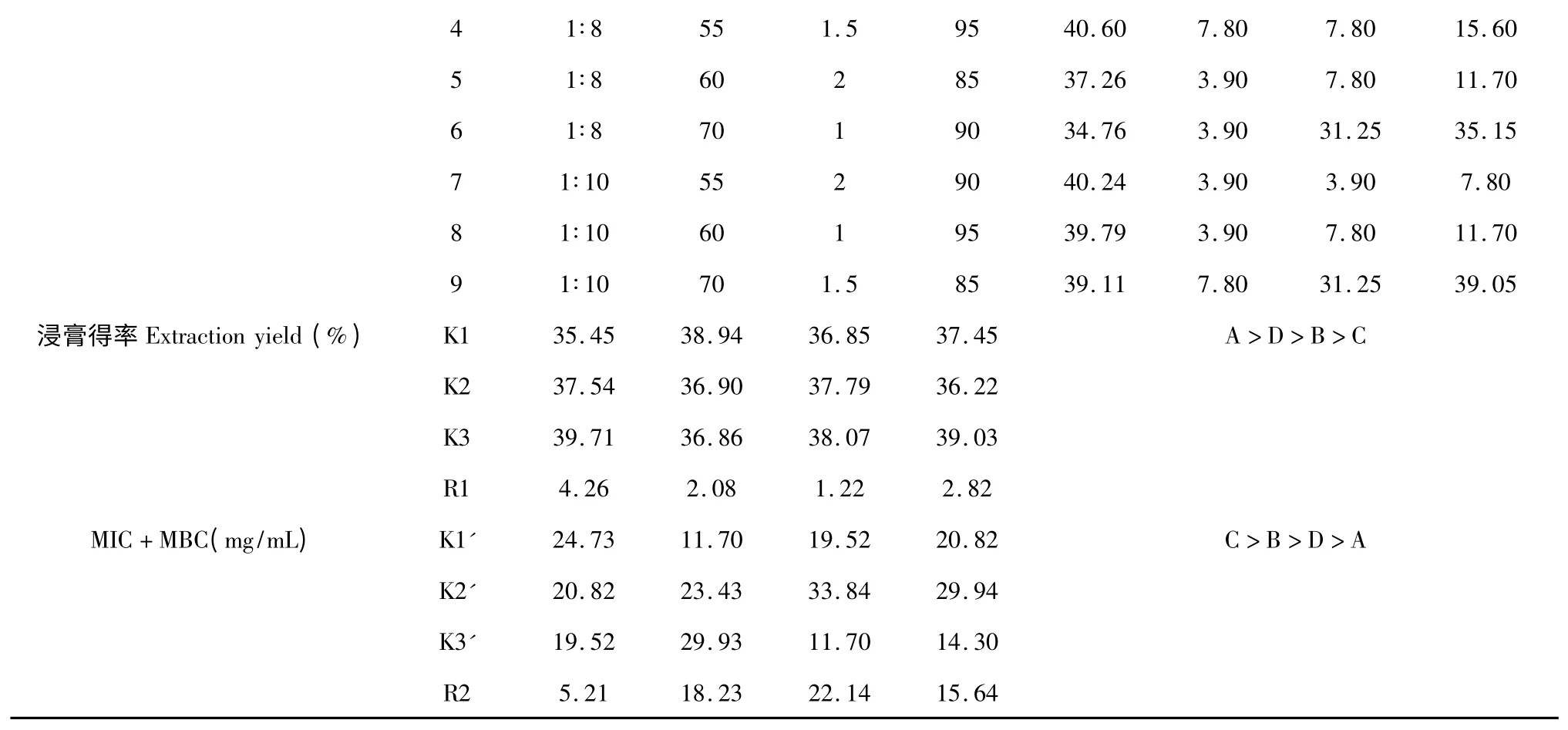
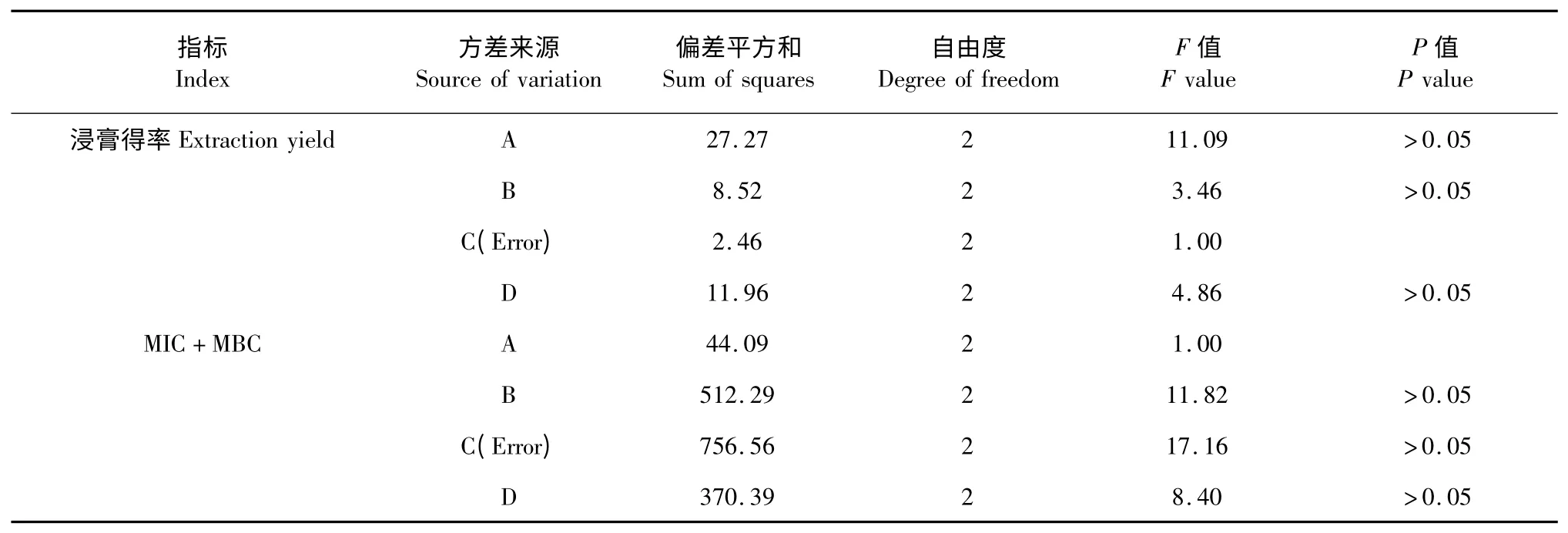
表6 以浸膏得率和MIC 值与MBC 值之和为指标的试验L9(34)的方差分析Table 6 Analysis of variance of L9(34)tests by taking extraction yield and the sum of MIC and MBC as indexes
4 个因素对黄芩提取物浸膏得率的影响大小顺序为A>D>B>C,最优水平组合为A3B1C3D3,即料液比为1∶10,乙醇浓度为55%,提取温度为95℃,一次提取2 h,共提取3 次。对MIC、MBC 之和的影响顺序为C>B>D>A,使MIC、MBC 之和最小最优水平组合为A3B1C3D3,即料液比为1∶10,乙醇浓度为55%,提取温度为95 ℃,一次提取2 h,共提取3 次。
4 个因素对黄芩提取物浸膏得率及MIC、MBC之和的影响均不显著,所以筛选黄芩的最优组合为A3B1C3D3,即料液比为1∶10,乙醇浓度为55%,提取温度为95 ℃,一次提取2 h,共提取3 次。
2.3 黄连最佳提取工艺的优选
按照正交实验设计的提取方法对黄连进行有效物质的提取,得到9 份黄连有效提取物。通过对黄连提取物各浸膏得率的计算及提取物对无乳链球菌MIC 值和MBC 值的研究,结果见表7 和表8。

表7 以浸膏得率和MIC 值与MBC 值之和为指标的试验L9(34)直观分析Table 7 The results of L9(34)tests by taking extract yield and the sum of MIC and MBC as indexes
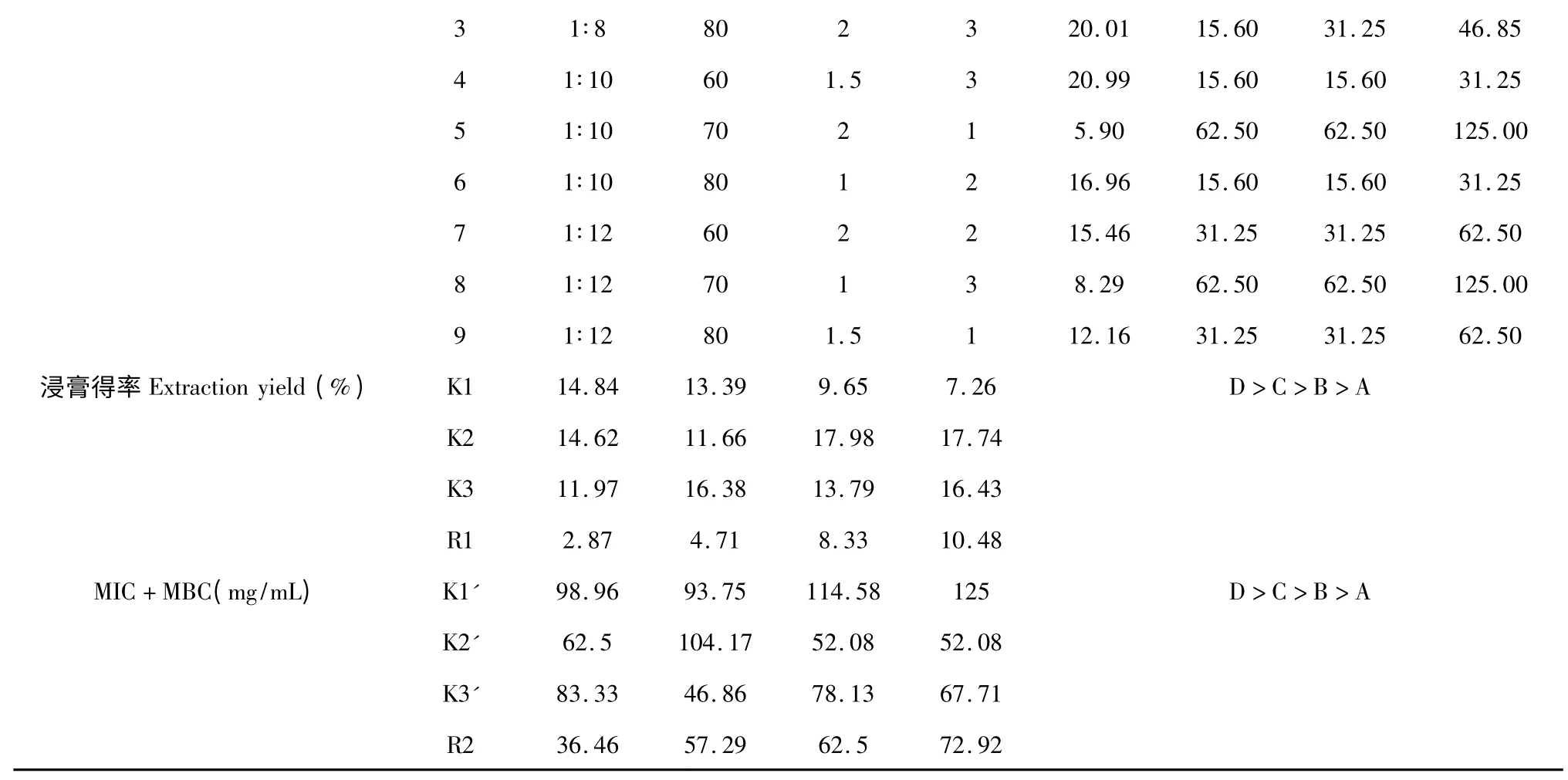
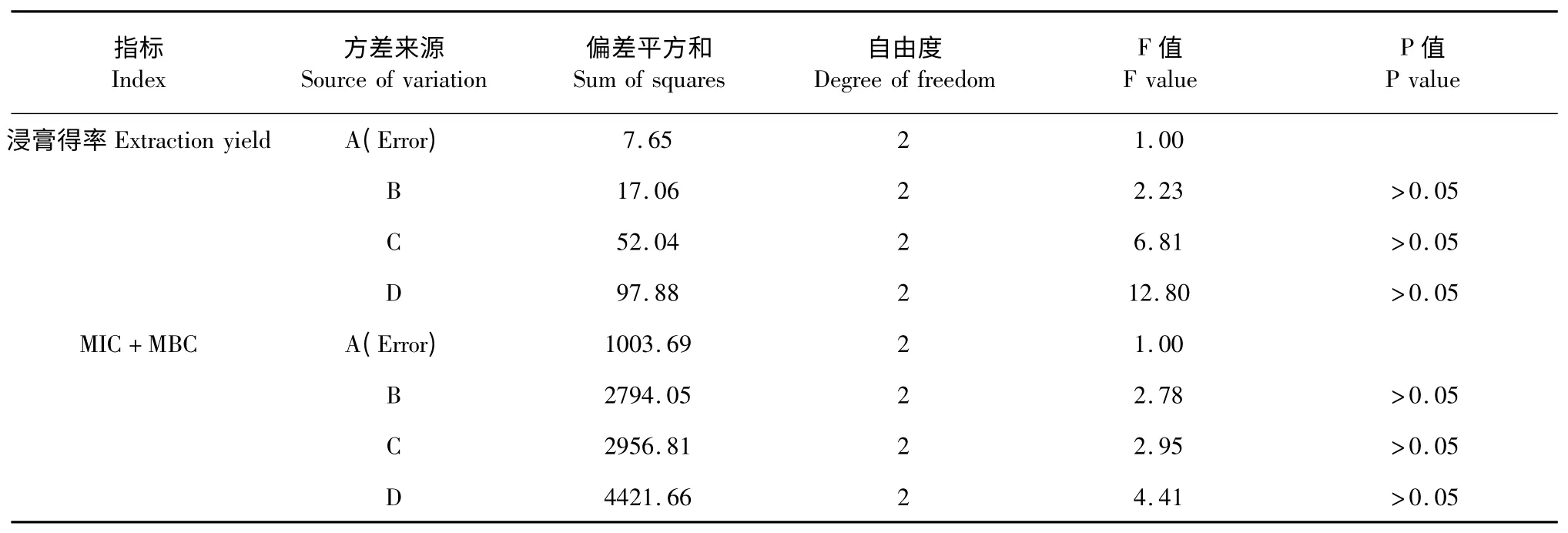
表8 以浸膏得率和MIC 值与MBC 值之和为指标的试验L9(34)的方差分析Table 8 Analysis of variance of L9(34)tests by taking extract yield and the sum of MIC and MBC as indexes
4 个因素对黄连提取物浸膏得率和MIC、MBC之和的影响大小顺序为D>C>B>A,以得率为指标的最优水平组合为A1B3C2D2,即料液比1∶8,乙醇浓度80%,1.5 h 一次,提取2 次。以MIC、MBC 之和最小为指标的最优水平组合为A2B3C2D2,即料液比为1∶10,乙醇浓度80%,1.5 h 一次,提取2 次。
4 个因素对黄芩提取物浸膏得率及MIC、MBC之和的影响均不显著,以浸膏得率,MIC、MBC 之和为指标时所得工艺的差异因素都是料液比,料液比对浸膏影响很小,为节约成本,将料液比设定为1∶8。所以选择黄连的最优水平为A1B3C2D2,即料液比为1∶8,乙醇浓度80%,1.5 h 一次,提取2 次。
2.4 在最佳提取工艺下各味中药提取物的体外抑菌活性
3 味中药在本研究筛选出的最佳提取工艺下得到的浸膏物质对无乳链球菌的MIC、MBC 值3 次结果的平均值见表9。
3 讨论
黄连、黄芩、虎杖具有良好的抗无乳链球菌作用。文献中对中药材提取方法的选择不尽相同,通常只会选择一种提取方式。中药化学成分非常复杂,抗菌成分也多种多样,不同的提取方式会提取出不同的成分,同时抑菌效果也会不尽相同。在影响中药提取质量的系列因素中,溶媒量、提取时间、提取次数为主要因素。所以本研究采用正交设计实验,综合考虑溶剂浓度、料液比、提取次数、提取时间、提取温度5 种因素对3 种中药有效物质提取质量的影响效果。在正交试验设计中,黄芩和虎杖均提取3 次,使其中药里的成分得到了充分的提取。
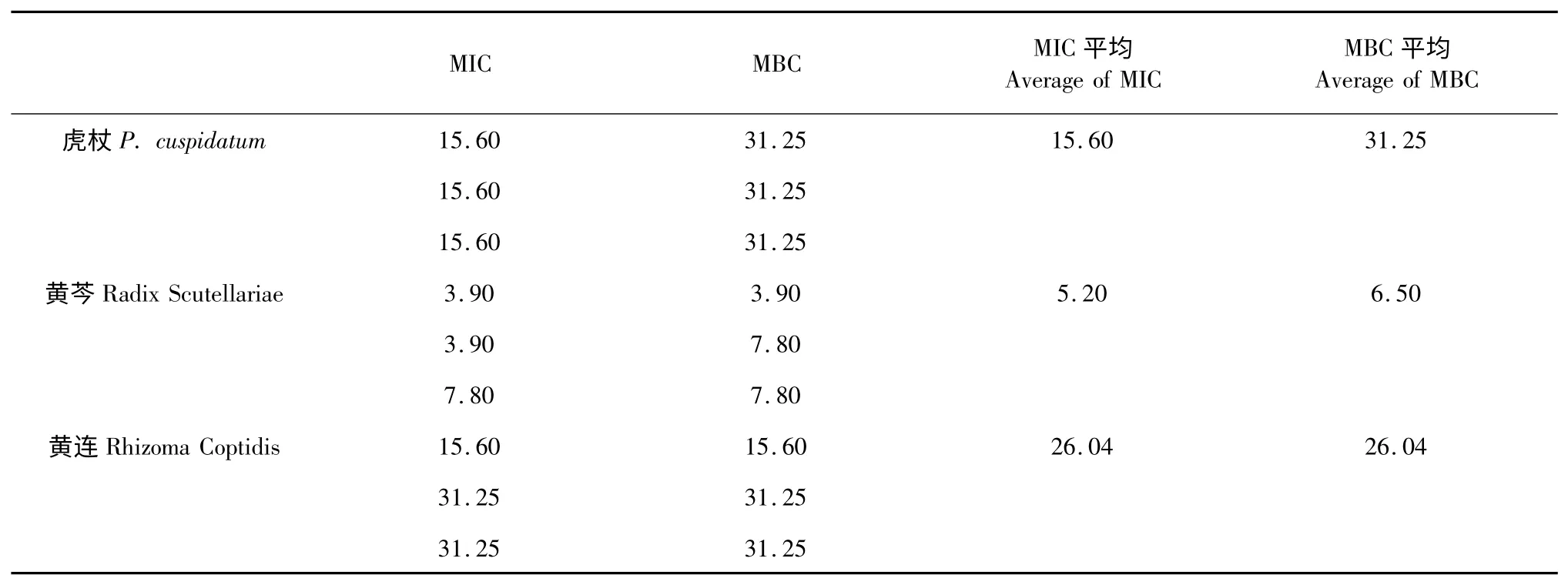
表9 最佳提取工艺下的3 中药对无乳链球菌的MIC 值和MBC 值(单位:mg/mL)Table 9 The MIC and MBC against S.agalactiae under the optimal extraction conditions of 3 traditional Chinese medicines(unit:mg/mL)
黄连、黄芩和虎杖有效物质最佳提取工艺较严格的选择标准为高效液相色谱法分别定量测定其中单一有效物质含量[10-12]。但本研究不是为了提取分离所得到的有效物质,只为从少量的原料药材中得到更多的抑菌效果好的有效物质,因而便以浓缩蒸干之后的浸膏得率及其最低抑菌浓度值(MIC)和最低杀菌浓度值(MBC)为综合评价指标,从中筛选出抑菌活性优异的提取方法及条件。MIC 值和MBC 值是评价药物对细菌抑菌效果的有效指标,MIC、MBC 值之和越小,其抑菌效果越好。
据文献报道,按照一般的提取方法,黄连、黄芩和虎杖对无乳链球菌的MIC 分别为31.25、7.8 0、15.60 mg/mL[16]。在本研究中,黄连的MIC 和MBC值均为26.04 mg/mL,黄芩的MIC 和MBC 值为5.20、6.50 mg/mL。虎杖正交试验的药敏实验结果中,MIC 值的范围为15.60~31.25 mg/mL,MBC 值的范围是15.60~62.50 mg/mL,验证试验中虎杖的MIC 值为15.60 mg/mL,MBC 值在15.60~62.50 mg/mL 范围内。说明黄连、黄芩、虎杖在最佳提取工艺下的有效物质抑菌效果明显强于一般提取工艺的有效物质。因此,筛选出的抗无乳链球菌的最佳提取工艺的提取方法可行,且简便易行的评价方法也为以后的中药提取研究扩宽了方向,值得推广使用。
1 Ni CX(倪春霞),Pu WX(蒲万霞),Hu YH(胡永浩),et al.Isolation,identification and drug sensitive test of pathogenic bactcria causing dairy cattle mastitis.Acta Agric Boreala-occidentalis Sin(西北农林学报),2010,19(2):20-24.
2 Yang R(杨锐),Li YL(李英伦),Li JL(李金良),et al.Isolation,identification and drug sensitive test of pathogenic bactcria causing clinical dairy cattle mastitis in Sichuan ya'an.Chin J Veterin Med(中国兽医杂志),2009,45(4):41-42.
3 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol Ⅰ,213.
4 Kuang HX(匡海学).Chinese Medicine Chemistry(中药化学).Beijing:China Traditional Medicine Press,2003.55-57
5 Cui XJ(崔学军).The research progress and clinical pharmacology of berberine.Lishizhen Med Mater Med Res(时珍国医国药),2006,17:1131-1312.
6 Wu SJ,Sun AL,Liu RM.Separation and purification of baicalin and wogonoside from the Chinese medicinal plant Scutellaria baicalensis georgi by high-speed counter-current chromatography.J Chromatogr A,2005,1066:243-247.
7 Chi R,Zhou F,Huang K,et al.Separation of baicalin from scutellaria baicalensis georgi with polyamide.Cent South Univ Technol,2008,15:606-607.
8 Wang ZH(王忠壮),Hu JH(胡晋红).Modern Chinese Materia Medica(现代中药学).Shanghai:The Second Military Medical University Press,2006.357.
9 Huang YF(黄远芬),Li BB(李蓓蓓),Luo XS(罗宵山).Pharmacological research progress of Polygonum cuspidatum and its effective ingredients.Guangdong Pharmacol J(广东药学),2000,10(6):13-15.
10 Huang JW(黄家为),Sheng ZH(盛振华).Study on extraction of berberine from Coptidis Rhizoma.Chin Arch Tradit Chin Med(中华中医药刊),2011,29:528-530.
11 Shi JY(石俊英),Zhang XW(张小伟),Zhang HM(张会敏).Orthogonal test for optimization of extraction and purification process for baicalin.J Shangdong Univ TCM(山东中医药大学学报),2008,32:413-415.
12 Xiang HY(向海艳),Zhou CS(周春山),Zhong SA(钟世安).Extraction process of resvertrol from Polygonum cuspidatum.J Chet South Univ,Sci Technol(中南大学学报,自科版),2004,35:965-969.
13 Liu D(刘丹),Tang HF(汤海峰),Zhang SQ(张三奇),et al.The optimization of extraction process for effective ingredients in Polygonum cuspidatum.Chin Tradit Patent Med(中成药),2007,29:516-521.
14 Shi GF(史高峰),Zhang XQ(张兴潜),Zhu JJ(祝娟娟),et al.The optimized extraction technology of total flavonoids from Radix Scutellariae.Appl Chem Ind(应用化学),2011,40:1973-1975.
15 Wang K(汪坤),Zhang ZL(张振凌),Jia XM(贾秀梅).Optimization of extraction technology of Coptidis Rhizoma with multi-components quantitation by one marker.Chin J Exp Tradit Med Form(中国实验方剂杂志),2011,17(24):9-11.
16 Peng LC(彭练慈),Yin ZQ(殷中琼),Jia RY(贾仁勇),et al.Effects of twenty traditional Chinese medicine extracts against Streptococcus agalactiae in vitro.J South China Agric Univ(华南农业大学学报),2014,35(4):22-25.
