邻苯二甲酸二辛酯合成热力学及动力学研究
2015-01-07李双成奚桢浩
李双成,奚桢浩,赵 玲
华东理工大学化学工程联合国家重点实验室,上海 200237
邻苯二甲酸二辛酯合成热力学及动力学研究
李双成,奚桢浩,赵 玲
华东理工大学化学工程联合国家重点实验室,上海 200237
邻苯二甲酸二辛酯(DOP)的合成过程分苯酐(PA)和异辛醇(2-EH)反应生成邻苯二甲酸单辛酯(MEHP)、MEHP和2-EH反应生成DOP两步进行,其中后一步是关键控制步骤。针对MEHP和2-EH之间的可逆反应,采用基团贡献法对反应焓变和熵变进行了理论计算;并采用间歇实验测定了无外加催化剂条件下的反应平衡和易挥发组分2-EH与水的汽液平衡,以及以钛酸四丁酯为催化剂的反应动力学。通过热力学实验确定了433.15~493.15 K时反应平衡常数为4.79~8.93,回归得到的反应焓为17.91 kJ/mol、反应熵为54.64 J/(K·mol),与基团贡献法计算值基本相符;活度系数Redlich-Kister方程能较好地关联2-EH和水的汽液平衡数据。动力学研究结果表明高转化率下DOP水解反应影响不可忽略,MEHP和2-EH间的正、逆反应都符合二级反应规律,回归得到453.15~493.15 K时正反应活化能为83.49 kJ/mol,指前因子为1.75×107kg/(mol·min)。
邻苯二甲酸二辛酯 邻苯二甲酸单辛酯 异辛醇 基团贡献法 反应动力学
邻苯二甲酸二辛酯(DOP)是一种带有支链的侧链醇酯,是使用最为广泛的一种增塑剂,常用于手套、管道以及装饰件等聚氯乙烯制品,主要作用是削弱聚氯乙烯分子间的作用力,降低软化温度,增加流动性,改善加工性能,提高制品柔韧性。随着需求量的增加,国内DOP产能已超过每年300万吨[1],并出现年产十万吨级的大规模生产装置[2]。
DOP的合成分两步进行[3]:第一步苯酐(PA)和异辛醇(2-EH)反应生成邻苯二甲酸单辛酯(MEHP),由于PA苯环具有张力,反应性极强,醇进攻PA开环的反应十分迅速,在373.15~393.15 K下不需要催化剂就可快速完成;第二步MEHP和2-EH反应生成DOP,是可逆反应,由于—COOC8H17基团引入的位阻效应以及该基团对苯环的钝化作用,对2-EH进攻第二羰基碳造成困难,故这一步反应较慢,所需温度较高并需要适当的催化剂降低反应活化能,是整个反应过程的控制步骤,因此对DOP合成过程的实验研究均集中于此反应。
DOP合成反应有酸催化和非酸催化两类,其中钛酸酯类非酸催化剂由于活性适中,副反应很少,产品色值好,80年代后在工业生产中广泛应用。关于MEHP和2-EH反应生成DOP这一可逆反应的热力学和动力学研究报道比较片面,不同温度下的反应平衡常数未见报道;动力学模型最具代表性的工作是Skrzypek等发表的系列报道[4-7],认为此反应的反应级数取决于所采用的催化剂,催化剂为钛酸四丁酯时该反应为二级反应[6],但实验过程采用高流量氮气吹扫,认为体系中不存在水,因此仅考虑MEHP和2-EH生成DOP的正反应、不考虑DOP水解这一逆反应。但目前DOP工业生产过程要求MEHP转化率能达到99.5%以上,如应用最为广泛的BASF工艺[8]采用了温度逐渐升高的五釜串联连续工艺,五个反应釜大小一样并共用同一个精馏塔以实现醇水的分离,220 ℃下第四个釜MEHP转化率从98.15%上升到99.58%,230 ℃下第五个釜MEHP转化率从99.58%上升到99.83%,所需停留时间基本相同,按照CSTR模型通过核算发现不考虑逆反应的简单二级反应规律已不适用,这主要因为反应釜内液相水含量与反应釜内传质和精馏塔分离效率密切相关,不可能达到零,即在高转化率的反应后期DOP水解这一逆反应的影响无法忽略。因此获得完整可靠的DOP合成反应的热力学和动力学数据对该过程达到高转化率的工艺优化和控制至关重要。
在工业反应温度范围内,本研究首先利用基团贡献法对DOP合成的两步反应的焓变和熵变进行了理论计算,再通过密闭系统实验测定了体系达到平衡状态时的汽液两相组成,回归得到关键反应的焓变和熵变,并与基团贡献法计算所得数据进行了对比;另外利用Redlich-Kister活度系数方程对体系中易挥发组分2-EH与水的汽液平衡组成进行关联。最后以钛酸四丁酯为催化剂,在考虑逆反应的条件下对MEHP和2-EH反应动力学进行了研究,得到相关动力学模型参数。
1 基团贡献法计算[9]
在Benson法中,标准状态下理想气体物质的生成焓ΔfHθm(g)和熵Sθ(g)由式(1)和式(2)计算:

Nk为基团k的个数,为各基团对生成焓和熵的贡献值。求标准状态下理想气体物质的生成焓可以直接把Benson基团值相加,求熵时则需要把分子的对称性考虑在内,对称熵SS与温度无关,由式(3)计算:

式中Noi是光学异构体数,Nts是总的对称数,R是气体常数。利用Benson法计算得到的标准状态下气体物质的生成焓和熵见表1。

表1 标准状态下气体物质的生成焓和熵Table 1 Values of formation entropy and enthalpy for gases at standard temperature and pressure

标准状态下的蒸发焓ΔHθV可采用Ducros基团贡献法进行计算,计算公式如下:


式中Tb为有机物常压下的沸点。对于醇和酸A和B分别取390.2,-873.3 J/(mol·K);对于酯类物质A和B分别取125.4,-222.4 J/(mol·K)。进而利用Benson和Ducros法结合蒸发熵的经验关联式计算得到标准状态下各液态组分的生成焓和熵见表2。有机物的摩尔生成焓和摩尔熵与温度和热容存在以下关系:
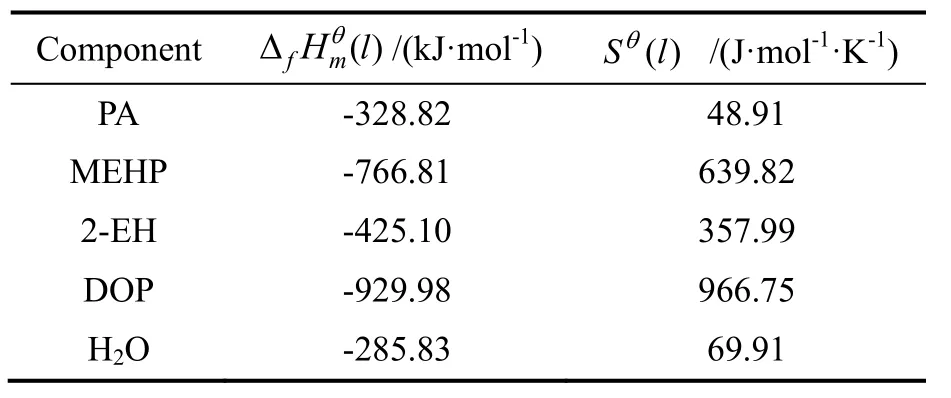
表2 标准状态下液体物质的生成焓和熵Table 2 Values of formation entropy and enthalpy for liquids at standard temperature and pressure

液态有机物的热容是温度的函数,可采用Ruzicka-Domalski基团贡献法计算,计算公式如下:
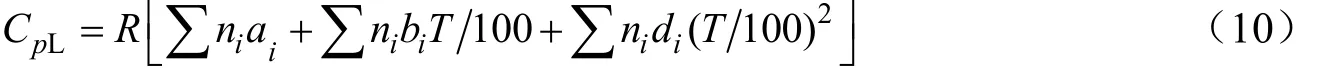
计算得到的各液态组分热容的表达式见表3,其中水的热容[75.20~75.89 J/(mol·K)]和水蒸汽的热容[33.72~34.83 J/(mol·K)]在计算范围内随温度变化很小,可取其平均值进行计算;当反应温度超过373.15 K时,水发生相变,需结合水的蒸发焓分两段进行计算。
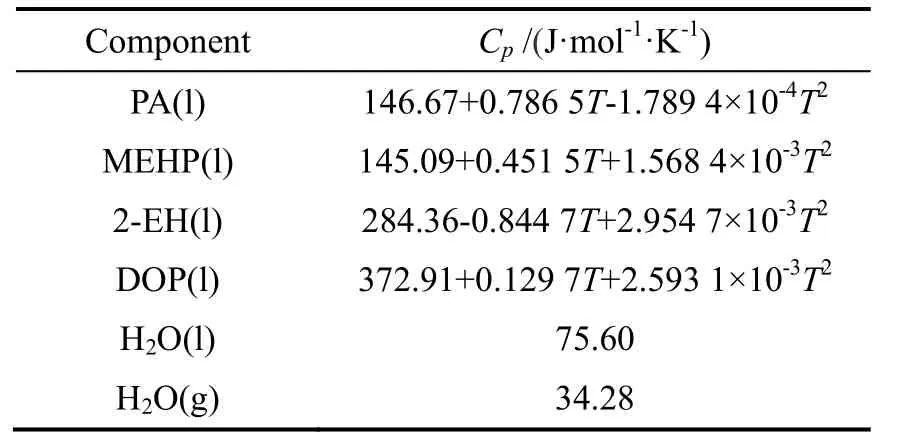
表3 热容与温度的关系Table 3 Correlation of heat capacity and temperature
根据上述热力学关系,分别对DOP合成过程的第一步和第二步反应进行计算,结果见表4和表5。从表4可以看出,第一步反应为熵增加的放热反应,在298.15~493.15 K温度内,反应平衡常数很大,是不可逆反应。从表5可以看出,随着反应温度的升高,第二步反应的反应焓和反应熵随之增大,433.15~493.15 K内,反应焓平均值为21.82 kJ/mol,反应熵平均值为55.04 J/(K·mol),为熵增加的吸热反应。

表4 第一步反应焓变和熵变计算值Table 4 Estimates values of reaction entropy and enthalpy for the first reaction
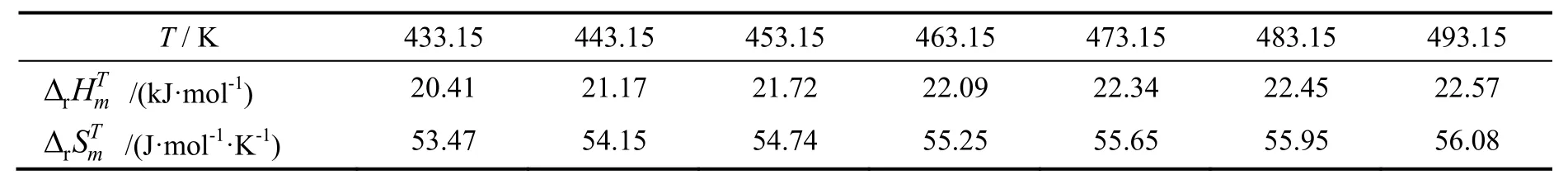
表5 第二步反应焓变和熵变计算值Table 5 Estimates values of reaction entropy and enthalpy for the second reaction
2 实验部分
2.1 实验设计与数据处理
PA和2-EH合成DOP的两步反应如下:
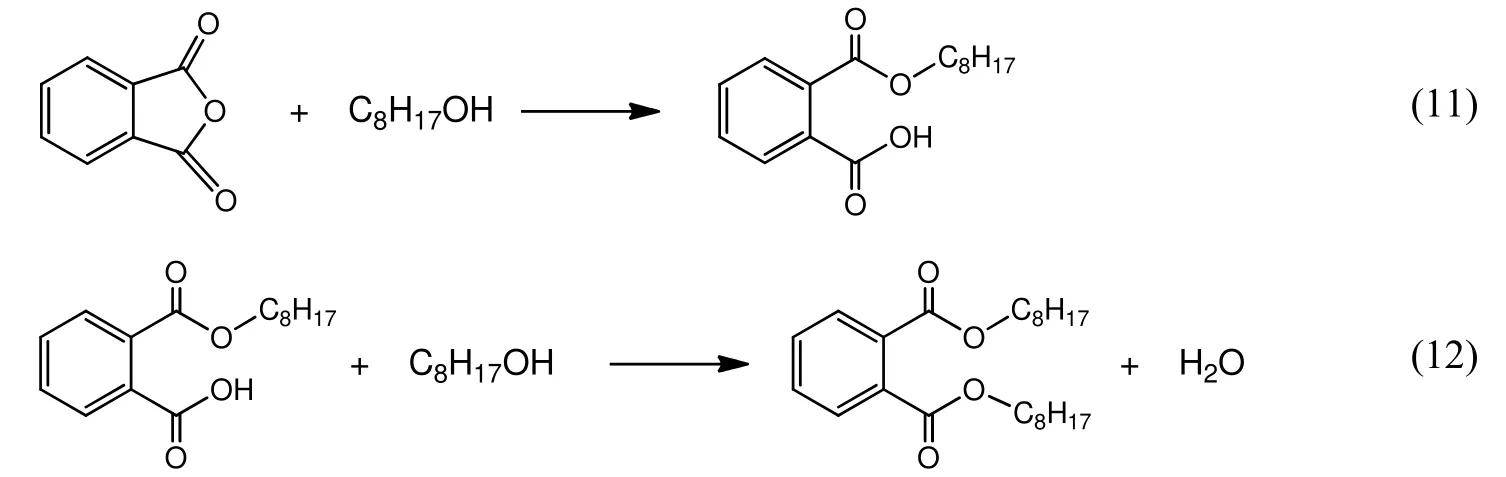
第一步反应在升温过程中即可完成。根据文献报道,非酸催化时第二步MEHP和2-EH生成DOP的正反应为二级反应[6,7];逆反应DOP的水解这也可以按二级反应处理[10],因为已有大量文献报道酯基水解反应为二级反应[11-13]。
当体系为密闭系统时,反应足够长时间后体系汽液组成不再变化,同时达到了第二步反应的反应平衡和汽液相平衡,液相包括第二步反应涉及的MEHP(A),2-EH(B),DOP(C)和水(D)四个组分,平衡时浓度C*,于是反应平衡常数为:

结合热力学关系可进一步得到该反应的焓变和熵变:

MEHP和DOP常压下的沸点分别为682.15 K和613.15 K,远高于水(373.15 K)和2-EH(462.15 K)的沸点,在实验条件范围内(433.15 K≤T≤493.15 K,0.26 MPa≤P≤0.69 MPa),MEHP和DOP气相分压极小,气相可近似认为仅有水和2-EH两组分:

2-EH和水满足汽液平衡方程:

式中,P为平衡时体系总压力,P*为饱和蒸汽压,可通过Antoine方程计算:

活度系数采用经验模型Redlich-Kister方程描述[14]:
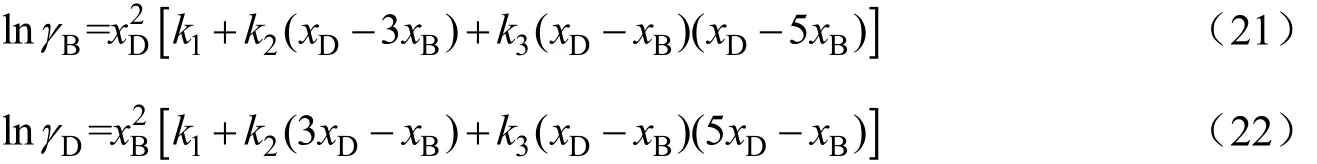
其中模型参数k1、k2、k3由实验数据回归得出。
在考虑逆反应的情况下,MEHP与2-EH的反应动力学表达式为:

令cAcB-cCcDK=M,上式可简化为:

在一定反应温度下,(-rA)对M作图所得直线斜率即为正反应的反应速率常数k,再根据Arrhenius方程可进一步得到活化能Ea和指前因子k0。

根据反应速率常数k和平衡常数K可得到逆反应的反应速率常数为k/K。
2.2 实验过程
热力学实验在间歇密闭系统中进行。2-EH和PA按物质的量比2.5:1一次性投入1 000 mL的反应釜,氮气吹扫,将反应釜密封后置于油浴中,开启磁力搅拌并升温至反应温度(160~220 ℃),控制反应釜上方的气相收集器及连接管路温度与反应器温度一致。反应足够长时间后(160 ℃下预实验发现大于25 h即可),反应釜内压力及各组分浓度不再变化,反应和系统达到平衡,此时关闭气相收集器连接阀,利用液相取样器对反应釜液相取样分析,气相部分经冷凝后取样分析。热力学实验结果均为两次重复实验的平均值,两次重复实验中各组分相对偏差最大在5%之内。
动力学实验在间歇开放系统中进行。2-EH和PA按物质的量比2.5:1一次性投入带有分离冷凝回流的500 mL三口烧瓶,氮气吹扫后开启磁力搅拌并升温至反应温度180~220 ℃,加入0.8%的催化剂钛酸四丁酯(以2-EH和PA总质量为基准),在消除传质影响的高搅拌转速下继续反应,并控制分离塔顶温度为383.15 K以保证水能及时从体系逸出从而达到高转化率,对不同反应时刻的液相体系进行取样分析,为了忽略由于水逸出引起的反应体积变化影响各组分摩尔浓度以单位重量为基准表示。
2.3 分析方法
羧基浓度测定方法参照GB/T2708-1995,使用ZDJ-4A自动电位滴定仪测定;水含量测定方法参照GB/T 12008.6-1989,采用METTLER V20微量水分析仪分析;2-EH含量用安捷伦GC2000型气相色谱仪器进行分析,HP-PONA 50 m×0.200 mm石英毛细管柱,氢火焰(FID)检测器,采用外标法。
3 结果与讨论
3.1 热力学结果与讨论
密闭体系达到平衡后,不同温度下的汽液相物质的量组成和压力见表6。160~220 ℃内平衡常数K随温度升高而增大,变化为4.79~8.93,与文献报道的6.95相接近[10]。
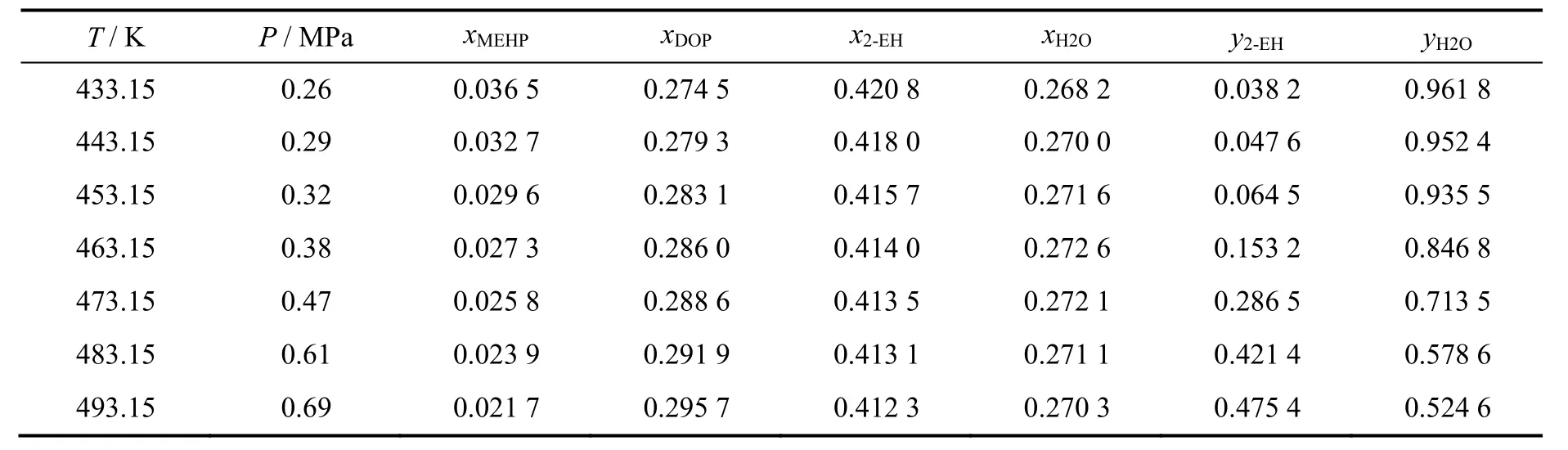
表6 不同温度下的汽液相平衡组成Table 6 Equilibrium composition at different temperature
由图1可以看出,lnK和T-1具有良好的线性关系。回归得到第二步反应的反应焓为17.91 kJ/mol,反应熵为54.64 J/(K·mol),与基团贡献法计算得到的该温度范围内平均反应焓(21.82 kJ/mol)和平均反应熵[55.04 J/(K·mol)]相对偏差分别为17.9%和0.7%。根据式(17)~(20)可计算得到各温度下的活度系数,随着温度从160 ℃升高到220 ℃,γH2O从1.56减少为0.44,γ2-EH从0.11增加至0.85,回归求得式(21)和式(22)的模型参数k1、k2、k3分别为-7.6,37.7,936.8。水和2-EH的活度系数实验值和模型计算值对比如图2和图3所示,平均相对偏差分别为7%和19%。
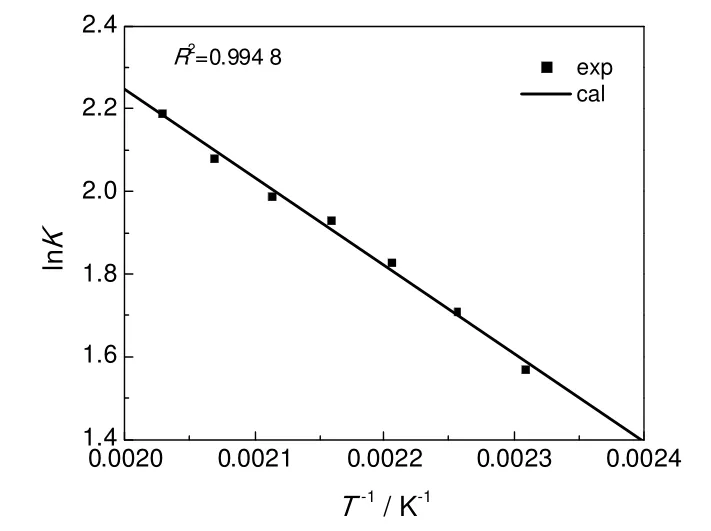
图1 lnK与T-1关系Fig.1 Inverse of temperaturevsnatural log of equilibrium constant
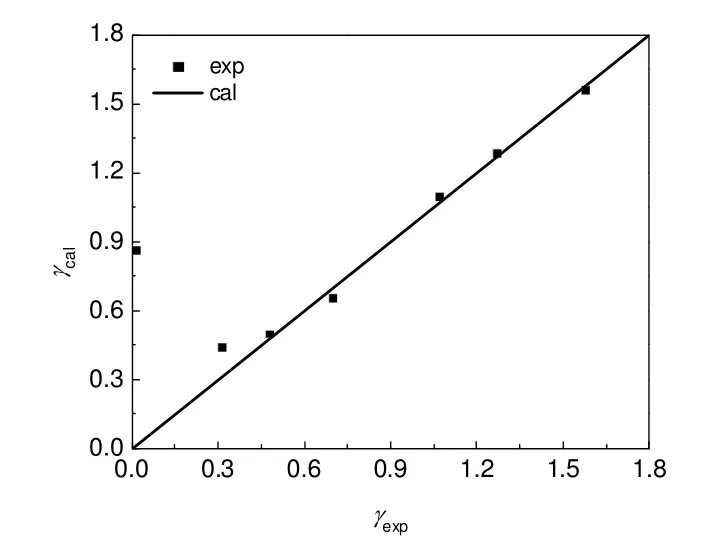
图2 H2O的活度系数关联Fig.2 Correlation between experimental and calculated activity coefficient of H2O
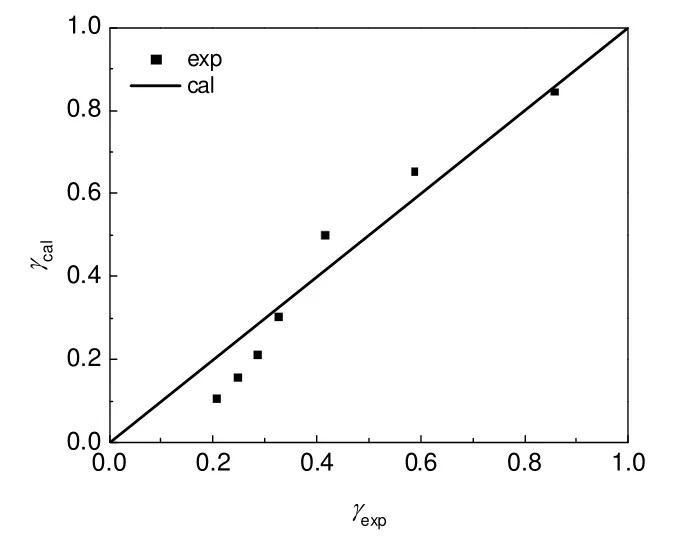
图3 2-EH的活度系数关联Fig.3 Correlation between experimental and calculated activity coefficient of 2-EH
3.2 反应动力学结果与讨论
不同反应温度下,体系内各组分浓度随时间变化关系见图4。
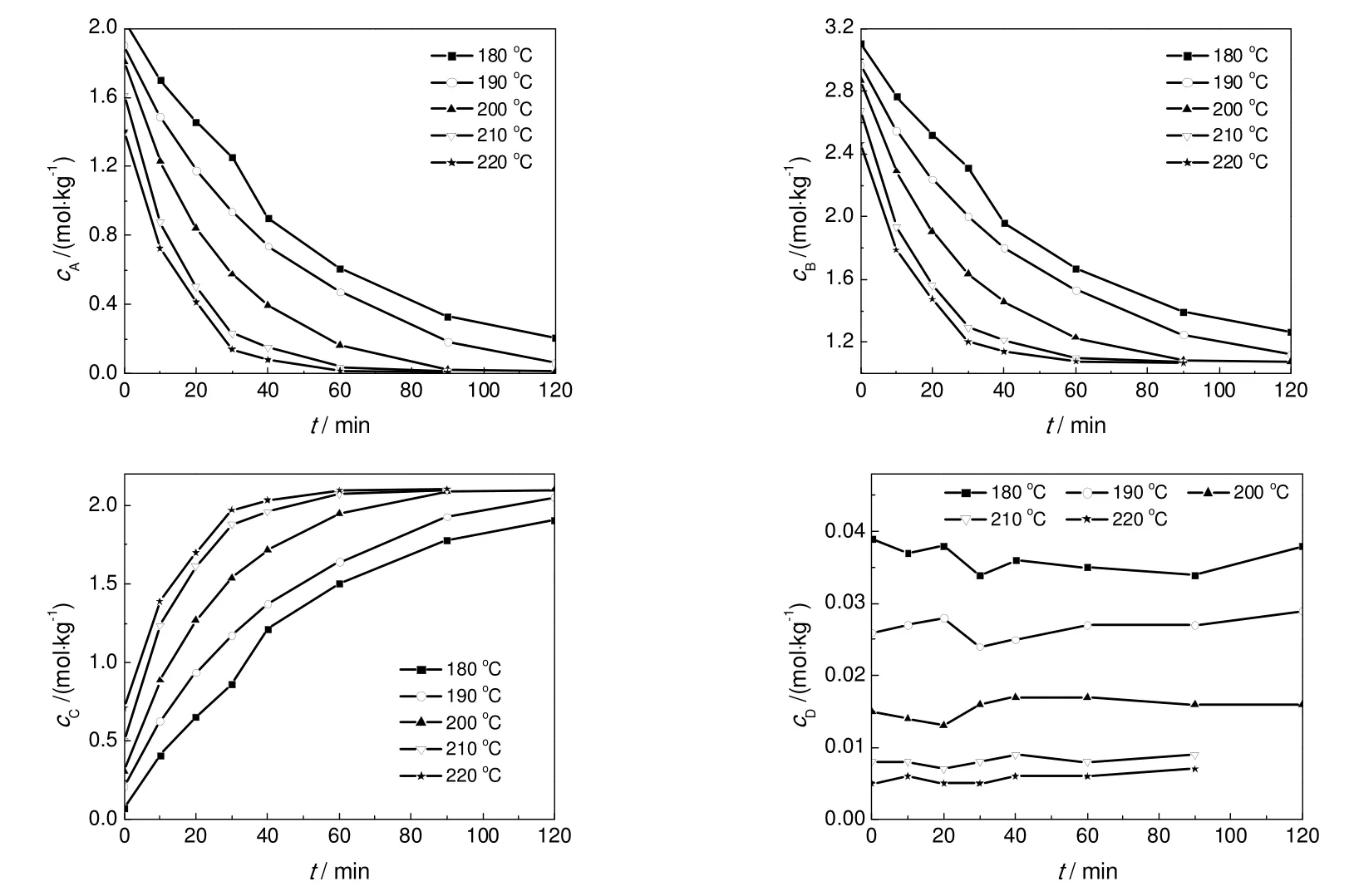
图4 不同温度下各组分液相浓度随时间的变化Fig.4 Concentration change with time at different temperature
可见,随着反应的进行,反应物MEHP和2-EH浓度逐渐降低,产物DOP浓度逐渐升高,最后都趋向于定值,高温下反应60 min后开始相对接近反应平衡;水在生成的同时就被迅速移除反应体系,体系中只存在少量的平衡水。不同转化率下逆反应速率与正反应速率之比(r2/r1)为cCcD/(KcAcB)见图5。MEHP转化率较低时,r2/r1很小,逆反应的影响基本可以忽略;但当转化率从90%增加至99.7%,r2/r1从0.05增加至0.35,因此高转化率下逆反应的影响不可忽略。
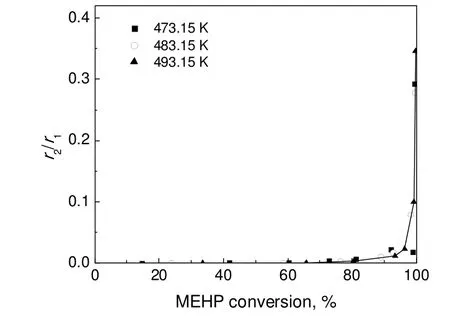
图5 较高温度下不同转化率时的r2/r1Fig.5r2/r1values at different MEHP conversions under higher temperature
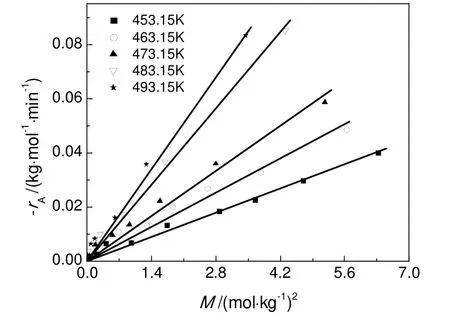
图6 不同温度下(-rA)-M的关系Fig.6 Correlation between (-rA) andMat different temperatures
根据式(24)作图结果见图6,(-rA)和M满足良好的线性关系,证明了MEHP和2-EH的正、逆反应均为二级反应的合理性,根据图中各直线斜率确定的五个温度下正反应速率常数k分别为0.004 1、 0.006 8、0.010 7、0.017 8、0.023 6 kg/(mol·min)。
由图7可知lnk和T-1具有良好的线性关系,MEHP和2-EH生成DOP正反应的活化能为83.49 kJ/mol,指前因子为1.75×107kg/(mol·min),略大于文献报道的在忽略逆反应影响情况下的活化能71.20 kJ/mol[6],如对MEHP转化率小于90%的动力学实验数据不考虑副反应进行回归,则得到正反应活化能为76.29 kJ/mol,与文献值相对接近。
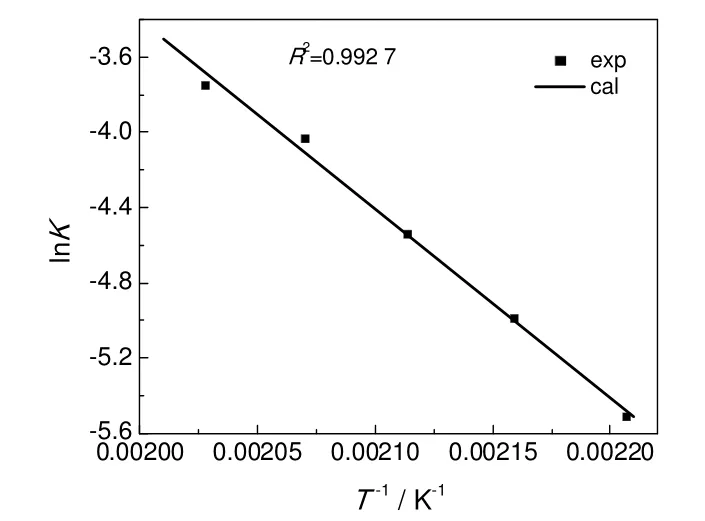
图7 lnK与T-1关系Fig.7 Inverse of temperaturevsnatural log of reaction rate constant
4 结 论
利用Benson、Ducros和Ruzicka-Domalski基团贡献法的计算结果表明,PA和异辛醇生成MEHP的第一步反应为熵增加的不可逆放热反应;MEHP和2-EH进一步酯化生成DOP的第二步反应是熵增加的吸热可逆反应,433.15~493.15 K内反应焓平均值为21.82 kJ/mol,反应熵平均值为55.04 J/(K·mol)。
433.15~493.15 K得到MEHP和2-EH的反应平衡常数在4.79~8.93间,反应焓为17.91 kJ/mol,反应熵为54.64 J/(K·mol),与基团贡献法计算结果基本相吻合。此体系液相包括MEHP、2-EH、DOP和水四个组分,气相只有易挥发的2-EH和水,活度系数经验模型Redlich-Kister方程可以较好地关联水和2-EH的汽液平衡数据。
对以钛酸四丁酯为催化剂的DOP合成过程反应动力学研究表明,高转化率下DOP水解反应的影响不可忽略;MEHP和2-EH间的正、逆反应均可以按二级反应处理,453.15~493.15 K内正反应的活化能为83.49 kJ/mol,指前因子为1.75×107kg/(mol·min)。
[1] 钱伯章. 增塑剂的国内外发展现状 [J]. 上海化工, 2010, 36(1):36-38.Qian Bozhang. The current development of plasticizer at home and abroad [J]. Shanghai Chemical Engineering, 2010, 36(1):36-38.
[2] 彭德萍. DOP增塑剂连续化生产工艺的酯化扩容技术改造研究 [D]. 重庆: 重庆大学, 2011.
[3] 朱志庆. 化工工艺学 [M]. 北京: 化学工业出版社, 2011, 227-228.
[4] Skrzypek J, Sadl owski J Z, Lachowska M, et al. Kinetics of the esterification of phthalic anhydride with 2-thylhexanol Part I: sulfuric acid as a catalyst [J]. Chemical Engineering and Process, 1994, 33(4):413-418.
[5] Skrzypek J, Sadl owski J Z, Lachowska M, et al. Kinetics of the esterification of phthalic anhydride with 2-thylhexanol Part II:p-toluenesulphonic acid as a catalyst [J]. Chemical Engineering and Process, 1995, 34(4):455-457.
[6] Skrzypek J, Sadl owski J Z, Lachowska M, et al. Kinetics of the esterification of phthalic anhydride with 2-thylhexanol Part III: tetrabutyl titanate as a catalyst [J]. Chemical Engineering and Process, 1996, 35(2):283-286.
[7] Skrzypek J, Sadl owski J Z, Lachowska M, et al. Kinetics of the esterification of phthalic anhydride with 2-thylhexanol Part IV: non-catalystic process. Final kinetic comparison of the catalyst [J]. Chemical Engineering and Process, 1998, 37(1):163-167.
[8] 罗文玲. 100 kt/a邻苯二甲酸二辛酯生产装置国产化设计 [J]. 化工设计, 2005, 15(1):11-14. Luo Wenling. The domestic design of 100 kt/a devices for DOP [J]. Chemical Engineering Design, 2005, 15(1):11-14.
[9] 赵国良. 有机物热力学数据的估算 [M]. 北京: 高等教育出版社. 1983:153-157.
[10] 吕海霞, 杨志杰, 韩方煜. 连续化DOP非酸催化酯化工序的改造 [J]. 计算机与应用化学, 2013, 30(1):76-80. Lv Haixia, Yang Zhijie, Han Fangyu. The reconstruction of continuous esterification for DOP using tetrabutyl titanate catalyst [J]. Computers and Applied Chemistry, 2013, 30(1):76-80.
[11] Huang J, Li D F, Li S A, et al. Kinetic analysis of carboxy ester hydrolysis by a dinuclear Zn(II) complex [J]. Journal of Inorganic Biochemistry, 2004, 98(3):502-509.
[12] Ravindranath K, Mashelkar R A. Modeling of poly (ethylene terephthalate) reactors: 4. a continuous esterification process [J]. Polymer Engineering and Science, 1982, 22(10):610-618.
[13] Yamada T, Imamura Y. Simulation of continuous direct esterification process between terephthalic acid and ethylene glycol [J]. Polymer-plastics Technology and Engineering, 1989, 28(7&8):811-876.
[14] 秦云锋. 乙酸异丙酯物系相平衡研究及乙酸酯类分离新工艺的开发 [D]. 广州: 华南理工大学, 2002.
Thermodynamics and Kinetics of Dioctyl Phthalate Synthesis Process
Li Shuangcheng, Xi Zhenhao, Zhao Ling
State Key Laboratory of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China
The synthesis of dioctyl phthalate (DOP) involves mono-(2-ethylhexyl) phthalate (MEHP) formation firstly by phthalic anhydride (PA) with 2-ethyl hexanol (2-EH) and further esterification between MEHP and 2-EH to generate DOP, and the second reaction is reversible and the controlling step. Since MEHP conversion is usually demanded to be over 99.5%, the influence of DOP hydrolysis cannot be neglected. The thermodynamic properties were calculated by Benson, Ducros and Ruzicka-Domalski group contribution methods. The vapor-liquid equilibrium composition and reaction equilibrium constants of the controlling reaction as well as the kinetics with tetrabutyl titanate as catalyst were investigated experimentally in batch reactor. The result of thermodynamic experiments showed that the enthalpy and entropy of the reaction between MEHP and 2-EH were 17.91 kJ/mol and 54.64 J/(K·mol) respectively, and this reaction was endothermic with increasing entropy which was consistent with the theoretical calculation result. The activity coefficient of water and 2-EH in this reactive system was fitted well using Redlich-Kister equation. The kinetic model of reversible reaction between MEHP and 2-EH was established, both the forward and backward reaction can be treated as second-order reactions, and parameter regression showed that the activation energy and pre-exponential factor of the forward reaction were 83.49 kJ/mol and 1.75×107kg/(mol·min) respectively.
dioctyl phthalate; monoethylhexyl phthalate;iso-octyl alcohol; group contribution method; reaction kinetics
TQ013.1; TQ013.2
A
1001—7631 ( 2015 ) 05—0385—08
2015-04-17;
: 2015-06-09。
李双成(1989—),男,硕士研究生;赵 玲(1969—),女,教授,通讯联系人。E-mail:zhaoling@ecust.edu.cn。
国家自然科学基金(21176070)。
