分枝杆菌降解甾醇侧链中底物及其增溶剂的研究
2015-01-07徐阳光范雅敏王海清关怡新姚善泾
徐阳光,范雅敏,罗 兰,王海清,关怡新,姚善泾
浙江大学化学工程与生物工程学院,浙江 杭州 310027
分枝杆菌降解甾醇侧链中底物及其增溶剂的研究
徐阳光,范雅敏,罗 兰,王海清,关怡新,姚善泾
浙江大学化学工程与生物工程学院,浙江 杭州 310027
为克服甾醇生物转化中存在的底物溶解度偏低的问题,拟选取多种有机溶剂、环糊精及其衍生物作为增溶剂,以探讨不同底物甾醇对其偏好性,并对增溶剂添加时间、添加量、底物的投料浓度等进行了详细研究。结果表明,植物甾醇(混合甾醇)最适于作为侧链降解转化底物,且底物甾醇对不同的增溶剂无明显偏好性。有机溶剂作为增溶剂时,乙醇和丙酮在提高产率方面均优于其它有机溶剂;而环糊精作为增溶剂时,甲基-β-环糊精效果最好,在投料浓度为15 g/L时(环糊精与底物物质的量比2:1),产率仍不低于60%。
植物甾醇 侧链降解 分枝杆菌 有机溶剂 环糊精及其衍生物
为解决甾体激素类药物合成中薯蓣皂素和剑麻皂素等半合成原料短缺的问题,采用微生物转化法降解植物甾醇侧链,以生产甾体类药物中重要的中间体雄甾-4-烯-3,17-二酮(AD)是目前的研究热点[1]。植物甾醇侧链降解过程可分为扩散和酶催化反应两个阶段,扩散过程包括底物固体颗粒的溶解、溶解后的底物分子向细胞内扩散以及产物分子向细胞外的转运等。与甾醇侧链降解有关的酶属于胞内酶,只有底物进入细胞后,转化反应才得以进行,但甾体类物质在水溶液中的溶解度很低(溶解度仅为10-5~10-4mol/L),不能很好地与转化酶接触,会造成转化率低、发酵时间长等一系列问题[2]。底物的溶解及传递是侧链降解过程中关键的控制步骤,直接决定着产物产率的高低。因此,改善底物的溶解性,增加反应体系中的有效底物浓度,强化底物和产物分子的内外传递,建立合理有效的生物转化体系是提高甾醇侧链降解反应效率的关键因素之一。
选取合适的有机溶剂和环糊精及其衍生物是增加底物溶解性的常用方法。但特定的底物是否对增溶剂具有偏好性,目前尚未见文献报道。而且,分枝杆菌降解甾醇侧链过程中关于底物也少有系统地研究。本研究拟选取5种甾醇(豆甾醇、β-谷甾醇、植物甾醇、胆固醇、麦角固醇)作为底物,6种有机溶剂[乙醇、甲醇、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、丙酮、1,2-丙二醇]和8种环糊精(β-环糊精、甲基-β-环糊精、羧甲基-β-环糊精、羟丙基-β-环糊精、2-羟丙基-β-环糊精、磺丁基-β-环糊精、γ-环糊精、羟丙基-γ-环糊精)作为增溶剂,对底物的偏好性和分枝杆菌降解甾醇侧链的催化过程进行研究,以改善底物的溶解性,进一步提高底物投料浓度。
1 实验部分
1.1 实验材料
分枝杆菌(Mycobacteriumsp. MB 3863),购自中国科学院微生物研究所;豆甾醇(stigmasterol,纯度>95%),β-谷甾醇(β-sitosterol,纯度>80%)和混合植物甾醇(phytosterols,其中豆甾醇26.2%、β-谷甾醇45%、菜油甾醇23.5%、菜籽甾醇3.2%),购自西安海斯夫生物科技公司;胆固醇(cholesterol,纯度>95%),麦角固醇(ergosterol,纯度>95%),β-环糊精(β-CD),2-羟丙基-β-环糊精(2-HP-β-CD),γ-环糊精(γ-CD),购自阿拉丁公司;甲基-β-环糊精(M-β-CD),羧甲基-β-环糊精(CM-β-CD),羟丙基-β-环糊精(HP-β-CD),磺丁基-β-环糊精(SBE-β-CD)和羟丙基-γ-环糊精(HP-γ-CD)均为无臭白色粉末,购自山东滨州智源生物科技有限公司;其它试剂均为市售分析纯或色谱纯。
1.2 实验方法
1.2.1 培养基组成
种子培养基:葡萄糖0.5%,蛋白胨0.5%,牛肉膏0.3%,甘油0.6%,NaCl 1.5%,pH值7.0。
发酵培养基:柠檬酸0.2%,柠檬酸铁铵0.005%,MgSO40.05%,K2HPO40.05%,(NH4)2HPO40.6%,吐温-80(Tween-80)0.3%,葡萄糖0.5%,pH值7.0。
1.2.2 底物预处理
有机溶剂为增溶剂时,将0.05 g底物溶解于2 mL有机溶剂中,50 ℃超声辅助溶解5 min,即得到底物有机溶剂悬浮液,保温备用。环糊精及其衍生物为增溶剂时,将环糊精与底物以1:1的物质量比加入50 mL发酵培养基,115 ℃灭菌30 min。
1.2.3 生物催化甾醇侧链降解反应
将保藏在4 ℃琼脂斜面培养基上的分枝杆菌孢子用无菌水洗下,转入种子培养基,在28 ℃和180 r/min培养12 h后,再转接于发酵培养基。将用增溶剂适当处理过的底物投入发酵液中,投料浓度1 g/L,在30 ℃和200 r/min转化168 h(环糊精为增溶剂时转化96 h)。取3 mL发酵液,加入6 mL乙酸乙酯振荡萃取15 min;取上相在10 000 r/min离心5 min后,取1 mL上清液烘干,有机滤膜过滤后加入1 mL色谱甲醇超声辅助溶解,采用高效液相色谱(HPLC)分析AD摩尔产率(Yield)。
1.2.4 分析方法
摩尔产率的测定采用高效液相色谱法(HPLC 1100,美国安捷伦公司),色谱柱为Kromasil 100-5C18柱(250 mm×4.6 mm),检测波长254 nm,流动相为甲醇与水(体积比为4:1),流速1 mL/min,进样量20 μL。绘制产物雄甾-4-烯-3,17-二酮(AD)的标准曲线,用外标法计算发酵培养液中AD含量。摩尔产率(Yield)的定义为产出的AD物质的量除以底物甾醇的物质的量,其中植物甾醇的相对分子质量按各成分比例,以400 g/mol计算。
2 结果与讨论
2.1 有机溶剂作为增溶剂的微生物转化
2.1.1 底物对有机溶剂的偏好性
用有机溶剂预溶解底物后再投料到发酵液中进行生物转化是一类较常用的提高底物溶解度的方法,主要包括乙醇、丙二醇、丙酮和N,N-二甲基甲酰胺等[2]。选取了6种有机溶剂增溶剂,其对5种甾醇底物的转化过程影响如表1所示。当未添加有机溶剂时,β-谷甾醇与植物甾醇(PS)的摩尔产率最高,分别达到57.0%和54.4%;其中得率最低的是麦角固醇,仅为2.3%,豆甾醇的摩尔产率也不高,只有23.3%。这是因为麦角固醇和豆甾醇经常被氧化成孕酮[3],它们C22位上的双键对于甾醇专一性降解常用菌有抑制作用[4],因而导致转化率很低。使用有机溶剂为增溶剂时,甾醇经有机溶剂超声辅助溶解,然后加入反应系统。由表1可见,使用增溶剂后,豆甾醇和麦角固醇的转化率依然较低,特别是麦角固醇,最高只有21.5%(乙醇为增溶剂),说明麦角固醇和豆甾醇不适于用作甾醇侧链降解的底物。β-谷甾醇和胆固醇的产率虽然较高,但原料昂贵,如市场上高纯度的β-谷甾醇(80%以上)价格是植物甾醇(PS)的20倍左右。综合产率和经济效益,植物甾醇(混合甾醇)最适于作为微生物侧链降解的底物。另外,植物甾醇、β-谷甾醇和胆固醇作底物时,6种有机溶剂作为增溶剂均可不同程度提高侧链降解产率;而在麦角固醇和豆甾醇作底物时,产率普遍较低,没有出现在某种有机溶剂中产率过高的现象,说明底物对有机溶剂无明显偏好性。AD产率主要由底物的分子结构决定,而底物与溶剂的相互作用对其影响较小。其中,乙醇和丙酮的增溶效果优于其它溶剂,其对5种底物转化率的提高均很明显,且其在底物预处理过程中均能将底物溶解至澄清透明,表明它们对底物的溶解性较好,是比较理想的甾体侧链降解增溶剂。
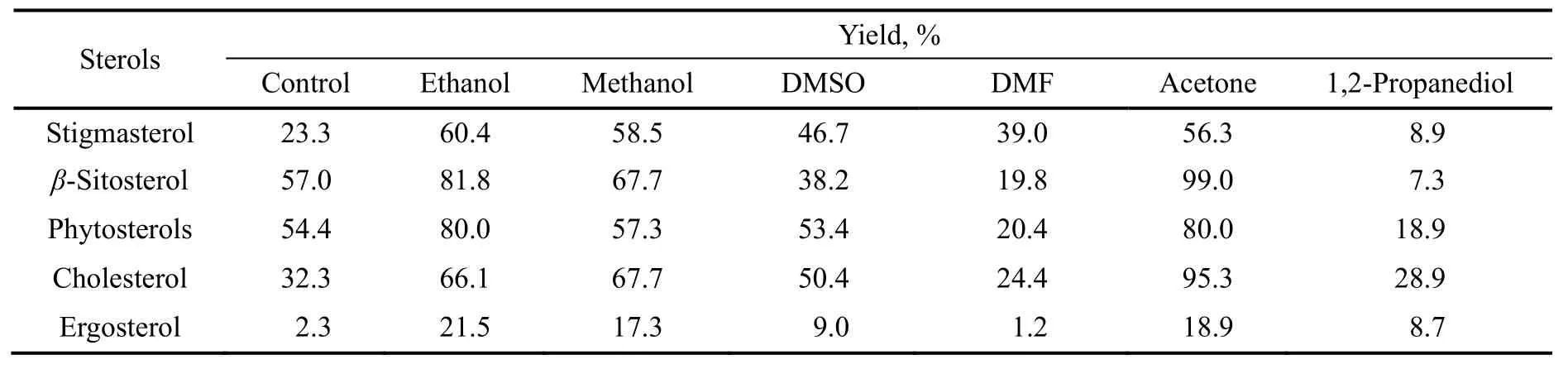
表1 有机溶剂对甾醇生物转化过程影响Table 1 Effect of organic solvents on sterols bioconversion
2.1.2 植物甾醇投料浓度的影响
为了达到较高的生物转化效率,生产过程中希望底物的投料浓度尽可能地高。选取乙醇作为增溶剂,混合植物甾醇为底物研究提高底物投料浓度对侧链降解过程的影响。将底物用2 mL乙醇超声辅助溶解后投入发酵液中,各个投料浓度下AD产率结果如图1所示。随着底物浓度的提高,产物AD的摩尔产率迅速下降,在植物甾醇的浓度为7 g/L时,其产率只有5%。这说明有机溶剂对甾醇的增溶效果有限,仅适用于低浓度的植物甾醇转化。另外,增加溶剂量会对细胞产生毒性,造成产率降低[5]。本实验曾用4 mL乙醇溶解1 g/L的底物进行反应,发现产率只有8%,叶丽等[6]在其研究中得到了类似结论。推测其原因是植物甾醇侧链降解反应为多酶催化,较其他单酶催化的转化反应更易受有机溶剂的毒害[7]。
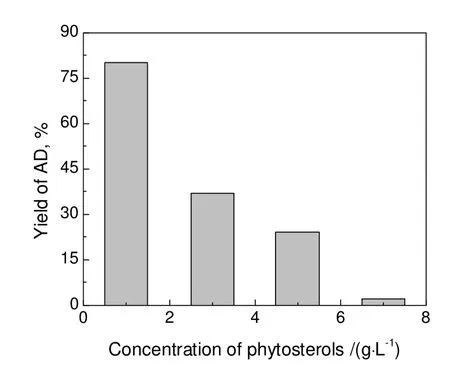
图1 乙醇作为增溶剂时底物浓度对AD产率的影响Fig.1 Effect of phytosterols feeding concentration on bioconversion using ethanol as a solubilizer
2.2 环糊精及其衍生物作为增溶剂的微生物转化
2.2.1 底物对环糊精及其衍生物的偏好性
环糊精(cyclodextrin, CD)是一种由6~8个葡萄糖通过α-1,4-糖苷键连接而成的环状寡聚糖,易溶于水,其疏水性空腔能够通过范德华力及氢键作用与疏水性分子结合,分为α、β、γ环糊精[8]。Hesselink等[9]通过实验证明,CD能显著增加MycobacteriumNRRL-B3683降解胆固醇和谷甾醇生产雄甾-4-烯-3,l7-二酮(AD)的产率,而且不会影响细胞生长速度及细胞密度。α、β、γ环糊精分别由6、7、8个葡萄糖分子组成,所以其形成的疏水性空腔大小不同,会影响植物甾醇的溶解度,因而影响AD产率。本工作首先研究了5种不同的环糊精对甾醇侧链降解过程的影响,结果如表2所示。
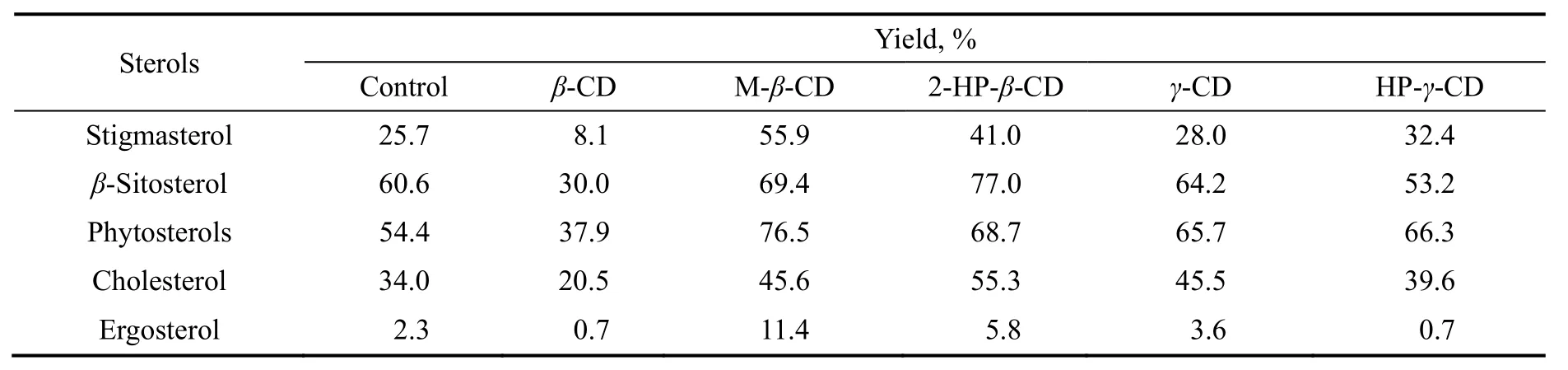
表2 环糊精类对甾醇生物转化过程影响Table 2 Effect of cyclodextrin and its derivatives on sterols bioconversion
在投料浓度1 g/L时,添加与底物物质的量比为1:1的环糊精,转化96 h后发现这5种环糊精对底物的转化率提高均不明显,即低底物浓度下其增溶效果反而不如有机溶剂,摩尔产率较高的依然是侧链上无双键的胆固醇,β-谷甾醇和混合植物甾醇,进一步说明了AD的摩尔产率主要由底物分子结构决定,底物与溶剂的相互作用对其影响较小,增溶剂只会使5种底物转化的AD产率同时升高或降低,但单个底物对某种增溶剂无明显偏好性。其中β-环糊精对底物的侧链降解反而有抑制作用,与不添加环糊精相比,底物的转化率均降低。这是因为β-环糊精与底物包结物不溶于水,直接添加β-环糊精,能和底物形成包结程度较低的包结物,反而不利于微生物细胞的转化反应[10]。表2表明,环糊精衍生物中增溶效果最好的溶剂是甲基-β-环糊精(M-β-CD),将植物甾醇的产率从54.4%提高到76.5%。与β-环糊精相比,γ-环糊精虽然具有较大的内腔,可以容纳更多的底物分子,但从结果来看,γ-环糊精及其衍生物提高摩尔产率的效果反而不如β-环糊精衍生物,说明环糊精的内腔不是越大越好,其增溶效果还和环上的配基结构有关。鉴于β-环糊精衍生物的增溶效果较好,本实验又进一步选取了3种β-环糊精衍生物即磺丁基-β-环糊精(SBE-β-CD)、羧甲基-β-环糊精(CM-β-CD)、羟丙基-β-环糊精(HP-β-CD)进行研究,以期提高植物甾醇的投料浓度,筛选出效果较佳的环糊精增溶剂。
2.2.2 环糊精添加比例对AD产率的影响
环糊精能显著增加植物甾醇等疏水化合物的水溶性,在一定范围内其溶解度的增加与环糊精添加量呈线性关系[11]。本工作研究了添加与底物植物甾醇(5 g/L)不同物质的量比的SBE-β-CD和CM-β-CD,转化96 h后结果如图2所示。由图2可知,AD产率随着环糊精与植物甾醇物质的量比的增加而逐渐增加,后趋于稳定,并有小幅下降。在加入物质的量比为2:1的环糊精时,AD产率最高为45%,是对照实验的2.5倍。
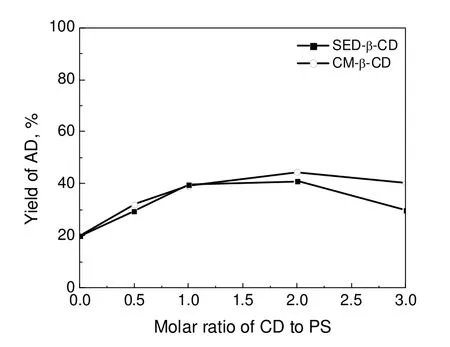
图2 环糊精添加量对产率的影响Fig.2 Effect of molar ratio of CD to phytosterols on AD yield
2.2.3 环糊精添加时间对AD产率的影响
在不同发酵时间加入与植物甾醇(10 g/L)物质的量比为2:1的HP-β-CD,转化反应96 h后,得到的AD产率,结果见图3。可以看出,HP-β-CD的添加时间对AD的摩尔产率影响不大,二级培养发酵初期添加时,产物AD的摩尔产率为55%,与发酵72 h时添加相比,提高了10%。因而,本实验中确定添加环糊精的最佳时间为二级发酵培养初始时刻。
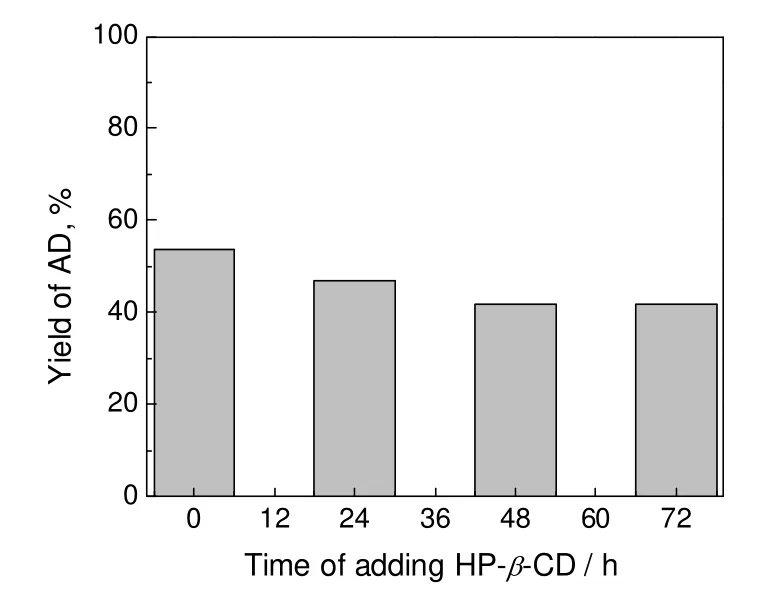
图3 环糊精添加时间对AD产率的影响Fig.3 Effect of time of adding CD on AD yield
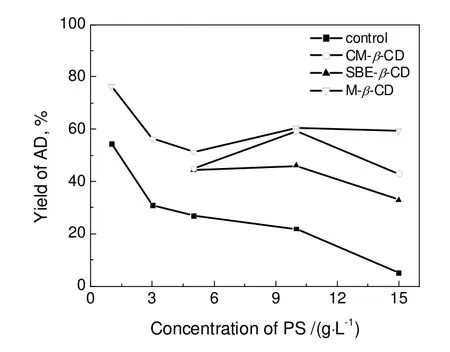
图4 环糊精作为增溶剂时底物浓度对AD产率的影响Fig.4 Effect of phytosterols feeding concentration on bioconversion using cyclodextrins as solubilizer
2.2.4 植物甾醇投料浓度的影响
底物的投料浓度是工业生产中一个重要的参数,为了提高生产效率,在保证产物较高的摩尔产率的前提下,应尽可能地提高投料浓度。本工作研究了以SBE-β-CD、CM-β-CD、M-β-CD为增溶剂时,投料浓度对AD产率的影响,添加与底物植物甾醇物质的量比为2:1的环糊精,转化96 h后结果如图4所示。3种环糊精对甾醇侧链降解的微生物转化均具有较好的效果。在高底物浓度时,添加环糊精的AD产率并没有因为底物浓度的提高而急剧下降,在15 g/L底物浓度下,添加了M-β-CD的AD摩尔产率仍有60%,说明β-环糊精衍生物对植物甾醇转化有良好的促进效果。综合考虑AD的产率和生产效率,确定15 g/L为适宜的底物投料浓度。
表3为近年来甾醇侧链降解反应的研究现状。与文献数据相比,本研究中底物的投料浓度15 g/L已达到较高水平,尽管AD的摩尔产率为60%,但其发酵转化时间仅为4天,大大缩短了转化过程,可显著提高生产效率,这在甾体药物的工业生产中具有重要意义,表明了将环糊精作为增溶剂应用于甾醇侧链降解过程的可行性和优势。
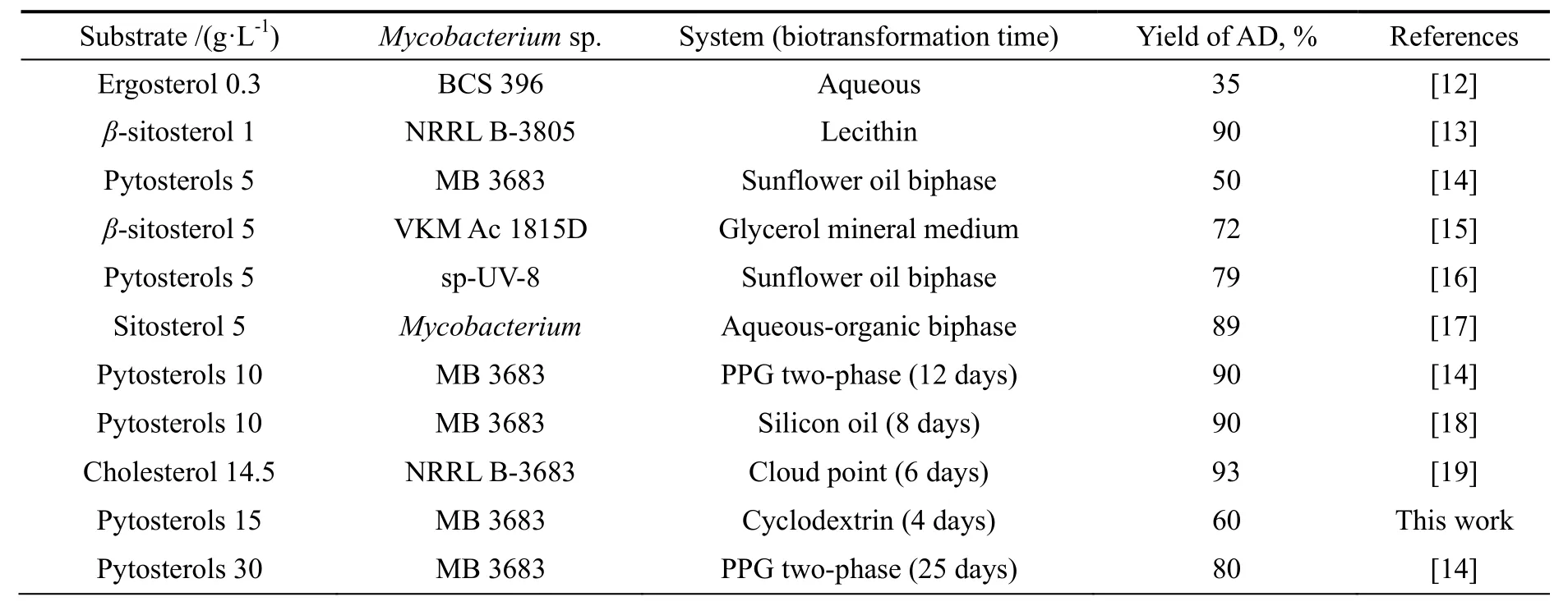
表3 甾醇侧链降解反应研究汇总Table 3 The situation of side-chain cleavage using different biotransformation processes
3 结 论
基于转化效率和经济性分析,植物甾醇是分枝杆菌降解甾醇侧链的最适宜底物。有机溶剂中增溶效果最好的是乙醇和丙酮,在1 g/L投料浓度均可使产物雄甾-4-烯-3,17-二酮(AD)的产率提高到80%以上;但当底物投料浓度提高到7 g/L时,AD产率迅速下降到5%,说明有机溶剂只适用于低投料浓度的底物溶解性改善,随着植物甾醇浓度提高,其增溶效果将变差。环糊精及其衍生物中,β-环糊精衍生物的增溶效果较好,疏水腔较大的γ-环糊精及其衍生物效果不佳,说明增溶效果还与环糊精上的配基有关。环糊精与植物甾醇的最佳投料物质的量比为2:1,合适的添加时间为二级培养的初始时刻。其中,甲基-β-环糊精增溶效果最好,在植物甾醇浓度高达15 g/L时,其AD摩尔产率仍不低于60%。研究结果表明不同结构的底物对有机溶剂和环糊精及其衍生物这两种增溶剂无明显的偏好性。
[1] Donova M V, Egorova O V. Microbial steroid transformations: current state and prospects [J]. Applied Microbiology and Biotechnology. 2012, 94 (6):1423-1447.
[2] 张春燕, 白宝星, 王明蓉. 甾体药物生物转化体系的研究进展 [J]. 国外医药抗生素分册, 2007, 28(5):210-214. Zhang Chunyan, Bai Baoxing, Wang Mingrong. Research progress in steroid medicine bioconversion system [J]. World Notes on Antibiotics, 2007, 28(5):210-214.
[3] Kieslich K. Microbial side-chain degradation of sterols [J]. Journal of Basic Microbiology, 1985, 25(7):461-474.
[4] Goswami P C, Singh H D, Baruad J N. Factors limiting the microbial conversion of sterols to 17-KS in the presence of metal chelate inhibitors [J]. Folia Microbiologica, 1984, 29(3):209-216.
[5] 杨 英, 姜绍通. 微生物降解甾醇侧链转化雄甾-4-烯-3,17-二酮(AD)的研究进展 [J]. 微生物学报, 2006, 33(6):142-145. Yang Ying, Jiang Shaotong. Advance in degrading side chain of sterols of getting androst-4-ene-3,17-dione by Microorganism [J]. Microbiology China, 2006, 33(6):142-145.
[6] 叶 丽, 李增霞, 陈 倩, 等. 分枝杆菌降解β-谷甾醇制备雄甾-1,4-二烯-3,17-二酮 [J]. 复旦学报, 2002, 29(4):280-283. Ye Li, Li Zengxia, Chen Qian, et al. Degradation of β-sitosterol to androst-1,4-diene-3,17-dione byMycobacteriumsp. [J]. Fudan University Journal of Medical Sciences, 2002, 29(4):280-283.
[7] Buckland B C, Dunnill P, Lilly M D. The enzymatic transformation of water-insoluble reactants in nonaqueous solvents: conversion of cholesterol to cholest-4-ene-3-one by a Nocardia sp [J]. Biotechnol Bioeng, 1975, 17(6):815-826.
[8] 张小燕. 新金分枝杆菌zjuvn-08转化植物甾醇合成雄甾烯二酮的研究 [D]. 杭州: 浙江大学, 2013.
[9] Hesselink P, Vliet S, Vries H, et al. Optimization of sterols side chain cleavage byMycobacteriumsp. in the presence of cyclodextrins[J]. Enzyme and Microbial Technology, 1989, 11(7):398-404.
[10] 申雁冰, 王 敏, 王永乐. 反应介质对植物甾醇侧链生物降解的影响 [J]. 天津科技大学学报, 2008, 23(4):27-30. Shen Yanbing,Wang Min,Wang Yongle. Effects of reaction medium on the side chain degradation of phytosterols byMycobacteriumsp. NRRL B-3683 [J]. Journal of Tianjin University of Science & Technology, 2008, 23(4):27-30.
[11] Brewster M E, Loftsson T. Cyclodextrins as pharmaceutical solubilizers [J]. Advanced Drug Delivery Reviews, 2007, 59(7):645-666.
[12] Ambrus G, Ilkőy É, Jekkel A, et al. Microbial transformation ofβ-sitosterol and stigmasterol into 26-oxygenated derivatives [J]. Steroids. 1995, 60(9):621-625.
[13] Rumijowska A, Lisowska K, Zi O Tkowski A, et al. Transformation of sterols byMycobacterium vaccae: effect of lecithin on the permeability of cell envelopes to sterols [J]. World Journal of Microbiology and Biotechnology, 1997, 13(1):89-95.
[14] Kutney J P, Milanova R K, Nedelcheva N V, et al. Process for the microbial conversion of phytosterols to androstenedione and androstadienedione: US, 6071714 [P]. 2000-06-06.
[15] Egorova O V, Gulevskaya S A, Puntus I F, et al. Production of androstenedione using mutants ofMycobacteriumsp [J]. Journal of Chemical Technology and Biotechnology. 2002, 77 (2):141-147.
[16] 杨 英, 姜绍通, 操丽丽, 等. 双液相系统中生物降解植物甾醇制备雄烯二酮工艺 [J]. 农业机械学报, 2008, 39(9):79-82. Yang Ying, Jiang Shaotong, Cao Lili, et al. Preparing androstenones by microbial degradation of phytosterol in biphasic system [J]. Transactions of the Chinese Society for Agricultural Machinery, 2008, 39(09):79-82.
[17] Dias A, Cabral J, Pinheiro H M. Sterol side-chain cleavage with immobilizedMycobacteriumcells in water-immiscible organic solvents[J]. Enzyme and Microbial Technology, 1994, 16(8):708-714.
[18] Stefanov S, Yankov D, Beschkov V. Biotransformation of phytosterols to androstenedione in two phase water-oil systems [J]. Chemical and Biochemical Engineering Quarterly, 2006, 20(4):421-427.
[19] Wang Z, Zhao F, Hao X, et al. Microbial transformation of hydrophobic compound in cloud point system [J]. Journal of Molecular Catalysis B: Enzymatic, 2004, 27(4):147-153.
新的非贵金属催化剂用于低温排气后处理显示了作为低成本组分的前景
新的非贵金属催化剂用于低温排气后处理显示了作为低成本组分的前景。美国橡树岭国家实验室的研究人员(ORNL)于2015年9月23日宣布,开发出由氧化铜、氧化钴和二氧化铈(被称为“CCC”)组成的三元混合氧化物催化剂,优于在模拟的排气流中用于CO氧化的合成的和商业上的铂族金属(PGM)催化剂,显示出无抑制的迹象,亦即无由NOx、CO和HC而使催化剂发生堵塞的迹象。
PGM催化剂是目前汽车尾气排放后处理的标准催化剂。然而,除了他们的高成本外,由于被排气流中烃类的抑制,PGM催化剂在低温(< 200 ℃)下会受到CO氧化的影响。新的ORNL催化剂显示了巨大的潜力,可作为用于低温排气流的低成本的组分,预计将适于未来汽车系统的特点,研究人员将他们的论文已刊载在德国《应用化学(Angewandte Chemie)》杂志上。
这种催化剂潜在的解决了没有贵金属的抑制问题,并可望有助于更高效的发动机满足即将到来的更严格的排放法规。研究人员进行了广泛的测试,使用不同比例的氧化铜、氧化钴和二氧化铈,以确定最优比例,最初评价的原子比例分别为1:5:5。
美国能源部的能源效率和可再生能源办公室车辆技术项目资助这项研究。
钱伯章 摘自Green Car Congress, 2015-09-24
Study on Substrate and Solubilizer in Side-Chain Cleavage of Sterols by Mycobacterium sp. MB 3863
Xu Yangguang, Fan Yamin, Luo Lan, Wang Haiqing, Guan Yixin, Yao Shanjing
College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
In order to solve the shortage of dioscin used in the synthesis of steroid drugs, the production of androst-4-ene-3,17-dione (AD) and other intermediates using phytosterols as the substrate has drawn great attention in recent years. The main problem of sterols conversion in side-chain cleavage of sterols by microbial fermentation is its strong hydrophobic character, which leads to poor contact between substrate and enzymes and thus results in low conversion rate and the fermentation time was delayed. In this study, 6 kinds of organic solvents and 8 kinds of cyclodextrin and their derivatives were used to enhance the dissolution of sterols in side-chain cleavage of sterols byMycobacteriumsp. MB 3863, and the preferences of different substrates on solubilizer were investigated. The results showed that phytosterols (mixture sterols) was one of the most suitable substrates in producing AD, and different substrates showed no preferences for given solubilizer to some extent. When organic solvents were used as solubilizer, ethanol and acetone were found to be the most ideal. As for cyclodextrin and its derivatives, the methyl-β-cyclodextrin was the best candidate; when the concentration of phytosterols was increased to 15 g/L, the molar yield of AD could still be over 60% at optimized feeding time and molar ratio of methyl-β-cyclodextrin to phytosterols (2:1).
phytosterols; side chain degradation; mycobacteria; organic solvents; cyclodextrin and its derivatives
TQ467.95
A
1001—7631 ( 2015 ) 05—0423—07
2014-05-04;
: 2014-06-20。
徐阳光(1989—),男,硕士研究生;关怡新(1966—),女,教授,通讯联系人。E-mail:guanyx@zju.edu.cn。
浙江省科技计划项目(2005C31028)。
