膜醭毕赤酵母结合杀菌剂对柑橘果实采后病害的控制效果
2015-01-05冯吉睿周雅涵曾凯芳
冯吉睿,周雅涵,曾凯芳,*
(1.西南大学食品科学学院,重庆 400715;2.新疆克拉玛依市食品药品监督管理局食品安全监督执法支队,新疆 克拉玛依 834000)
膜醭毕赤酵母结合杀菌剂对柑橘果实采后病害的控制效果
冯吉睿1,2,周雅涵1,曾凯芳1,*
(1.西南大学食品科学学院,重庆 400715;2.新疆克拉玛依市食品药品监督管理局食品安全监督执法支队,新疆 克拉玛依 834000)
探究膜醭毕赤酵母与低剂量杀菌剂(多菌灵、甲基硫菌灵)结合使用对柑橘采后病害的防治效果。通过筛选能与膜醭毕赤酵母结合使用的杀菌剂,考察柑橘常见病原菌对杀菌剂的敏感性,继而在果实上验证结合处理对柑橘采后病害的防治效果。离体实验的结果表明,多菌灵和甲基硫菌灵对酵母生长无抑制作用;柑橘青霉菌、绿霉菌和炭疽菌对两种杀菌剂敏感性不同,但半数抑制浓度(EC50值)均小于建议剂量的1%。果实活体实验的研究结果表明,膜醭毕赤酵母结合低剂量的多菌灵或甲基硫菌灵对柑橘果实青霉病、绿霉病的防治效果均好于膜醭毕赤酵母和低剂量杀菌剂单独处理;但膜醭毕赤酵母结合低剂量的甲基硫菌灵对夏橙果实接种炭疽病的防治效果不佳。同时,膜醭毕赤酵母结合低剂量的多菌灵或甲基硫菌灵对夏橙果实自然发病率的控制呈增效作用,对锦橙果实自然发病率的控制呈叠加作用,两种结合处理均能保证夏橙和锦橙的好果率。
膜醭毕赤酵母;杀菌剂;柑橘果实;采后病害
柑橘是世界第一大水果,世界140多个国家和地区都有种植。中国作为世界上最大的柑橘生产国,种植面积和年产量均居世界第一位[1]。与快速发展的柑橘种植业和加工业相比,柑橘采后贮藏技术发展相对缓慢。其中,侵染性病害包括青霉病、绿霉病、炭疽病、蒂腐病、酸腐病等是造成柑橘采后损失的主要原因。目前柑橘果实采后侵染性病害的控制主要依赖于化学杀菌剂,如多菌灵、甲基硫菌灵、噻菌灵、抑霉唑、咪鲜胺等。其中,噻菌灵和抑霉唑是全球用于减少果蔬采后腐烂的主要杀菌剂[2]。随着人们更加关注杀菌剂对环境和食品安全的影响,寻找更安全、更环保的方法控制采后病害以替代或减少杀菌剂用量显得尤为重要[3-4]。伴随生物防治技术的发展,利用拮抗酵母菌控制果蔬采后病害逐渐成为近年来的研究热点。然而,与传统的化学杀菌剂相比,拮抗酵母菌单独使用容易受环境、果实生理状态等多种因素的影响,防治效果往往达不到要求[5]。研究表明,拮抗酵母菌复合杀菌剂或其他物质使用,能在降低杀菌剂用量的同时,很好地控制果蔬采后病害的发生[6-9]。此外,酵母具有降解真菌毒素和降低杀菌剂残留的功能[10-11]。实验室前期研究结果表明,膜醭毕赤酵母复合水杨酸、热处理对柑橘果实采后青霉病和绿霉病有很好控制效果[12]。膜醭毕赤酵母和低剂量杀菌剂复合使用控制果蔬采后病害的研究还未见报道。因此,本实验拟筛选能与膜醭毕赤酵母结合使用的杀菌剂,研究膜醭毕赤酵母与杀菌剂结合处理对柑橘果实采后病害的控制效果,以期减少采后柑橘果实化学杀菌剂用量,提高果实的贮藏安全性。
1 材料与方法
1.1材料、微生物与试剂
夏橙(Citrus sinensisL.Osbeck cv. Olinda Valencia orange)采于重庆市垫江县白马镇;锦橙(Citrus sinensisL.Osbeck cv. Jincheng 447#)采于重庆市渝北区统景镇。供试柑橘果实于当天运回贮藏于7~10℃冷库,挑选大小均一、无机械伤、成熟度基本一致的果实作为实验材料。
膜醭毕赤酵母(Pichia membranaefaciens) 中国工业微生物菌种保藏管理中心;青霉菌(Penicillium italicumWehmer.)、绿霉菌(Penicillium digitatumSacc.)和炭疽菌(Colletotrichum gloeosporidesPenz.)为本实验室自行分离和保藏的菌种。
多菌灵(50%可湿性粉剂) 江苏蓝丰生物化工股份有限公司;甲基硫菌灵(70%可湿性粉剂)、代森锌(65%可湿性粉剂) 深圳诺普信农化股份有限公司;抑霉唑(500 g/L乳油) 江苏龙灯化学有限公司;咪鲜胺(250 g/L乳油) 美国FMC公司;咪鲜胺锰盐(50%可湿性粉剂) 上海生农生化制品有限公司。
1.2仪器与设备
SW-CJ-1F超净工作台 苏净集团安泰有限公司;B203生物显微镜 重庆奥特光学仪器有限公司;BS-4G振荡培养箱 金坛市富华仪器有限公司;DHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;PSX-280手提式高压杀菌锅 上海申安医疗器械厂;XB.K.25血球计数板型 上海求精生化试剂有限公司;GL-20G-Ⅱ高速冷冻离心机 上海安亭科学仪器厂;WH-2微型漩涡混合仪 上海沪西分析仪器有限公司;SL602N高精显电子天平 上海民桥精密科学仪器有限公司。
1.3方法
1.3.1酵母悬浮液的制作
膜醭毕赤酵母是用于酿造荔枝酒的酵母,酵母于4℃低温条件下保存在NYDA培养基。培养程序为:1)活化:在28℃条件下,酵母在NYDA培养基上培养48 h[13];2)液体培养:用接种环将活化好的酵母接种到NYDB液体培养基中,在200 r/min、28℃条件下培养24 h;3)离心分离:在5 000 r/min、4℃条件下,离心10 min,并用无菌水洗涤2次,除去培养介质;4)再悬浮及质量浓度确定:离心后的酵母细胞用无菌水重新悬浮,血球计数板计数,使用时再用无菌水稀释至所需质量浓度。
1.3.2青霉菌、绿霉菌和炭疽菌的培养
青霉菌和绿霉菌在PDA培养基于28℃条件下培养5 d,炭疽菌在PDA培养基于25℃条件下培养7 d,用无菌打孔器取直径为6 mm的菌块用于实验。得到的青霉菌、绿霉菌在PDA培养基上于28℃条件下培养7 d,用无菌水将孢子洗下,4层纱布过滤后,血球计数板计数,再用无菌水稀释至所需数量浓度。炭疽菌在PDA培养基于25℃条件下培养,待长出红色孢子后用无菌水将孢子洗下,4层纱布过滤后,血球计数板计数,再用无菌水稀释至所需数量浓度。青霉菌、绿霉菌孢子悬浮液数量浓度为1×104孢子/mL。炭疽菌孢子悬浮液数量浓度为1×105孢子/mL。
1.3.3膜醭毕赤酵母与杀菌剂的兼容性测定
分别称取一定量的多菌灵、甲基硫菌灵、抑霉唑、咪鲜胺、咪鲜胺锰盐和代森锌,用无菌水配制成一定质量浓度的杀菌剂溶液,与灭菌冷却至50℃左右的NYDA培养基(少加一定量水)混匀,配成含杀菌剂质量分数分别为100%、75%、50%、25%的NYDA培养基(以商业建议剂量为100%,多菌灵、甲基硫菌灵、抑霉唑、咪鲜胺、咪鲜胺锰盐和代森锌的标签建议剂量分别是500、700、500、250、500μg/mL和650μg/mL),以不含杀菌剂的NYDA培养基做对照。倒平板,冷却凝固后,接100μL104CFU/mL的酵母悬浮液涂布,在28℃条件下培养24 h后观察。每个质量分数3个平板,实验重复3次。
1.3.4病原菌对多菌灵和甲基硫菌灵的敏感性测定
将对酵母生长没有显著抑制作用的杀菌剂(多菌灵和甲基硫菌灵)用无菌水稀释10 000倍作为母液,取相应量加入灭菌冷却至50℃左右的PDA培养基中,混匀,配成最终质量浓度为0.005、0.025、0.05、0.25、0.5μg/mL的含杀菌剂培养基,以不含杀菌剂的PDA培养基作对照。倒平板,冷却凝固后,用灭菌的镊子将培养5 d的青霉菌、绿霉菌和培养7 d的炭疽菌菌饼接种到上述系列杀菌剂质量浓度的PDA培养基平板中央,青霉菌、绿霉菌在28℃培养4 d后,用十字交叉法测量菌落直径,炭疽菌在25℃培养7 d后测量菌落直径,生长抑制率计算如式(1)所示。以不同的杀菌剂质量浓度(μg/mL)为横坐标(x),以杀菌剂对病原菌菌丝的生长抑制率为纵坐标(y)作图,获得回归方程,计算杀菌剂对病原菌的半数抑制浓度(EC50),并按式(1)[14]计算抑制率。

1.3.5膜醭毕赤酵母结合杀菌剂对柑橘果实青霉、绿霉和炭疽病的防治效果
1.3.5.1接种病原菌后果实发病率测定
柑橘果实用2%次氯酸钠溶液浸泡2 min进行表面杀菌,然后用自来水冲洗,室温条件下晾干。将果实随机分成8组。用75%乙醇溶液擦拭果实赤道部位,用无菌打孔器在果实赤道部位对称打孔两个(5 mm×3 mm),分别接种30μL1×104孢子/mL青霉菌、绿霉菌孢子悬浮液和1×105孢子/mL炭疽菌孢子悬浮液。接种后的果实在20℃、相对湿度为80%~90%环境中放置24 h后,分别在如下溶液中浸泡2 min:A:无菌水(对照);B:1×108CFU/mL膜醭毕赤酵母;C:50μg/mL多菌灵(商业建议剂量的10%);D:500μg/mL多菌灵(商业建议剂量);E:50μg/mL多菌灵结合1×108CFU/mL膜醭毕赤酵母;F:70μg/mL甲基硫菌灵(商业建议剂量的10%);G:700μg/mL甲基硫菌灵(商业建议剂量);H:70μg/mL甲基硫菌灵结合1×108CFU/mL膜醭毕赤酵母。待果实晾干后单果包装,置于(25±2)℃、相对湿度80%~90%条件下贮藏,观察发病率。每个处理3次重复,每个重复6个果实。
1.3.5.2果实自然发病率测定
柑橘果实用2%次氯酸钠浸泡2 min表面杀菌,然后用自来水冲洗,室温条件下晾干。将果实随机分成8组,分别在如下溶液中浸泡2 min:A:无菌水作为对照;B:1×108CFU/mL膜醭毕赤酵母;C:125μg/mL多菌灵(商业建议剂量的25%);D:500μg/mL多菌灵(商业建议剂量);E:125μg/mL多菌灵结合1×108CFU/mL膜醭毕赤酵母;F:175μg/mL甲基硫菌灵(商业建议剂量的25%);G:700μg/mL甲基硫菌灵(商业建议剂量);H:175μg/mL甲基硫菌灵结合1×108CFU/mL膜醭毕赤酵母。晾干后单果包装,置于25℃条件下贮藏,每隔7 d调查发病率,计算方法如式(2)所示,统计病情指数,计算协同作用因数。每个处理3个重复,每个重复20个果实。

病情指数测定参照Hofman等[15]的方法,按病斑面积(V)进行如下分级:0级:无病斑;1级:0<V≤5%;2级:5%<V≤15%;3级:15%<V≤30%;4级:30%<V≤50%;5级:V>50%。计算如式(3)所示:

增效作用[9]:保护效力(protection efficacy,PE)取值范围为0(没有保护效力)~100(最大保护效力),计算如式(4)所示:

式(4)中:C为对照组果实发病个数;T为处理组(酵母菌、杀菌剂、酵母菌+杀菌剂)果实发病个数。
协同作用因数(synergy factor,SF)计算如式(5)所示:

式(5)中:E(obs)和E(exp)分别为实验观察和期望得到的PE(酵母+杀菌剂)。
期望得到的PE值E(exp)计算如(6)所示:

式(6)中:a为酵母单独使用的PE值;b为杀菌剂单独使用的PE值。
如果SF=1,表明酵母和杀菌剂之间产生叠加作用;SF>1,表明两者之间产生协同作用;SF<1,表明两者之间产生拮抗作用。
1.4数据分析
运用Excel 2013统计分析所有数据,计算标准误并制图;应用SPSS 19.0软件对数据进行方差分析(ANOVA),利用Duncan’s多重比较对差异显著性进行分析,P<0.05表示差异显著。
2 结果与分析
2.1膜醭毕赤酵母与杀菌剂的兼容性
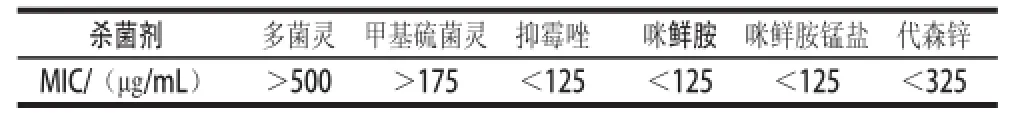
表1 杀菌剂对膜醭毕赤酵母生长的最小抑制浓度(minimum inhibitory concentration,MIC)Table 1 Minimum inhibitory concentration of fungicides toward the in vitro growth of the biocontrol yeast P. membranaefaciens
体外培养实验结果(表1)表明,多 菌灵(MIC>500μg/mL)对膜醭毕赤酵母的生长没有抑制作用,甲基硫菌灵在高质量浓度时会影响膜醭毕赤酵母的生长,在质量浓度低于商业建议剂量的25%时(MIC>175μg/mL)对酵母菌的生长没有抑制。而抑霉唑、咪鲜胺、咪鲜胺锰盐和代森锌会强烈抑制膜醭毕赤酵母的生长。故多菌灵和低质量浓度的甲基硫菌灵(商业建议剂量的25%)可以和膜醭毕赤酵母结合来控制柑橘果实的采后侵染性病害。
2.2柑橘果实病原菌对杀菌剂的敏感性
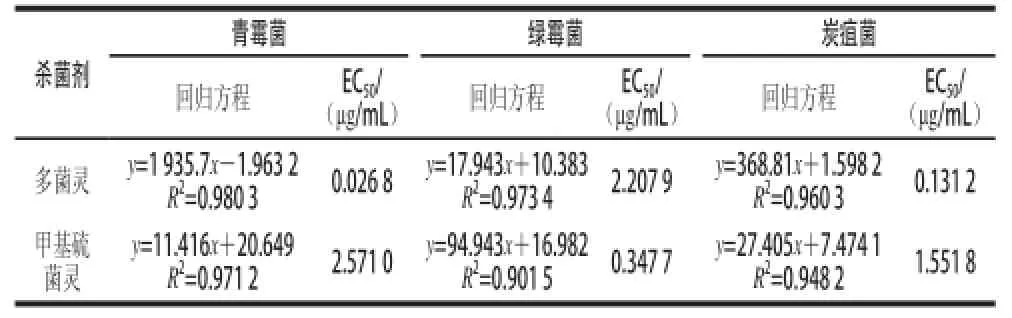
表2 多菌灵和甲基硫菌灵对青霉菌、绿霉菌和炭疽菌菌丝扩展的影响Table 2 Effect of fungicides on the hyphal growth and development ofP. italicum P. digitatum and C. gloeosporioides
表2结果表明,青霉菌、绿霉病和炭疽病对多菌灵和甲基硫菌灵的敏感程度不同。甲基硫菌灵对青霉菌菌丝扩展的EC50为2.571 0μg/mL,而多菌灵对青霉菌菌丝扩展的EC50为0.026 8μg/mL,通过比较两种杀菌剂对青霉菌菌丝扩展的EC50得出,青霉菌对多菌灵更敏感,甲基硫菌灵次之。与青霉菌的结果相反,绿霉菌对甲基硫菌灵更敏感,多菌灵次之。与青霉菌的结果一致,炭疽菌对多菌灵更敏感,甲基硫菌灵次之。
2.3膜醭毕赤酵母结合杀菌剂对柑橘果实接种发病率的影响

表3 膜醭毕赤酵母结合杀菌剂对夏橙接种发病率的影响Table 3 Effect ofP. membranaefacienscombined with fungicides on the infection rate of Olinda Valencia orange%
表3结果表明,膜醭毕赤酵母结合低剂量的多菌灵对夏橙接种青、绿霉病和炭疽病的防治效果均显著好于对照组和酵母单独处理组,与多菌灵单独处理组无显著性差异,但结合组的发病率低于低剂量单独处理组。膜醭毕赤酵母结合低剂量的甲基硫菌灵对夏橙接种青、绿霉病防治效果均显著好于对照组和膜醭毕赤酵母单独处理组,结合组的发病率与低剂量单独处理组相当并低于低剂量单独处理组。结合处理对夏橙接种炭疽病的防治效果不佳。表4结果表明,膜醭毕赤酵母结合低剂量的多菌灵对锦橙接种青、绿霉病和炭疽病的防治效果均显著好于空白组和膜醭毕赤酵母单独处理组,与多菌灵单独处理组无显著性差异,但结合组的发病率低于低剂量单独处理组。膜醭毕赤酵母结合低剂量的甲基硫菌灵对锦橙接种青、绿霉病和炭疽病的防治效果均显著好于对照组和膜醭毕赤酵母单独处理组,结合组的发病率与低剂量单独处理组相当并低于低剂量单独处理组。
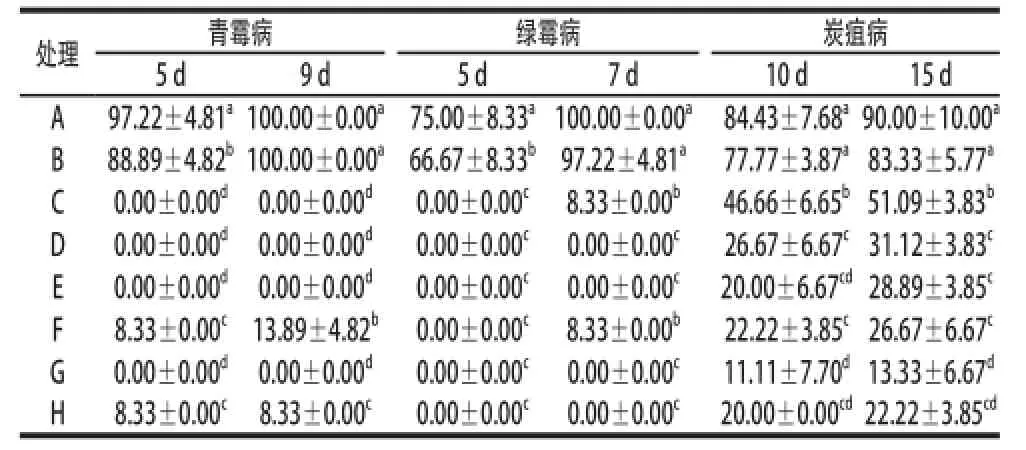
表4 膜醭毕赤酵母结合杀菌剂对锦橙接种发病率的影响Table 4 Effect of P. membranaefaciens combined with fungicides on the infection rate of Jincheng%
2.4膜醭毕赤酵母与杀菌剂结合对柑橘果实自然发病情况的影响
2.4.1膜醭毕赤酵母与杀菌剂结合对柑橘果实自 然发病率的影响
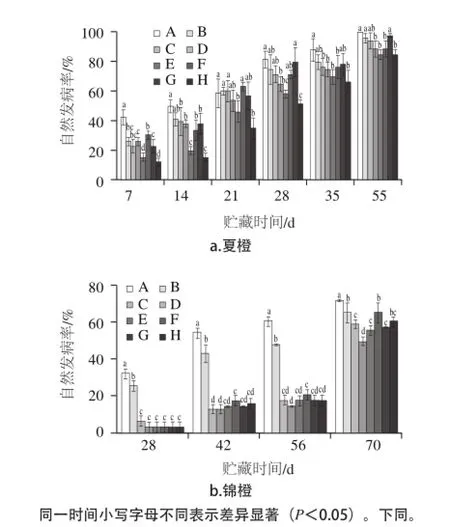
图1 膜醭毕赤酵母结合杀菌剂对柑橘果实自然发病率的影响Fig.1 Effect of P. membranaefaciens in combination with fungicides on the disease incidence of citrus
如图1a所示,在夏橙贮藏前28 d和贮藏第55天,膜醭毕赤酵母结合低剂量杀菌剂处理组的果实自然发病率均显著低于对照组和酵母单独处理组(P<0.05)。随着贮藏时间的延长,膜醭毕赤酵母单独处理和25%多菌灵处理对病害的控制效力下降。贮藏前21 d,结合处理组果实的自然发病率显著低于与其他处理组。 贮藏28~55 d范围内,膜醭毕赤酵母结合25%多菌灵处理组果实的发病率与全剂量多菌灵处理组相当并低于其他各组。而膜醭毕赤酵母结合25%甲基硫菌灵处理组果实发病率在贮藏第35、55天与25%甲基硫菌灵处理组没有显著性差异,前者低于后者。贮藏28 d之后,全剂量的甲基硫菌灵处理组果实发病率急剧上升,与对照组无显著性差异。贮藏第55天,对照组的发病率达到100%,酵母组为96.30%,25%多菌灵组为94.44%,25%甲基硫菌灵组为88.89%,膜醭毕赤酵母结合25%多菌灵处理组为85.19%,膜醭毕赤酵母结合25%甲基硫菌灵处理组为85.19%。由图1a可以得出,膜醭毕赤酵母结合低剂量的多菌灵或甲基硫菌灵均可以很好地控制夏橙自然发病率。
如图1b所示,在锦橙贮藏前56 d,膜醭毕赤酵母结合低剂量杀菌剂处理组的果实自然发病率均显著低于对照组和膜醭毕赤酵母单独处理组(P<0.05),与杀菌剂单独处理组的果实自然发病率没有显著性差异。随着贮藏时间的延长,各个处理对病害的控制效力下降。贮藏第70天,结合处理组与低剂量杀菌剂处理组的果实自然发病率相当并低于后者。贮藏第70天,膜醭毕赤酵母结合25%多菌灵的发病率比对照组低15.88%,比25%多菌灵单独处理组低3.18%;膜醭毕赤酵母结合25%甲基硫菌灵的发病率比对照组低11.11%,比25%甲基硫菌灵单独处理组低4.76%。由图1b可以得出,膜醭毕赤酵母结合低剂量的多菌灵或甲基硫菌灵均可以很好地控制锦橙自然发病率。
2.4.2膜醭毕赤酵母与杀菌剂结合对柑橘果实自然发病病情指数的影响
如图2a所示,通过对膜醭毕赤酵母结合低剂量杀菌剂处理夏橙果实病情指数的统计发现,病情指数表现出与自然发病率相似的结果。随着贮藏时间的延长,各个处理组的病情指数逐渐上升。在整个贮藏期间,对照组的病情指数显著高于膜醭毕赤酵母结合杀菌剂处理组,结合处理组的病情指数均小于其他处理组。在贮藏第55天,酵母结合低剂量多菌灵处理组的病情指数显著低于多菌灵单独处理组,酵母结合低剂量甲基硫菌灵处理组的病情指数与低剂量单独处理组没有显著性差异。换言之,结合处理组不仅保证了低的自然发病率还保证了较小的病斑。
如图2b所示,通过对膜醭毕赤酵母结合低剂量杀菌剂处理锦橙果实病情指数的统计发现,病情指数表现出与自然发病率相似的结果。随着贮藏时间的延长,各个处理组的病情指数逐渐上升。在整个贮藏期间,对照组和酵母单独处理组的病情指数显著高于酵母结合杀菌剂处理组。在贮藏第70天,酵母结合低剂量多菌灵处理组的病情指数显著低于低剂量多菌灵单独处理组,与全剂量多菌灵处理组无显著性差异;酵母结合低剂量甲基硫菌灵处理组的病情指数显著低于低剂量单独处理组。换言之,结合处理组不仅保证了低的自然发病率还保证了较小的病斑。

图2 膜醭毕赤酵母结合杀菌剂对柑橘自然发病病情指数的影响Fig.2 Effect ofP. membranaefaciensin combination with low doses of fungicides on the disease index of citrus
2.4.3协同作用因数

表5 不同杀菌剂和膜醭毕赤酵母结合使用的协同作用因数Table 5 Values of synergy factor forP. membranaefacienscombine with a low dose of different fungicides
通过对夏橙贮藏第14、28天和锦橙贮藏第28、70天的协同作用因数计算,以确定膜醭毕赤酵母和两种杀菌剂是增效作用、叠加作用还是拮抗作用。在夏橙果实上多菌灵和甲基硫菌灵和酵母结合,两者之间是增效作用。而在锦橙果实上,酵母和两种杀菌剂之间是叠加作用。故多菌灵、甲基硫菌灵可以和膜醭毕赤酵母结合,用于柑橘病害的防治。
3 讨论与结论
目前消费者对柑橘果实安全性要求的提高和相关国家法律法规和标准中对果蔬农残要求的进一步严格化[16],迫使人们寻找控制柑橘采后病害的新措施以替代或减少化学杀菌剂的危害[17-18]。利用拮抗酵母来防治采后微生物病害被认为是最有潜力的方法之一[19]。有研究表明,将拮抗酵母与其他天然物质或低剂量的化学合成杀菌剂结合使用,能进一步强化酵母对果实采后病害的控制效果。Lima等[9]将对杀菌剂有抗性的生防酵母(Rhodosporidium kratochvilovaeLS11和Cryptococcus laurentiiLS28)结合低剂量的啶酰菌胺或嘧菌环胺处理苹果果实,不但能有效控制扩展青霉对果实的侵染,减少果实表面杀菌剂的残留量,而且降低了展青霉毒素对果实的污染,二者在病害控制上展现出协同作用。本实验研究结果表明,膜醭毕赤酵母复合低剂量多菌灵和甲基硫菌灵,对控制柑橘接种青霉病、绿霉病、炭疽病有很好的效果。同时在较长的贮藏周期中,酵母复合低剂量多菌灵或甲基硫菌灵能显著的抑制柑橘果实自然发病率及病情指数的上升。同时,增效因子的评价结果表明,酵母与低剂量的杀菌剂在夏橙采后病害控制上有明显的增效作用。
增效和叠加作用的产生涉及果实、病原菌、酵母菌三者之间的相互作用[20-21]。对拮抗酵母菌来讲,能快速在果实伤口定植、生长和病原菌进行营养和空间的竞争对其生防效力的发挥是至关重要的;杀菌剂对病原菌的生长有直接的杀灭或抑制作用。体外实验的研究结果表明,与酵母具有良好兼容性的杀菌剂对病原 菌菌丝生长具有显著的抑制作用。说明低剂量杀菌剂通过对病原菌的抑制作用,强化了酵母的营养和空间竞争能力。膜醭毕赤酵母和低剂量的多菌灵或甲基硫菌灵复配使用,显著降低了柑橘果实贮藏病害发生,一方面与两种杀菌剂对病原菌的直接杀灭和抑制作用有关,另一方与膜醭毕赤酵母诱导果实产生的抗性有关。前期研究表明,膜醭毕赤酵母可以诱导柑橘果实的抗病性,延缓果实衰老[22]。
本实验研究表明,苯并咪唑类杀菌剂多菌灵和甲基硫菌灵在一定质量浓度条件下不抑制膜醭毕赤酵母的生长。柑橘侵染性病害病原菌青霉菌、绿霉菌和炭疽菌对以上两种杀菌剂的敏感性很强。膜醭毕赤酵母结合低剂量的多菌灵或甲基硫菌灵对柑橘接种青霉病、绿霉病的防治效果均好于酵母和低剂量杀菌剂单独处理。膜醭毕赤酵母结合低剂量的甲基硫菌灵在夏橙上对接种炭疽病防治效果不佳。在自然发病率实验中,膜醭毕赤酵母和低剂量的多菌灵或甲基硫菌灵结合,呈现增效作用,能够很好控制夏橙和锦橙采后侵染性病害的发生。
[1] FAO. Citrus is the first fruit tree-crop in terms of production with more than 128 MT per year[EB/OL]. [2014-12-01]. http://faostat.fao.org/.
[2] SCHIRRA M, D’AQUINO S, CABRAS P, et al. Control of postharvest diseases of fruit by heat and fungicides: efficacy, residue levels, and residue persistence. A review[J]. Agricultural and Food Chemistry, 2011, 59: 8531-8542.
[3] SHARMA R R, SINGH D, SINGH R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: a review[J]. Biological Control, 2009, 50: 205-221.
[4] SMILANICK J L, MANSOUR M F, MARGOSAN D A, et al. Influence of pH and NaHCO3on effectiveness of imazalil to inhibit germination ofPenicillium digitatumand to control postharvest green mold on citrus fruit[J]. Plant Disease, 2005, 89: 640-648.
[5] JANISIEWICZ W J, KORSTEN L. Biological control of postharvest diseases of fruits[J]. Annual Review of Phytopathology, 2002, 40: 411-441.
[6] LIMA G, SPINA A M, CASTORIA R, et al. Integration of biocontrol agents and food-grade additives for enhancing protection of apples fromPenicillium expansumduring storage[J]. Journal of Food Protection, 2005, 68: 2100-2106.
[7] LIMA G, de CURTIS F, de CICCO V. Interaction of microbial biocontrol agents and fungicides in the control of postharvest diseases[J]. Stewart Postharvest Review, 2008, 1: 1-7.
[8] DROBY S, WISNIEWSKI M, MACARISIN D, et al. Twenty years of postharvest biocontrol research: is it time for a new paradigm?[J]. Postharvest Biology and Technology, 2009, 52: 137-145.
[9] LIMA G, CASTORIA R, de CURTIS F, et al. Integrated control of blue mould using new fungicides and biocontrol yeasts lowers levels of fungicide residues and patulin contamination in apples[J]. Postharvest Biology and Technology, 2011, 60(2): 164-172.
[10] CASTORIA R, MORENA V, CAPUTO L, et al. Effect of the biocontrol yeastRhodotorula glutinisstrain LS11 on patulin accumulation in stored apples[J]. Phytopathology, 2005, 95(11): 1271-1278.
[11] CASTORIA R, MANNINA L, LUCIA M, et al. Nuovi dati sul decremento di patulina causato da un lievito di biocontrollo in mele infettate daPenicillium expansum[J]. Rapporti ISTISAN, 2007, 37: 147.
[12] ZHOU Yahan, MING Jian, DENG Lili, et al. Effect ofPichia membranaefaciensin combination with salicylic acid on postharvest blue and green mold decay in citrus fruits[J]. Biological Control, 2014, 74: 21-29.
[13]习柳,田世平.酵母拮抗菌与碳酸氢钠配合对番茄果实采后病害的防治效果研究[J].中国农业科学, 2005, 38(5): 950-955.
[14] HOLMES G J, ECKERT J W. Sensitivity ofPenicillium digitatumandP. italicumto postharvest citrus fungicides in California[J]. Postharvest Pathology and Mycotoxins, 1999, 89(9): 716-721.
[15] HOFMAN P J, BEASLEY D R, JOYCE D C, et al. Bagging of mango (Mangifera indicacv.‘Keitt’) fruit influences fruit quality and mineral composition[J]. Postharvest Biology and Technology, 1997, 12(1): 83-91.
[16]马强,祁春节.农药残留限量标准对中国大陆柑橘出口贸易影响的实证分析[J].华中农业大学学报:社会科学版, 2013(6): 53-58.
[17] DROBY S, CHALUTZ E, WILSON C L, et al. Biological control of postharvest diseases: a promising alternative to the use of synthetic fungicides[J]. Phytoparasitica, 1992, 20(Suppl 1): 149-153.
[18] JANISIEWICZ W J, KORSTEN L. Biological control of postharvest diseases of fruits[J]. Annual Review of Phytopathology, 2002, 40(1): 411-441.
[19] SPADAROD, GULLINO M L. State of the art and future prospects of the biological control of postharvest fruit diseases[J]. International Journal of Food Microbiology, 2004, 91(2): 185-194.
[20] TEIXID☒ N, VI☒AS I, USALL J, et al. Improving ecological fitness and environmental stress tolerance of the biocontrol yeast Candida sake by manipulation of intracellular sugar alcohol and sugar content[J]. Mycological Research, 1998, 102(11): 1409-1417.
[21] LIU J, WISNIEWSKI M, DROBY S, et al. Effect of heat shock treatment on stress tolerance and biocontrol efficacy ofMetschnikowia fructicola[J]. FEMS Microbiology Ecology, 2011, 76(1): 145-155.
[22] QING F, SHIPING T. Postharvest biological control ofRhizopusrot of nectarine fruits byPichia membranefaciens[J]. Plant Disease, 2000, 84(11): 1212-1216.
Combination ofPichia membranaefacienswith Fungicides for Control of Postharvest Diseases of Citrus Fruit
FENG Jirui1,2, ZHOU Yahan1, ZENG Kaifang1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Food Safety Supervision and Law Enforcement Team of Food and Drug Administration Karamay Xinjiang, Karamay 834000, China)
In order to reduce the dosage of fungicides and find an effective control method for postharvest diseases of citrus, the effect ofPichia membranefaciensin combination with low-dose fungicides (carbendazim and thiophanate-methyl) on the control of postharvest citrus diseases was studied. Fungicides which could be well combined withP. membranaefacienswere selected and the sensitivity of common citrus pathogens to the selected fungicides was verified. The postharvest fruits were then used to validate the controlling effect ofP. membranefacienscombined with fungicides on their diseases. Thein vitroexperiments showed that neither carbendazim nor thiophanate-methyl inhibited the growth ofP. membranaefaciens. However,Penicillium italicum,Penicillium digitatumandColletotrichum gloeosporioidesshowed different sensitivities to the two fungicides, but the EC50values were all lower than 1%of the recommended dosage. Thein vivoexperiments showed that the treatment withP. membranefaciensin combination with either carbendazim or thiophanate-methyl had a better control efficacy on blue mold and green mold than the individual treatments. However, the anthracnose rot in Valencia orange was not well controlled byPichia membranefacienscombined with thiophanate-methyl. The combined treatments had a synergistic control effect on the incidence of Valencia orange diseases and an additive effect on that of Jincheng, which could be an effecti ve strategy to maintain good commercial rates of Valencia orange and Jincheng.
Pichia membranaefaciens; fungicide; citrus fruit;postharvest diseases
S609.3;S667.7
A
1002-6630(2015)12-0249-05
10.7506/spkx1002-6630-201512047
2014-12-23
国家自然科学基金面上项目(31271958);重庆市科技攻关(应用技术研发类/重点)项目(cstc2012gg-yyjsB80003);公益性行业(农业)科研专项(201203034);中央高校基本科研业务费专项(XDJK2015D014)
冯吉睿(1990—),男,硕士研究生,研究方向为食品加工与安全。E-mail:qishui93@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:zengkaifang@163.com
