17β-雌二醇对H2O2致血管内皮损伤的保护作用及机制的研究
2015-01-05王朝霞范春雨吕吉元
王朝霞,赵 烨,范春雨,吕吉元
17β-雌二醇对H2O2致血管内皮损伤的保护作用及机制的研究
王朝霞,赵 烨,范春雨,吕吉元
目的 探讨17β-雌二醇对H2O2引起的血管内皮损伤的保护作用和可能的机制。方法 人脐静脉内皮细胞株在37 ℃、5%CO2,条件下正常培养至细胞形成致密单层时,分别进行干预。实验分为5组,空白对照组:细胞正常培养,含10%胎牛血清DMEM培养基培养;过氧化氢损伤组:将培养融合状态达到80%~90%的HUVEC,每孔加入终浓度为0.75 mmol/L的H2O2;H2O2损伤+17β-雌二醇保护组:H2O2损伤浓度同过氧化氢损伤组,17β-雌二醇终浓度0.1 mmol/L;单纯17β-雌二醇组:17β-雌二醇终浓度0.1 mmol/L;H2O2损伤+17β-雌二醇保护+渥曼青霉素组 H2O2损伤浓度同过氧化氢损伤组,17β-雌二醇终浓度0.1 mmol/L,渥曼青霉素终浓度100 nmol/L。收集干预后的各组细胞,Western-blot法检测细胞内PI3K/Akt蛋白表达情况,用CCK-8法比较细胞活性,流式细胞技术测定细胞凋亡率,荧光探针标记法测定细胞内活性氧(ROS)水平。结果 17β-雌二醇可以明显提高氧化应激损伤组内皮细胞中PI3K/Akt的表达,17β-雌二醇可以明显提高H2O2损伤后血管内皮细胞的存活率,降低早期和晚期凋亡率,并且减少H2O2损伤后血管内皮细胞内的ROS含量,差异有统计学意义(P<0.001),在加入PI3K/Akt通路的特异性抑制剂渥曼青霉素以后,17β-雌二醇抗氧化损伤的作用明显减弱。结论 17β-雌二醇通过上调H2O2导致的血管内皮细胞损伤后胞内PI3K/Akt蛋白的表达,提高细胞存活率,发挥抗氧化损伤和抗细胞凋亡作用,这可能是雌激素发挥心血管保护效应的重要途径之一。
血管内皮损伤;17β-雌二醇;氧化应激; PI3K/Akt信号通路
中国的女性死因排序中,心血管疾病死亡率已超过了脑卒中和肿瘤,成为首位死亡原因。血管内皮细胞受损是动脉粥样硬化的始动环节,也是很多心血管疾病的病理基础。近年来活性氧自由基对血管内皮的损伤作用已引起人们的广泛重视,在一些损伤因素的作用下,细胞内氧化代谢物增加,或细胞中抗氧化保护机制不足时,使活性氧(ROS)产生堆积并对细胞产生毒性,这种氧化和抗氧化的不平衡状态称之为氧化应激。活性氧可以导致内皮细胞受损凋亡,保护内皮细胞和防止其凋亡,对防止心血管疾病具有重要的意义。雌激素(estorgen,E)具有保护女性心血管系统、防止和延缓动脉粥样硬化形成以及提高女性冠状动脉硬化性心脏病(coronary heart disease,CHD)患者生存率和生活质量的作用,绝经后的妇女接受雌激素替代疗法能降低患冠心病的风险达40%~50%[1,2],使女性死亡率下降89%[3]。血管内皮损伤是引发动脉粥样硬化和血管再狭窄的重要原因[4],已有研究提示17β-雌二醇可明显缩小球囊损伤术后的内皮损伤面积[5],抑制内皮细胞凋亡[6]。
近年研究认为,雌激素对血管内皮的保护作用可能来自两个方面:一是促进血管内皮功能恢复,二是促进血管内皮损伤修复[5],但作用机制不清。虽然雌激素在心血管领域的研究不少,但雌激素对血管内皮的损伤后保护作用机制目前研究尚不完全清楚,本研究旨在探讨雌激素对过氧化氢引起的内皮损伤的保护作用和可能的机制。
1 材料与方法
1.1 材料 人脐静脉内皮细胞(HUVEC)购自北京协和医科大学细胞中心,Dulbecco改良Eagle培养基(DMEM)、胰蛋白酶为美国GIBCO公司产品,17β-雌二醇购自美国Sigma公司,CCK-8购自碧云天试剂公司,小牛血清购自Hyclone公司,渥曼青霉素购自Alexis公司。
1.2 方法
1.2.1 细胞培养 人脐静脉内皮细胞采用含10%的胎牛血清的DMEM培养基培养,置入37 ℃,5%CO2细胞培养箱内,所有实验检测于培养3 d~4 d细胞达80%~90%融合状态后进行。
1.2.2 实验分组 空白对照组:细胞正常培养,含10%胎牛血清DMEM培养基培养;过氧化氢损伤组:将培养融合状态达到80%~90%的HUVEC,每孔加入终浓度为0.75 mmol/L的H2O2;H2O2损伤+17β-雌二醇保护组:H2O2损伤浓度同过氧化氢损伤组,17β-雌二醇终浓度0.1 mmol/L;单纯17β-雌二醇组:17β-雌二醇终浓度0.1 mmol/L; H2O2损伤+17β-雌二醇保护+渥曼青霉素组:H2O2损伤浓度同过氧化氢损伤组,17β-雌二醇终浓度0.1 mmol/L,渥曼青霉素终浓度100 nmol/L。
1.2.3 Western-blot检测细胞中PI3K/Akt蛋白含量变化 不同干预后,检测各组PI3K/Akt蛋白的含量,按照试剂盒操作说明逐步操作,提取细胞蛋白并进行浓度测定,进行SDS-PAGE电泳和转膜、免疫反应和曝光,利用Quantity one 图像分析软件分析实验结果。
1.2.4 CCK-8法检测细胞活性 细胞接种于96孔板,无血清培养24 h后,弃无血清培养液,暴露于含H2O2的培养液,继续培养12 h;17β-雌二醇与渥曼青霉素在暴露前6 h加入。培养结束,培养液中按1∶10比例加入CCK-8液,37 ℃孵箱继续孵育1 h,酶标仪450 nm处检查每孔的吸光度OD值。细胞存活率(%)=处理组OD值/对照组OD组×100%。
1.2.5 Annexin-V/PI联合染色流式细胞术检测细胞凋亡率 细胞接种于6孔板,不同处理后,弃培养液,磷酸盐缓冲液(PBS)洗3遍,0.25%胰蛋白酶消化1 min,含胎牛血清的培养液终止消化,移入离心管,1 000 r/min离心5 min,弃上清,加Annexin-V/PI液,避光孵育20 min,上流式细胞仪检测细胞凋亡率。
1.2.6 流式细胞术检测HUVEC内ROS含量 细胞按1×105/mL密度接种于6孔板,每孔1 mL。收集各组细胞,去除培养基,各孔加入1 mL浓度为10 μmol/L的DCFH-DA探针,继续孵育20 min,然后用无血清培养液洗涤3次,PBS液洗涤1次,0.25%胰蛋白酶500 mL消化2 min,冰浴终止消化,移入离心管,1 000 r/min离心5 min,弃上清,加入适量Barfer,上流式细胞仪检测细胞内ROS的量。
1.2.7 荧光探针标记法测定HUVEC内ROS活性 具体探针标记方法同上,用无血清培养液及PBS也洗涤以后,荧光显微镜下观察细胞内ROS表达情况。

2 结 果
2.1 Western-blot检测细胞中PI3K/Akt蛋白含量变化 H2O2损伤引起的氧化应激可以刺激细胞中PI3K/Akt蛋白表达轻度上调,从而发挥抗氧化作用,与空白对照组相比,H2O2损伤组PI3K表达0.540±0.033、0.570±0.039,差异无统计学意义,Akt表达差异有统计学意义(0.560±0.038 vs 0.310±0.011,P<0.05)。H2O2损伤在有17β-雌二醇保护剂条件下,细胞内抗氧化相关通路蛋白PI3K、Akt表达明显升高(0.850±0.046、0.740±0.042,P<0.001)。详见图1。
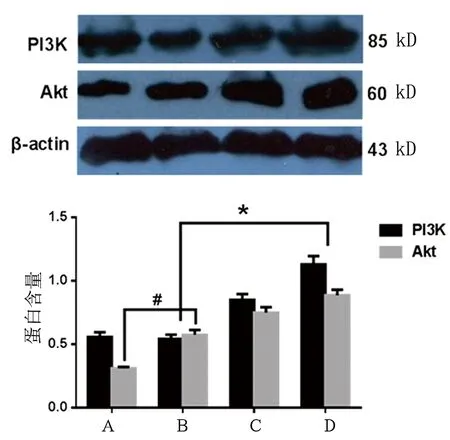
注:A为空白对照组;B为H2O2损伤组;C为H2O2损伤+17β-雌二醇保护组;D为17β-雌二醇组。H2O2损伤组与对照组、17β-雌二醇保护组、17β-雌二醇保护+渥曼青霉素组比较,P<0.001。
图1 Western-blot检测细胞中PI3K/Akt蛋白含量变化
2.2 CCK-8检测细胞存活率 17β-雌二醇可以明显减少氧化应激引起的细胞凋亡,增加细胞存活率(见图2)。加入CCK-8试剂后,培养孔中活细胞数越多,对应的450 nm处吸光度值越高。实验表明,不同干预组细胞的存活率不同,氧化应激损伤组细胞存活率最低,细胞活性为对照组的(30.95±1.95)%,氧化应激损伤组与对照组比较差异有统计学意义(P<0.001)。加入17β-雌二醇,可以明显减少氧化应激引起的细胞损伤死亡,细胞存活率明显提高为对照组的(72.63±3.51)%,H2O2+17β-雌二醇组与对照组比较差异有统计学意义(P<0.001),而H2O2+17β-雌二醇组加入PI3K/Akt抑制剂渥曼青霉素细胞存活率又有所下降,为(42.50±2.28)%。H2O2损伤组与H2O2加17β-雌二醇组比较差异有统计学意义(P<0.001),H2O2损伤组与H2O2+17β-雌二醇+渥曼青霉素组比较差异有统计学意义(P<0.001),H2O2+17β-雌二醇组与H2O2+17β-雌二醇+渥曼青霉素组的差异有统计学意义(P<0.001)。

注:A为空白对照组;B为H2O2损伤组;C为H2O2损伤+17β-雌二醇保护组;D为17β-雌二醇组;E为H2O2损伤+17β-雌二醇保护+渥曼青霉素组。H2O2损伤组与对照组、17β-雌二醇保护组、17β-雌二醇保护+渥曼青霉素相比较,P<0.001。
图2 CCK-8法检测各组细胞活性的结果
2.3 流式细胞术细胞凋亡率检测结果 流式细胞术检测的各不同干预组细胞凋亡率不同(见图3),H2O2损伤组细胞凋亡率明显高于对照组,分别为(51.22±1.78)%和(12.18±0.69)%,差异有统计学意义(P<0.001),H2O2损伤组和17β-雌二醇保护组差异有统计学意义,分别为(51.22±1.78)%和(33.38±1.15)%,差异有统计学意义(P<0.001),损伤加入保护剂后可以明显减少细胞凋亡情况。加入PI3K/Akt抑制剂渥曼青霉素后凋亡率增加,为(41.22±1.32)%,与H2O2损伤组和17β-雌二醇保护组相比较,差异有统计学意义(P<0.001)。
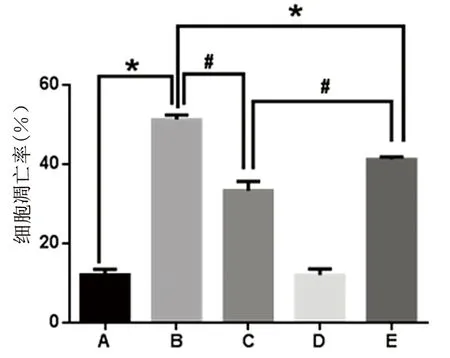
注:A为空白对照组;B为H2O2损伤组;C为H2O2损伤+17β-雌二醇保护组;D为17β-雌二醇组;E为H2O2损伤+17β-雌二醇保护+渥曼青霉素组。右下和右上象限分别代表早期凋亡细胞和晚期凋亡细胞,左下代表正常细胞。H2O2损伤组与对照组、17β-雌二醇保护组、17β-雌二醇保护+渥曼青霉素组比较,P<0.001。
图3 流式细胞仪检测各组细胞凋亡率
2.4 流式细胞术检测HUVEC内ROS含量 定量检测各组细胞内ROS含量不同(见图4),H2O2损伤组表达明显高于其他组,与对照组和17β-雌二醇保护组相比较差异具有统计学意义(P<0.001),Mean值分别为(53.72±1.25)、(16.07±0.61)、(26.38±0.78),17β-雌二醇可下调H2O2引起的细胞内ROS含量,减少氧化应激损伤。
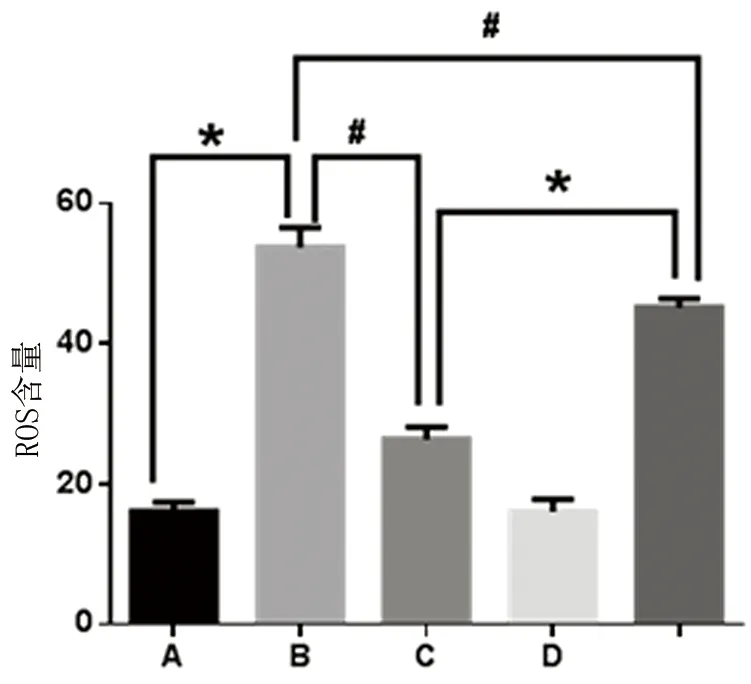
注:A为空白对照组;B为H2O2损伤组;C为H2O2损伤+17β-雌二醇保护组;D为17β-雌二醇组。H2O2损伤组与对照组、17β-雌二醇保护组、17β-雌二醇保护+渥曼青霉素组相比较,P<0.001。
图4 流式细胞仪检测DCFH-DA探针标记各组细胞内ROS含量
2.5 荧光显微镜观察HUVEC内ROS活性检测结果 H2O2损伤可使细胞内ROS生成增加,17β-雌二醇可减弱该作用,定性观察可见各组ROS染色表达强度不同,17β-雌二醇可以减弱H2O2损伤导致的细胞内ROS产生。
3 讨 论
冠心病和高血压等心血管疾病在绝经前女性中的发病率明显低于同龄男性[7]。同时发现,绝经后女性的心血管疾病发病率明显高于绝经前女性,这提示可能与绝经期体内雌激素水平降低有关[8]。在动物实验研究表明雌激素对心血管具有保护作用[9,10],这一点在20世纪90年代关于绝经后女性是否使用雌激素具有保护心血管的作用的流行病学研究中得到支持[11-13],甚至当时有观察性研究提示,绝经后女性使用雌激素可以降低高达50%的心血管疾病危险性[1],后来Stefanick等[14]关于使用雌激素和心血管疾病的Meta分析得出结论,绝经后使用雌激素可以减少30%的心血管疾病的发病率。但是在两个荟萃分析研究中发现,既往存在心血管疾病的妇女,在绝经后使用雌激素治疗并不能起到保护心血管的作用[15,16]。雌激素对早期的动脉粥样硬化性心血管疾病具有一级保护作用,但是对高级别的心血管疾病没有二级保护作用。
研究证明雌激素不仅限于对动脉粥样硬化性心血管病有保护作用,而且对炎症性刺激导致的增殖性血管疾病也有保护作用,如Kaposi肉瘤(KS),一种罕见的血管增殖性疾病,来源于内皮细胞,HHV8在男女两性的流行病学检出率是一致的[17],由此看来,雌激素对该种血管疾病的保护作用要超过对动脉粥样硬化性心血管疾病的作用。
原则上来说,血管壁的所有组分都对雌激素有反应,包括各种血管内皮细胞,血管平滑肌细胞,心肌细胞和成纤维细胞。雌激素可以影响许多在炎症性和增殖性血管性疾病中基因的表达,包括动脉粥样硬化。直接影响的基因包括细胞活性分子,例如黏附分子、激素受体,还包括炎症相关性,血管重建,血管再生和血管张力相关的特殊基因表达。
核因子相关因子(Nrf22)是一个重要的氧化和电应力传感器,通过调节第二阶段的防御和抗氧化基因的转录激活保证氧化还原平衡的维护[18]。心血管疾病患者细胞内ROS升高,这导致血管内皮功能受损和一氧化氮的生物利用度降低[19]。血红素加氧酶-1(HO-1)是一种保护抗氧化酶,它在动脉粥样硬化病变中经常为过度表达,并且可被Nrf2调节[20]。Nrf2经历易位到细胞核,与抗氧化基因的抗氧化反应元件(ARE)相结合,促进转录。已经研究表明,大豆异黄酮的代谢物S-雌马酚可以激活Nrf2/ARE信号通路,这是细胞抗氧化反应的主要组成部分,这个反应是通过PI3K/Akt和ER途径介导的,表明这可能是大豆异黄酮保护血管内皮细胞免受氧化应激的具体机制[21]。最近的研究表明,Nrf2/ ARE信号通路可能是生物预防治疗动脉粥样硬化,糖尿病,高血压和中风的一个目标通路。其中该信号通路的上游介导通路PI3K/Akt通路在很多细胞内过程中都有参与,包括细胞增殖和细胞死亡。上述研究还表明,加入PI3K/Akt的阻滞剂7,4′-二羟基异黄酮可以阻断Nrf2的核迁移,这说明Nrf2发挥核内抗氧化作用主要是通过PI3K/Akt通路实现的[21]。本研究中重点检测该通路重要蛋白PI3K和Akt的表达情况,发现17β-雌二醇可以明显促进该通路核心蛋白的表达,作用同该通路的激活剂,从而使其介导下游通路发挥抗氧化作用,减轻血管内细胞损伤。
渥曼青霉素是一种真菌代谢产物,其通过与PI3K的催化亚单位p110结合,非竞争性和不可逆地抑制PI3K激酶活性,从而阻断PI3K/Akt信号通路,是PI3K的特异性抑制剂[22]。
已有很多研究表明,17β-雌二醇可能在心血管疾病发病过程中发挥作用,例如通过增强VEGF-A下游的Norch通路刺激血管新生,通过结合雌激素受体激活MAPK信号通路的非基因效应而促进血管内皮增殖。本研究发现17β-雌二醇可以明显提高H2O2损伤后血管内皮细胞的存活率,降低早期和晚期凋亡率,并且减少H2O2损伤后血管内皮细胞内的ROS含量,减少氧化应激导致的血管损伤,说明17β-雌二醇对于过氧化氢导致的血管内皮氧化应激损伤确实有保护作用。本研究发现17β-雌二醇可以明显上调氧化应激损伤组内皮细胞中PI3K/Akt的表达,从而介导细胞抗氧化反应的主要通路Nrf2/ ARE信号通路而发挥抗氧化作用;另外PI3K/Akt信号通路还具有抗细胞凋亡作用,但在加入该通路的特异性抑制剂渥曼青霉素以后,17β-雌二醇抗氧化损伤的作用明显减弱,说明PI3K/Akt信号通路可能都是17β-雌二醇抗氧化损伤的机制通路之一。
总之,虽雌激素可对女性心血管系统有多方面的作用,但对血管内皮细胞功能的调节在其心血管作用中占有重要地位,抗氧化损伤可能是雌激素产生心血管保护效应的重要途径。
[1] Manson JE,Martin KA.Clinical practice.Postmenopausal hormone-replacement therapy[J].N Engl J Med,2001,345(1):34-40.
[2] Dubey RK,Imthurn B,Zacharia LC,et al.Hormone replacement therapy and cardiovascular disease:What went wrong and where do we go from here?[J].Hypertension,2004,44(6): 789-795.
[3] Bush TL,Barrett-Connor E,Cowan LD,et al.Cardiovascular mortality and noncontraceptive use of estrogen in women:Results from the Lipid Research Clinics Program Follow-up Study[J].Circulation,1987,75(6):1102-1109.
[4] Ross R.The pathogenesis of atherosclerosis:A perspective for the 1990s[J].Nature,1993,362(6423): 801-809.
[5] Asahara T,Bauters C,Pastore C,et al.Local delivery of vascular endothelial growth factor accelerates reendothelialization and attenuates intimal hyperplasia in balloon-injured rat carotid artery[J].Circulation,1995,91(11):2793-2801.
[6] Spyridopoulos I,Sullivan AB,Kearney M,et al.Estrogen-receptor-mediated inhibition of human endothelial cell apoptosis.Estradiol as a survival factor[J].Circulation,1997,95(6): 1505-1514.
[7] Orshal JM,Khalil RA.Gender,sex hormones,and vascular tone[J].Am J Physiol Regul Integr Comp Physiol,2004,286(2): R233-249.
[8] Hodis HN,Mack WJ,Lobo RA,et al.Estrogen in the prevention of atherosclerosis.A randomized,double-blind,placebo-controlled trial[J].Ann Intern Med,2001,135(11): 939-953.
[9] Barrett-Connor E,Bush TL.Estrogen and coronary heart disease in women[J].JAMA,1991,265(14):1861-1867.
[10] Henderson BE,Paganini-Hill A,Ross RK.Decreased mortality in users of estrogen replacement therapy[J].Arch Intern Med,1991,151(1):75-78.
[11] Wolf PH,Madans JH,Finucane FF,et al.Reduction of cardiovascular disease-related mortality among postmenopausal women who use hormones:Evidence from a national cohort[J].Am J Obstet Gynecol,1991,164(2): 489-494.
[12] Grodstein F,Stampfer MJ,Manson JE,et al.Postmenopausal estrogen and progestin use and the risk of cardiovascular disease[J].N Engl J Med,1996,335(7):453-461.
[13] Grodstein F,Manson JE,Colditz GA,et al.A prospective,observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease[J].Ann Intern Med,2000,133(12): 933-941.
[14] Stefanick ML.Estrogens and progestins:Background and history,trends in use,and guidelines and regimens approved by the US Food and Drug Administration[J].Am J Med,2005,118(Suppl 12B):64-73.
[15] Vittinghoff E,Shlipak MG,Varosy PD,et al.Risk factors and secondary prevention in women with heart disease:The Heart and Estrogen/progestin Replacement Study[J].Ann Intern Med,2003,138(2):81-89.
[16] Herrington DM,Reboussin DM,Klein KP,et al.The estrogen replacement and atherosclerosis (ERA) study: Study design and baseline characteristics of the cohort[J].Control Clin Trials,2000,21(3):257-285.
[17] Calabro ML,Sheldon J,Favero A,et al.Seroprevalence of Kaposi’s sarcoma-associated herpesvirus/human herpesvirus 8 in several regions of Italy[J].J Hum Virol,1998,1(3): 207-213.
[18] McMahon M,Itoh K,Yamamoto M,et al.Keap1-dependent proteasomal degradation of transcription factor Nrf2 contributes to the negative regulation of antioxidant response element-driven gene expression[J].J Biol Chem,2003,278(24):21592-21600.
[19] Mann G.E,Bonacasa B,Ishii T,et al.Targeting the redox sensitive Nrf2-Keap1 defense pathway in cardiovascular disease:Protection afforded by dietary isoflavones[J].Curr Opin Pharmacol,2009,9(2):139-145.
[20] Anwar AA,Li FY,Leake DS,et al.Induction of heme oxygenase 1 by moderately oxidized low-density lipoproteins in human vascular smooth muscle cells:Role of mitogen-activated protein kinases and Nrf2[J].Free Radic Biol Med,2005,39(2):227-236.
[21] Zhang T,Liang X,Shi L,et al.Estrogen receptor and PI3K/Akt signaling pathway involvement in S-(-)equol-induced activation of Nrf2/ARE in endothelial cells[J].PLoS One,2013,8(11):e79075.
[22] Zhang D,Fan D.Multidrug resistance in gastric cancer:Recent research advances and ongoing therapeutic challenges[J].Expert Rev Anticancer Ther,2007,7(10):1369-1378.
(本文编辑 郭怀印)
山西医科大学第一医院(太原 030001)
吕吉元,E-mail:yaya20120710@163.com
R331.3 R256.2
A
10.3969/j.issn.1672-1349.2015.14.011
1672-1349(2015)14-1616-04
2015-06-25)
