CDC4及c-Myc在胃癌中的表达及临床意义
2015-01-04黄国全张才全吴泉峰孙建华
黄国全,黎 晖,张才全,吴泉峰,孙建华
1.湖北省恩施土家族苗族自治州中心医院胃肠外科,湖北 恩施 445000;
2.重庆医科大学附属第一医院胃肠外科,重庆 400016
CDC4及c-Myc在胃癌中的表达及临床意义
黄国全1,黎 晖2,张才全2,吴泉峰1,孙建华1
1.湖北省恩施土家族苗族自治州中心医院胃肠外科,湖北 恩施 445000;
2.重庆医科大学附属第一医院胃肠外科,重庆 400016
背景与目的:胃癌是全世界多发恶性肿瘤之一,其死亡率及术后复发率高。目前治疗胃癌的手段主要是手术及放化疗,但总体效果欠佳。随着经济及分子生物学的飞速发展,胃癌的早期诊断及分子靶向治疗成为全世界研究的热点。胃癌的发生、发展与抑癌基因的失活和癌基因的过表达相关。CDC4/Fbχw7为重要的抑癌基因。本实验通过研究CDC4(F框/WD-40域蛋白7,也称为FBXW7、Sel-10、Ago)及c-Myc蛋白在人胃癌组织中的表达,分析两者与胃癌临床病理特征的关系。方法:应用半定量逆转录聚合酶链反应(semiquantitative reverse transcription polymerase chain reaction,sRT-PCR)、免疫组化及蛋白[质]印迹法(Western blot)检测40例胃癌组织、癌旁组织及正常胃黏膜组织中CDC4、c-Myc的mRNA及蛋白的表达,并分析两者之间的相关性及与患者病理特征之间的关系。结果:胃癌中CDC4蛋白的表达明显低于癌旁组织及正常组织(P<0.05)。而c-Myc蛋白的表达在胃癌中显著增高,阳性率同癌旁组织及正常组织比较,差异有统计学意义(P<0.05)。CDC4、c-Myc蛋白及其mRNA的表达与胃癌患者的性别、年龄、肿瘤部位无关,而与肿瘤浸润深度、分化程度、TNM分期、有无淋巴结转移及有无远处转移有关(P<0.05)。CDC4和c-Myc在mRNA水平和蛋白水平的表达均呈负相关(P<0.05)。结论:CDC4在胃癌中表达量显著下降,可能与胃癌的浸润、分化及转移相关,其表达缺失可能导致c-Myc的过度表达。CDC4可能成为早期诊断、判断胃癌预后及浸润转移的生物学指标。
CDC4;c-Myc;免疫组化;半定量逆转录聚合酶链反应;蛋白[质]印迹法
胃癌是世界上最常见的恶性肿瘤之一,其发病率和病死率居各种恶性肿瘤之首[1-2],5年生存率仅为5%~15%[3]。CDC4(F框/WD-40域蛋白7,也称为FBXW7、Sel-10、Ago)是F-box蛋白家族成员,其基因在多种肿瘤中均有突变,表现为不同程度的缺失[4-8]。本实验通过检测CDC4、c-Myc蛋白的表达,探讨其与胃癌临床病理学特征之间的关系。
1 材料和方法
1.1 病理资料
收集重庆医科大学附属第一医院胃肠外科2010年10月—2011年9月确诊为胃癌的临床手术标本40例。所有患者术前均未行过放化疗,其中男性26例,女性14例,年龄38~78岁,平均年龄59.7岁。每例标本均收取癌组织、癌旁组织(距肿瘤边缘1.5~2.0 cm)及正常胃黏膜组织(距肿瘤边缘≥6 cm)。标本离体后迅速将每例标本分为3份,两份放入液氮中保存,供半定量逆转录聚合酶链反应(semi-quantitative reverse transcription polymerase chain reaction,sRTPCR)及蛋白[质]印迹法(Western blot)检测,余下的用4%多聚甲醛固定,石蜡包埋后供免疫组化检测。所有病例的临床资料完整。
1.2 主要试剂
鼠抗人CDC4单克隆抗体(ab74054)购自武汉艾美捷科技有限公司,兔抗人c-Myc多克隆抗体(bs-0842R)购自北京博奥森生物技术有限公司,免疫组化试剂盒CW2035和CW2068均购自北京康为世纪生物科技有限公司,辣根过氧化物酶标记山羊抗兔IgG(H+L)购自上海碧云天生物技术有限公司,SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术有限公司,蛋白提取试剂盒购自上海贝博生物试剂公司,RNA裂解液TRIzol购自上海贝博生物试剂公司,扩增试剂盒购自Fermentas中国公司。
1.3 实验方法
1.3.1 sRT-PCR检测胃癌组织中CDC4和c-Myc mRNA的表达
根据总RNA抽提试剂盒说明书提取胃癌组织总RNA,将RNA逆转录成cDNA,进行PCR扩增。扩增引物由生工生物工程(上海)股份有限公司设计合成。c-Myc基因扩增上游引物为5’-GACAGCAGCTCGCCCAAGT-3’,下游引物为5’-CTCCAGCAGAAGGTGATCCAG-3’,产物长度为253 bp。CDC4基因扩增上游引物为5’-GTGGGACATACAGGTGGA-3’,下游引物为5’-CAACGCACAGTGGAAGTA-3’,产物长度为146 bp。内参GAPDH基因扩增上游引物为5’-AAATCCCATCACCATCTTCCAG-3’,下游引物为5’-TGAGTCCTTCCACGAT ACCAAA-3’,产物长度为310 bp。扩增条件:94 ℃预变性5 min;95 ℃变性10 s,57 ℃退火20 s,72 ℃延伸40 s,共40个循环。扩增后取扩增产物各3 µL在1.5%琼脂糖凝胶电泳仪上鉴定,用Bio-Rad凝胶成像仪显像,并用Quantityone软件对结果进行分析。
1.3.2 Western blot检测胃癌组织中CDC4及c-Myc蛋白的表达
按试剂盒说明书提取上述胃癌标本的总蛋白,测定蛋白浓度后加入5×蛋白上样缓冲液煮沸5 min。配制5%浓缩胶和10%分离胶行SDS-PAGE凝胶电泳,根据蛋白Maker切胶并转移蛋白到PVDF膜上,5%脱脂奶粉封闭2 h,温育一抗(稀释比例均为1∶100),4 ℃过夜,并以GAPDH做内对照。PBST洗膜3次,每次10 min。温育二抗1 h后再用PBST洗膜3次,每次10 min。采用ECL显影试剂进行显影,Bio-Rad凝胶成像仪显像,并用Quantity-one软件对所得结果进行分析。
1.3.3 免疫组化检测胃癌组织中CDC4及c-Myc蛋白的表达
按免疫组化SP法操作说明书检测CDC4和c-Myc蛋白的表达。胃癌组织经4%多聚甲醛固定,石蜡包埋后,4 μm连续切片。将切片经二甲苯中脱蜡、乙醇梯度水化、阻断内源性过氧化物酶、抗原修复、正常山羊血清封闭后,滴加一抗(均为1∶100稀释),4 ℃过夜,再加入生物素化的二抗(37 ℃,30 min),滴加辣根酶标记链酶卵白素,DAB显色,镜下观察至出现黄色终止反应,苏木精复染,中性树胶封片后显微镜下采集图片。
所有免疫组化结果至少由2位未参与实验研究的病理科医生分别独立以盲法观察确定来计算细胞总数和阳性细胞数。若遇结果不一致时,则由2人商议做出决定。以细胞核和(或)细胞质内出现棕黄色颗粒为阳性,按照Beesley分级法[9],以阳性细胞所占百分比和着色强度进行分级:无阳性细胞或阳性细胞数小于10%为阴性(-),阳性细胞数10%~25%为弱阳性(+),阳性细胞数25%~50%为阳性(++),阳性细胞数大于50%为强阳性(+++)。
1.4 统计学处理
2 结 果
2.1 胃癌组织中CDC4和c-Myc的mRNA表达
本研究采用sRT-PCR法检测40例胃癌组织中CDC4及c-Myc的mRNA的表达。CDC4及c-Myc的mRNA在人胃癌组织、癌旁组织及正常组织的表达,差异无统计学意义(P<0.05,图1)。
CDC4 mRNA在胃癌组织中的表达水平较癌旁组织及正常胃黏膜中显著降低(P<0.05)。c-Myc mRNA在胃癌中的表达水平较癌旁组织及正常胃黏膜中则是明显升高(P<0.05)。随着肿瘤的分化程度的降低,TNM分期、浸润深度的增加,CDC4 mRNA的表达有显著下降趋势(P<0.05);而c-Myc mRNA的表达随着肿瘤的分化程度的降低,TNM分期、浸润深度的增加而显著升高(P<0.05)。CDC4 mRNA和c-Myc mRNA的表达与患者的年龄、性别、肿瘤的部位及淋巴结有无转移无关(表1)。
2.2 胃癌组织中CDC4及c-Myc 蛋白的表达
选取所收集的40例胃癌组织标本中的6例胃癌组织标本及对应的癌旁正常组织,同时从重庆医科大学附属第一医院标本库中选取6例胃正常黏膜组织标本均行Western blot检测CDC4的蛋白表达情况。采用Western blot法检测人胃癌组织、癌旁组织及正常组织中CDC4及c-Myc的蛋白的表达。结果发现,CDC4及c-Myc在胃癌组织、癌旁组织及正常组织中的表达差异有统计学意义(P<0.05,图2,表2)。
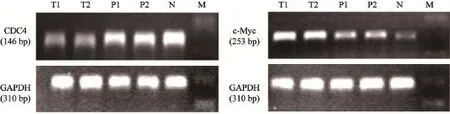
图1 RT-PCR法检测CDC4、c-Myc mRNA 的表达Tab. 1 The expressions of CDC4 mRNA and c-Myc mRNA detected by RT-PCR
表1 CDC4 mRNA和 c-Myc mRNA的表达与胃癌临床病理特征之间的关系Tab. 1 The correlation between the mRNA expression of CDC4, c-Myc and clinical pathological parameters in gastric cancer (±s)
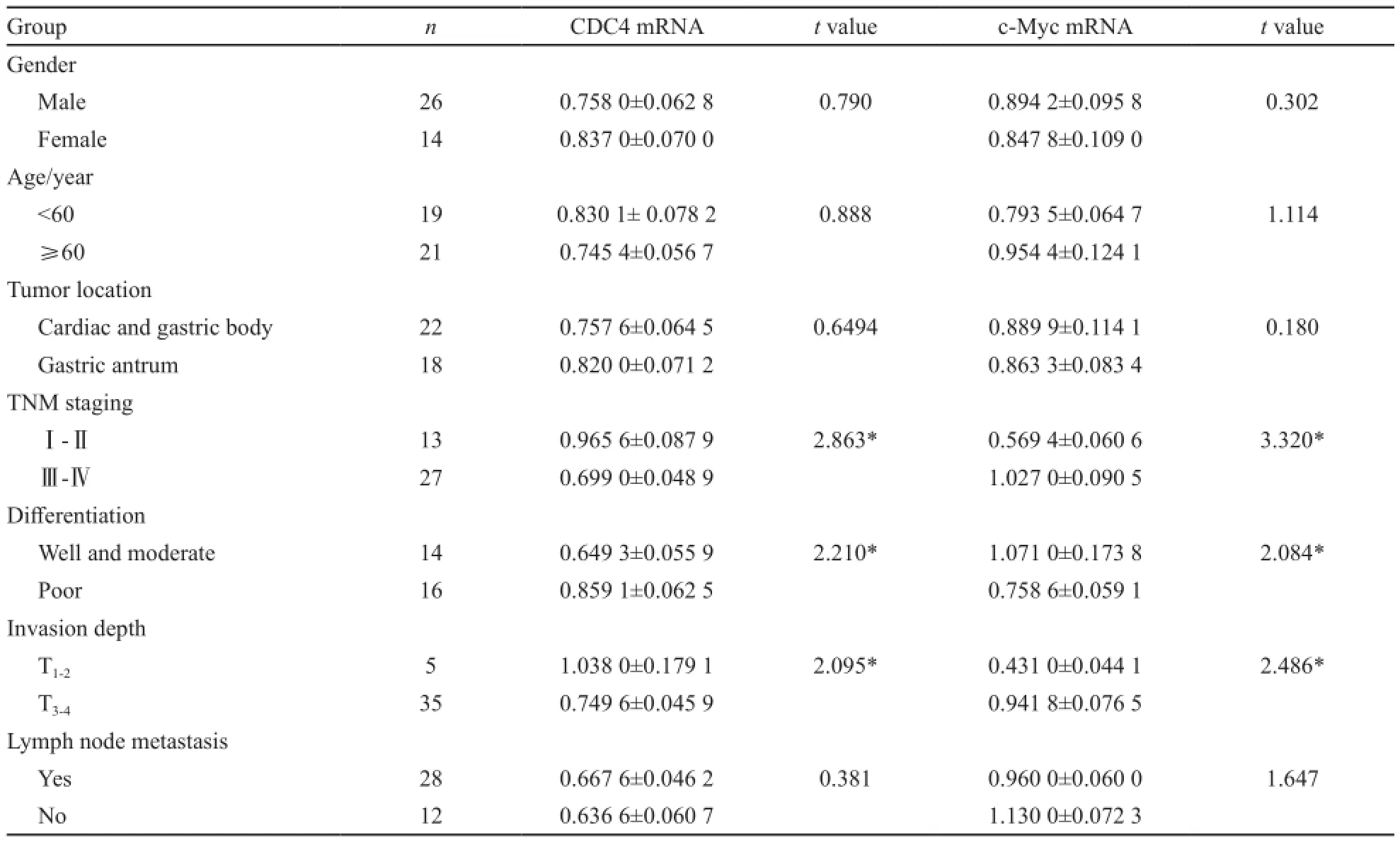
表1 CDC4 mRNA和 c-Myc mRNA的表达与胃癌临床病理特征之间的关系Tab. 1 The correlation between the mRNA expression of CDC4, c-Myc and clinical pathological parameters in gastric cancer (±s)
*: P<0.05, compared with corresponding group
Group n CDC4 mRNA t value c-Myc mRNA t value Gender Male 26 0.758 0±0.062 8 0.790 0.894 2±0.095 8 0.302 Female 14 0.837 0±0.070 0 0.847 8±0.109 0 Age/year <60 19 0.830 1± 0.078 2 0.888 0.793 5±0.064 7 1.114≥60 21 0.745 4±0.056 7 0.954 4±0.124 1 Tumor location Cardiac and gastric body 22 0.757 6±0.064 5 0.6494 0.889 9±0.114 1 0.180 Gastric antrum 18 0.820 0±0.071 2 0.863 3±0.083 4 TNM stagingⅠ-Ⅱ 13 0.965 6±0.087 9 2.863* 0.569 4±0.060 6 3.320*Ⅲ-Ⅳ 27 0.699 0±0.048 9 1.027 0±0.090 5 Differentiation Well and moderate 14 0.649 3±0.055 9 2.210* 1.071 0±0.173 8 2.084* Poor 16 0.859 1±0.062 5 0.758 6±0.059 1 Invasion depth 1.038 0±0.179 1 2.095* 0.431 0±0.044 1 2.486* T3-4 35 0.749 6±0.045 9 0.941 8±0.076 5 Lymph node metastasis Yes 28 0.667 6±0.046 2 0.381 0.960 0±0.060 0 1.647 No 12 0.636 6±0.060 7 1.130 0±0.072 3 T1-25
40例胃癌组织中CDC4的阳性表达率为52.5%;在癌旁组织及正常组织中分别为42.5%和70.0%。c-Myc在胃癌组织中阳性表达率为60.0%,在癌旁组织及正常胃黏膜组织中分别为45.0%和27.5%。统计学分析结果表明:与癌旁组织及正常组织相比,CDC4在胃癌组织中的表达明显下降,而c-Myc则显著增高(表3,图3)。
CDC4蛋白的表达在胃癌组织较癌旁组织及正常组织显著增高,c-Myc蛋白在胃癌组织中的表达较癌旁组织及正常胃黏膜组织则明显降低;随着肿瘤分化程度的降低、TNM分期的增加、肿瘤浸润深度越深,CDC4蛋白的表达显著下降(P<0.05)。而c-Myc蛋白的表达随着肿瘤分化程度的降低、TNM分期的增加、肿瘤浸润深度越深而显著升高(P<0.05),并且两种蛋白的表达与年龄、性别、肿瘤的部位及淋巴结转移情况均无关。CDC4与c-Myc在mRNA水平(r2=0.101 3,P=0.042 5)和蛋白水平(r2=0.822 2,P=0.012 6)的表达也呈负性相关(图4,表4)。
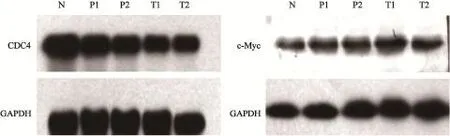
图2 Western blot检测CDC4、c-Myc表达结果Fig. 2 CDC4 and c-Myc protein expressions detected by Western blot

表2 CDC4和c-Myc蛋白在胃癌组织、癌旁组织及正常黏膜组织中的表达Tab. 2 Protein expressions of CDC4 and c-Myc in gastric cancer tissues, adjacent mucosa tissues and normal mucosa tissues
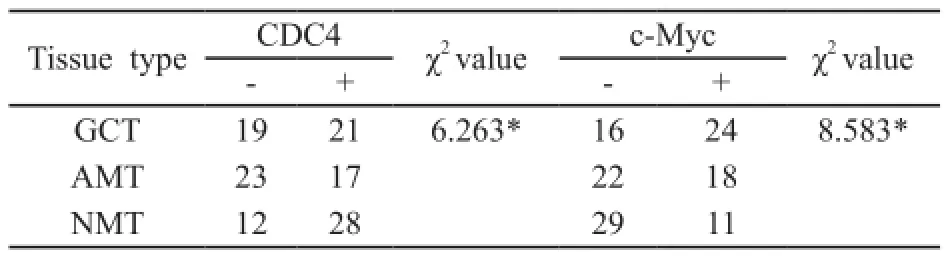
表3 CDC4和c-Myc蛋白在胃癌组织、癌旁组织及正常黏膜组织中的表达Tab. 3 The protein expressions of CDC4 and c-Myc in gastric cancer tissues, adjacent mucosa tissues and normal mucosa tissues
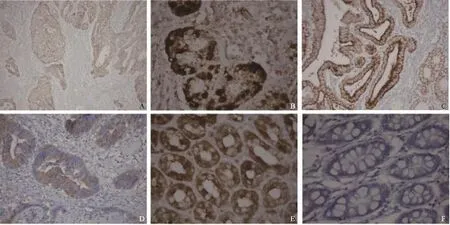
图3 胃癌组织、癌旁组织和正常胃黏膜组织中CDC4和c-Myc的表达Fig. 3 The protein expressions of CDC4 and c-Myc in gastric cancer tissues, adjacent mucosa tissues and normal mucosa tissues (DAB, ×400)
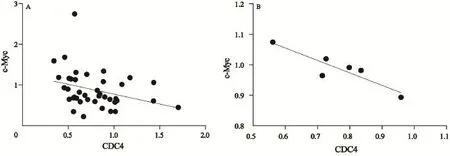
图4 CDC4与c-Myc在mRNA水平和蛋白水平的相关性表达Fig. 4 The correlation of CDC4 and c-Myc in mRNA level and protein level
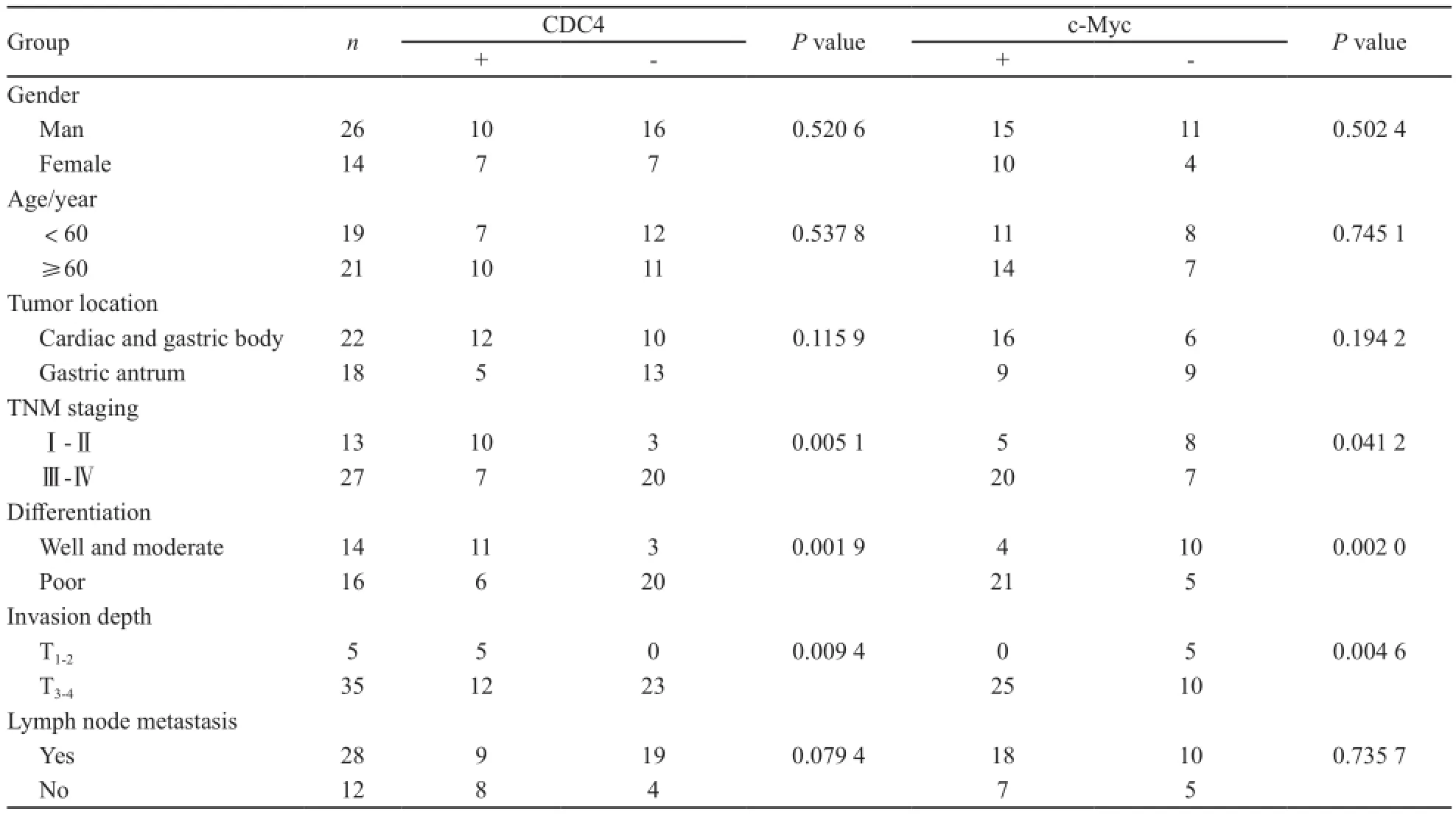
表4 CDC4和c-Myc蛋白水平的表达与胃癌临床病理特征之间的联系Tab. 4 The correlation between the protein expressions of CDC4 and c-Myc and clinical pathological parameters in gastric cancer
3 讨 论
胃癌为世界范围内第四常见的癌症,超过70%的病例出现在发展中国家。胃癌的危险因素包括幽门螺杆菌感染、吸烟、高盐饮食及腌制食品,并有1%~3%的胃癌与遗传性易感综合征有关。人类抑癌基因CDC4定位于4q31.2,长约200 kb。CDC4蛋白是F-box蛋白家族成员,并且是SCF(SKP1-CUL1-F-box)型泛素连接酶的靶蛋白识别组分。CDC4作用的许多底物均为癌基因,如cyclin E、c-Myc、c-Jun和Notch基因通路等[10-11],它们在细胞生物学中具有非常重要地位。前已有研究[12]证明,CDC4能促使cyclin E、c-Myc和c-Jun等癌基因表达产物的降解。另有研究[13]表明,CDC4的表达缺失会导致cyclin E、c-Myc及Aurora-A等蛋白质大量蓄积,从而加快了癌细胞的增殖。国外已有文献报道[14],在胃癌组织中,CDC4的低表达与肿瘤大小、TNM分期、淋巴结转移及预后不良等有关。本次实验结果提示:CDC4在胃癌组织中的低表达与胃癌的分化程度、淋巴结转移、TNM分期有关,即胃癌分化程度越低、分期越晚、淋巴结转移数量越多,则CDC4的阳性表达率越低。这说明CDC4的表达可能在胃癌的发生、发展、转移的过程中起重要作用。
c-Myc是MYC家族成员之一。该家族属核蛋白类,其编码产物可与核内DNA特异性结合,在细胞核内转化成功能蛋白。已知的MYC家族至少有3个成员:c-Myc、n-Myc和l-Myc。其中c-Myc的作用是三者中最强的,可促进细胞增殖、永生化、去分化和转化等,在多种肿瘤形成过程中处于重要地位[15]。c-Myc基因既是一种可易位基因,又是一种多种物质调节的可调节基因,也是一种可使细胞无限增殖,获永生化功能,促进细胞分裂的基因。已有研究表明[16-17],c-Myc是CDC4泛素化修饰的重要底物,CDC4的表达缺失可以导致细胞内c-Myc蛋白的显著增加,而CDC4的过表达则可促使c-Myc泛素化修饰和蛋白降解。本实验显示,c-Myc蛋白和mRNA的表达在胃癌组织、癌旁组织及正常组织中的表达情况差异有统计学意义(P<0.05),这与林静等[18]的研究结果一致。c-Myc的表达与胃癌的分化程度、TNM分期及淋巴结转移密切相关,即组织分化程度越低、分期越晚、淋巴结转移越多,则c-Myc表达的阳性率就越高。这说明其表达越高,预示胃癌的恶性程度越高,浸润和转移能力也越强。
c-Myc和cyclin E均是细胞周期的调节因子,他们含量的下降可以引起细胞退出细胞周期,而CDC4的表达缺失增加了这两种因子的蛋白含量,从而促使细胞周期的重新进入,这是CDC4基因突变造成癌症发生的重要原因之一。在我们的前期研究中发现[19],CDC4和cyclin E在胃癌组织中mRNA的表达呈负性相关,通过负性调节cyclin E可达到抑制胃癌的发生、发展。
综上所述,CDC4同c-Myc与胃癌的发生、发展及浸润、转移等密切相关。联合检测CDC4和c-Myc有助于诊断胃癌、评价胃癌的恶性程度、转移能力及预后判断,CDC4可能成为将来胃癌诊断的又一新的重要生物学指标和胃癌靶基因治疗的新靶点。
[1] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2007[J]. CA Cancer J Clin, 2007, 57(1): 43-66.
[2] PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74-108.
[3] BERARDI R, SCARTOZZI M, ROMAGNOLI E, et al. Gastric cancer treatment: a systematic review[J]. Oncol Rep, 2004, 11(4): 911-916.
[4] MOBERG K H, BELL D W, WAHRER D C, et al. Archipelago regulates cyclin E levels in Drosophila and is mutated in human cancer cell lines[J]. Nature, 2001, 413(6853): 311-316.
[5] STROHMAIER H, SPRUCK C H, KAISER P, et al. Human F-box protein hCdc4 targets cyclin E for proteolysis and is mutated in a breast cancer cell line[J]. Nature, 2001, 413(6853): 316-322.
[6] EKHOLM-REED S, SPRUCK C H, SANGFELT O, et al. Mutation of hCDC4 leads to cell cycle deregulation of cyclin E in cancer[J]. Cancer Res, 2004, 64(3): 795-800.
[7] CASSIA R, MORENO-BUENO G, RODRIGUEZ-PERALES S, et al. Cyclin E gene (CCNE) amplification and hCDC4 mutations in endometrial carcinoma[J]. J Pathol, 2003, 201(4): 589-595.
[8] RAJAGOPALAN H, JALLEPALLI P V, RAGO C, et al. Inactivation of hCDC4 can cause chromosomal instability[J]. Nature, 2004, 428(6978): 77-81.
[9] BEESLEY M F, MCLAREN K M. Cytokeratin 19 and galectin-3 immunohistochemisty in the differential diagnosis of solitary thyroid nodules[J]. Histopathology, 2002, 41(3): 236-243.
[10] MILNE A N, LEGUIT R, CORVER W E, et al. Loss of CDC4/ FBXW7 in gastric carinoma [J]. Cell Oncol, 2013, 32(5-6): 347-359.
[11] BABAEI-JADIDI R, LI N, SAADEDDIN A, et al. FBXW7 influences murine intestinal homeostasis and cancer, targeting Notch, Jun, and DEK for degradation[J]. J Exp Med, 2011, 208(2): 295-312.
[12] NAKAYAMA K I, NAKAYAMA K. Ubiquitin ligases: cellcycle control and cancer[J]. Nat Rev Cancer, 2006, 6(5): 369-381.
[13] FUJII Y, YADA M, NISHIYAMA M, et al. Fbxw7 contributes to tumor suppression by targeting multiple proteins for ubiquitin-dependent degradation[J]. Cancer Sci, 2006, 97(8): 729-736.
[14] YOKOBORI T, MIMORI K, IWATSUKI M, et al. P53-altered FBXW7 expression determines poor prognosis in gastric cancer cases[J]. Cancer Res, 2009, 69(9): 3788-3794.
[15] COLLINS S, GROUDINE M. Amplification of endogenous myc-related DNA sequences in a human myeloid leukaemia cell line[J]. Nature, 1982, 298(5875): 679-681.
[16] WELCKER M A, ORIAN A, GRIM J E. A nucleolar isoform of the Fbw7 ubiquitin ligase regulates c-Myc and cell size[J]. Curr Biol, 2004, 14(20): 1852-1857.
[17] YADA M, HATAKEYAMA S, KAMURA T, et al. Phosphorylation-dependent degradation of c-Myc is mediated by the F-box protein Fbw7[J]. EMBO J, 2004, 23(10): 2116-2125.
[18] 林 静, 项锋钢, 杨文荣, 等. PTTG、c-Myc及Ki67在胃癌中的表达及相关性研究[J]. 胃肠病学和肝病学杂志, 2007, 16(6): 528-531.
[19] 黄国全, 张才全, 彭小超, 等. 胃癌中CDC4及cyclin E的表达及临床意义[J]. 生命科学研究, 2011, 15(4): 339-344.
The expressions of CDC4 and c-Myc in gastric cancer and their clinical signifieance
HUANG Guoquan1, LI Hui2, ZHANG Caiquan2, WU Quanfeng1, SUN Jianhua1 (1.Gastrointestinal Surgery, the Central Hospital of Enshi Autonomous Prefecture, Enshi 445000, Hubei Province, China; 2. Department of Gastrointestinal Surgery, the First Affiliated Hospital, Chongqing Medical University, Chongqing 400016, China)
ZHANG Caiquan E-mail: zhangyu0323@21cn.com
Background and purpose:The gastric cancer is the highest incidence of malignant tumors in the world. The main treatment methods for gastric cancer are operation and chemotherapy. But the effect is not good. With the rapid development of economy and molecular biology, early diagnosis and molecular targeted therapy for gastric cancer has become a research hotspot. The oncogene overexpression and the anti-oncogene lower expression are closely related with gastric cancer. CDC4/FBXW7 is an anti-oncogene, but c-Myc is an oncogene. The previous research showed that CDC4 affected the expression of many oncogenes, such as Cyclin E. This study aimed to investigate the expression of CDC4 and c-Myc in gastric cancer and to elucidate the potential relationship between their expressions and clinical pathological characteristics.Methods:Semi-quantitative reverse transcription polymerase chain reaction (sRT-PCR), immunohistochemistry and Western blot method were used to determine the mRNA and protein expressions of CDC4 and c-Myc in 40 specimens of gastric carcinoma tissues, corresponding adjacent tissues and normal mucosal tissues. The expressions of CDC4 and c-Myc and the clinical pathological characteristics were analyzed.Results:Theprotein expressions of CDC4 in gastric cancer tissues were significantly lower than those in adjacent tissues and normal mucosal tissues (P<0.05), whereas the protein expression of c-Myc in gastric cancer tissues was significantly higher than that in adjacent tissues and normal mucosal tissues (P<0.05). The protein and mRNA expression of CDC4 and c-Myc were correlated with differentiation, TNM stage, lymph node metastasis, infiltration, but not with patients’ gender, age and site of cancer (P<0.05). There was a significant negative correlation between CDC4 and c-Myc at the mRNA and protein expression levels (P<0.05).Conclusion:The lower expression of CDC4 is correlated with differentiation, TNM stage, lymph node metastasis and infiltration. c-Myc overexpression is likely to be the CDC4 loss. It suggests that the loss of CDC4 may be a valuable marker for assessing the diagnosis and treatment and the prognosis of gastric cancer.
CDC4; c-Myc; Immunohistochemistry; Semi-quantitative reverse transcription polymerase chain reaction; Western blot
10.3969/j.issn.1007-3969.2015.12.003
R735.2
A
1007-3639(2015)12-0933-07
2014-07-21
2015-05-14)
张才全 E-mail:zhangyu0323@21cn.com
