粉防己碱诱导人视网膜母细胞瘤细胞凋亡及其机制研究
2015-01-04沈永青穆卫红孙东兰张艳华
张 静,沈永青,仇 炜,穆卫红,孙东兰,张艳华
1.石家庄市第四医院产前诊断中心,河北 石家庄 050011;
2.河北中医学院护理学院,河北 石家庄 050020;
3.石家庄市鹿泉区人民医院外科,河北 石家庄 050020;
4.首都医科大学附属北京友谊医院泌尿外科,北京 100050
粉防己碱诱导人视网膜母细胞瘤细胞凋亡及其机制研究
张 静1,沈永青2,仇 炜3,4,穆卫红1,孙东兰1,张艳华1
1.石家庄市第四医院产前诊断中心,河北 石家庄 050011;
2.河北中医学院护理学院,河北 石家庄 050020;
3.石家庄市鹿泉区人民医院外科,河北 石家庄 050020;
4.首都医科大学附属北京友谊医院泌尿外科,北京 100050
背景与目的:粉防己碱(tetrandrine,Tet)是一种天然化合物,其抗视网膜母细胞瘤作用尚不清楚。该研究拟检测Tet对人视网膜母细胞瘤细胞的抗肿瘤作用,并进一步阐明其作用机制。方法:采用CCK-8法检测Tet对视网膜母细胞瘤细胞活力的抑制作用;应用Annexin V/PI法检测细胞凋亡情况;在2’,7’-二氯荧光素二乙酸酯(2’, 7’-dichlorofluorescin diacetate,DCFH-DA)染色后,采用流式细胞术检测细胞内反应性活性氧(reactive oxygen species,ROS)含量;采用蛋白[质]印迹法(Western blot)检测细胞Akt、p-Akt蛋白表达量。结果:Tet显著抑制视网膜母细胞瘤细胞活力,Tet浓度为4、8、10和20 μmol/L处理细胞24 h时,WERI-Rb-1细胞抑制率分别为5.7%、25.0%、55.1%和84.9%,Y79细胞抑制率分别为2.4%、2.9%、23.8%和54.2% (P<0.01);10 μmol/L Tet处理细胞12、24和48 h时,WERI-Rb-1细胞抑制率分别为6.0%、45.5%和74.7%,Y79细胞抑制率分别为2.9%、19.4%和43.3%(P<0.01)。Tet诱导细胞凋亡,以10 μmol/L Tet处理细胞24和48 h时,WERI-Rb-1细胞凋亡率分别为(23.70±1.75)%和(34.83±3.15)%,Y79细胞凋亡率分别为(9.62±2.69)%和(14.97±1.50)%(P<0.01),凋亡抑制剂Z-VAD-FMK能够显著抑制Tet对视网膜母细胞瘤细胞的凋亡诱导作用(P<0.05)。10 μmol/L Tet作用细胞6及12 h后,细胞的ROS产生量较对照组明显上升(P<0.01),N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine,NAC)能够抑制Tet诱导产生的ROS(P<0.01),NAC抑制ROS后,细胞的凋亡率较单独Tet作用组明显下降(P<0.01)。Tet能够抑制视网膜母细胞瘤细胞PI3K/Akt信号通路。结论:Tet诱导视网膜母细胞瘤细胞凋亡,该作用机制与细胞内ROS升高、PI3K/Akt信号通路抑制有关。
粉防己碱;视网膜母细胞瘤;凋亡;反应性活性氧;PI3K/Akt
粉防己碱(tetrandrine,Tet)是从千金藤属防己科植物粉防己根部提取的一种天然双苄基异喹啉类化合物[1]。粉防己在我国传统医药中具有悠久的应用历史,其被广泛应用于类风湿性关节炎、败血症、肺硅沉着病等疾病的治疗中[2-4]。近年来,Tet由于其显著的抗肿瘤作用而受到广泛关注。已有研究表明,Tet不但具有良好的直接抗肿瘤作用,同时也具有显著地逆转肿瘤细胞耐药的作用[5-7]。视网膜母细胞瘤是最常见的儿童恶性肿瘤之一,发病率为1∶21 000~1∶18 000[8]。虽然随着治疗方法的改进,视网膜母细胞瘤的治疗效果明显改善,患儿的生存率显著上升,但是视网膜母细胞瘤作为一种严重致残致死的疾病仍旧危害着许多儿童的健康。本研究通过探讨Tet的抗视网膜母细胞瘤的效果,初步阐明其作用机制,并为Tet在视网膜母细胞瘤中的应用提供实验依据。
1 材料和方法
1.1 试验材料
人视网膜母细胞瘤细胞系WERI-Rb-1及Y79购自中国医学科学院基础医学研究所基础医学细胞中心,Tet(纯度≥90%)及N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine,NAC)购自美国Sigma-Aldrich公司,RPMI-1640培养基及胎牛血清购自美国Hyclone公司,CCK-8购自东仁化学科技(上海)有限公司,Z-VAD-FMK购自美国Enzo公司,Akt、p-Akt及GAPDH抗体均购自美国Cell Signaling Technology公司,AnnexinⅤ/PI凋亡检测试剂盒购自美国BD公司,反应性活性氧(reactive oxygen species,ROS)活性氧检测试剂盒购自南京凯基生物科技公司。
1.2 方法
1.2.1 细胞培养
WERI-Rb-1及Y79细胞均使用含有10%胎牛血清的RPMI-1640培养基,置于37 ℃、CO2体积分数为5%、饱和湿度的细胞培养箱中常规培养。
1.2.2 CCK-8实验
取对数生长期细胞传代至96孔细胞培养板内,过夜后依实验所需加入相应浓度的药物,给药时间达到实验设定时间后,每孔加入10 μL CCK-8试剂,置于细胞培养箱内继续温育2 h,酶标仪450 nm比色并记录结果。
1.2.3 AnnexinⅤ/PI凋亡试验
将待检测细胞常规离心收集,使用PBS洗涤2次后,轻柔加入500 μL结合缓冲液重悬细胞,依次加入AnnexinⅤ和PI各5 μL,混匀后避光染色15 min,流式细胞仪检测。
1.2.4 蛋白[质]印迹法(Western blot)检测
将待检测细胞收集后使用细胞裂解液裂解,BCA法蛋白定量,加入上样缓冲液后加热变性,取等量蛋白进行SDS-PAGE电泳分离后,恒流300 mA转膜,5%脱脂奶粉封闭后,一抗温育过夜,次日TBST缓冲液洗膜后,二抗室温温育1 h,ECL化学发光,拍照存档,本研究所使用一抗封闭浓度均为1∶1 000。
1.2.5 ROS活性氧检测
使用无血清培养基将二氯二氢荧光素一乙酰乙酸酯(2’, 7’-dichlorofluorescindiacetate,DCFH-DA)稀释至终浓度10 μmol/L,待检测细胞常规收集后悬浮于该稀释液内,在37 ℃细胞培养箱中温育20 min,每5 min颠倒混匀1次。检测前使用无血清培养基洗涤细胞2次,流式细胞仪检测。
1.3 统计学处理
采用SPSS 13.0统计软件进行统计分析。数据采用χ±s表示,两样本均数间比较采用t检验,多样本均数间比较采用单因素方差分析(one way ANOVA),组间比较采用LSD检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Tet对人视网膜母细胞瘤细胞活力的影响
对WERI-Rb-1及Y79细胞分别给予不同浓度(4、8、10和20 μmol/L)的Tet作用,24 h后使用CCK-8实验进行检测,结果如图1A所示。Tet的抗肿瘤效果随着给药浓度的增加而不断增强,在Tet浓度为4、8、10和20 μmol/L时,WERIRb-1细胞抑制率分别为5.7%、25.0%、55.1%和84.9%,Y79细胞抑制率分别为2.4%、2.9%、23.8%和54.2%;WERI-Rb-1及Y79细胞在药物浓度分别为8及10 μmol/L时,细胞活力开始受到显著抑制,差异有统计学意义(P<0.01)。以10 μmol/L Tet处理WERI-Rb-1及Y79细胞,分别于12、24及48 h检测细胞活力,结果表明Tet的抗肿瘤作用有明显的时-效变化,WERI-Rb-1细胞抑制率分别为6.0%、45.5%和74.7%,Y79细胞抑制率分别为2.9%、19.4%和43.3%,差异有统计学意义(P<0.01,图1B)。
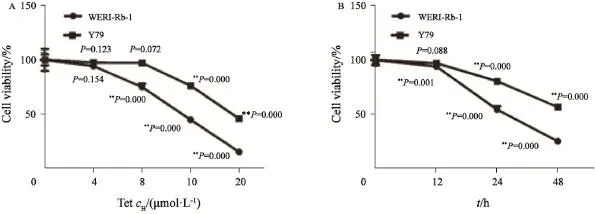
图1 Tet对视网膜母细胞瘤细胞活力的影响Fig. 1 The anti-tumor effects of Tet on retinoblastoma cells
2.2 Tet对人视网膜母细胞瘤细胞凋亡的影响
为了研究Tet是否可以诱导视网膜母细胞瘤细胞凋亡,本研究使用Annexin Ⅴ/PI法检测细胞凋亡率,结果显示在给予10 μmol/L Tet作用细胞24和48 h后,肿瘤细胞凋亡比率明显上升,WERI-Rb-1细胞凋亡率由(3.45±0.83)%分别上升至(23.70±1.75)%和(34.83±3.15)%,Y79细胞凋亡率分别为(9.62±2.69)%和(14.97±1.50)%,差异有统计学意义(P<0.01,图2A)。进一步使用凋亡抑制剂Z-VAD-FMK进行研究,发现在10 μmol/L Tet作用细胞24 h后,Z-VAD-FMK可以显著抑制Tet对WERI-Rb-1及Y79细胞的凋亡诱导作用(P<0.05,图2B、C)。该结果说明Tet的抗肿瘤作用与其诱导凋亡作用有关。
2.3 Tet对人视网膜母细胞瘤细胞ROS的影响
使用对Tet更为敏感的WERI-Rb-1细胞进行后续实验,检测WERI-Rb-1细胞内的ROS含量,在给予10 μmol/L Tet作用细胞6和12 h后,细胞的ROS产生量较对照组明显上升,其平均荧光强度较对照组分别上升了(2.46±0.33)和(3.01±0.16)倍,差异有显著统计学意义(P<0.01,图3A)。进一步使用ROS清除剂NAC进行实验,结果表明NAC能够使Tet诱导产生的ROS显著降低(P<0.01,图3B)。为了说明Tet引起的细胞ROS升高与凋亡之间的关系,本研究在给予细胞NAC后进行了凋亡检测。结果表明,在给予NAC抑制ROS后,细胞凋亡率较单独Tet作用组明显下降(P<0.01,图3C),NAC能够部分逆转Tet的抗肿瘤作用。上述结果表明,Tet能够引起ROS升高,且该作用与其介导的肿瘤细胞凋亡有关。
2.4 Tet对WERI-Rb-1细胞PI3K/Akt信号通路的作用
Western blot检测结果表明,在给予Tet 12 h后,视网膜母细胞瘤WERI-Rb-1细胞p-Akt表达量呈现明显下降的趋势(图4A),说明Tet能够抑制WERI-Rb-1细胞PI3K/Akt信号通路的活性。为了说明该信号抑制作用与ROS产生之间的关系,本研究又使用了ROS清除剂NAC进行研究,结果如图4B所示,在给予了NAC后,p-Akt的表达量较Tet单独处理组明显上升,ROS能够抑制WERI-Rb-1细胞PI3K/Akt信号通路。
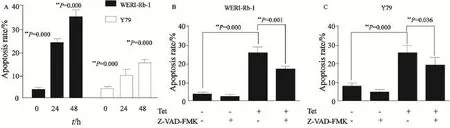
图2 Tet对视网膜母细胞瘤细胞凋亡的影响Fig. 2 The effects of Tet on apoptosis of retinoblastoma cells
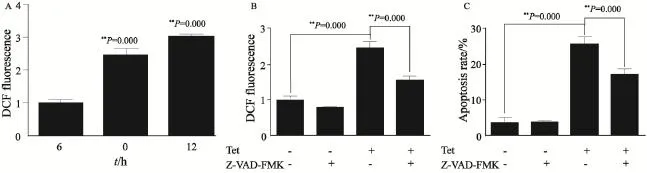
图3 Tet诱导ROS生成并导致细胞凋亡Fig. 3 Tet induces cell apoptosis via ROS induction
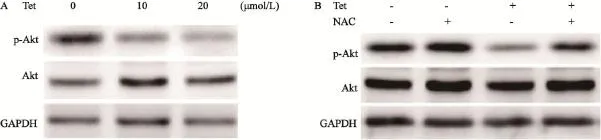
图4 Tet抑制WERI-Rb-1细胞PI3K/Akt信号通路Fig. 4 Tet inhibited the PI3K-Akt signal pathway of WERI-Rb-1 cells
3 讨 论
视网膜母细胞瘤是发病率最高的儿童眼内原发恶性肿瘤,如果不接受治疗,患儿通常会在1~2年内死亡[9]。近年来,随着治疗技术的不断提高,完全通过眼球摘除手术治疗视网膜母细胞瘤的方法已较少应用。目前视网膜母细胞瘤的治疗原则是在保障患儿生命的前提下尽量保留患眼及残存的视功能。所以在该病的治疗中,保守治疗起到了非常重要的作用。放疗和化疗是最常用的保守治疗视网膜母细胞瘤的方法,但是放疗可能会造成严重的并发症,化疗又会诱导肿瘤耐药从而导致治疗失败,如果能找到合适的保守治疗的方法将极大提高患者的生存率。
我国传统中医药在肿瘤治疗中具有非常广阔的应用前景。Tet是从中药粉防己中提取的天然化合物,具有悠久的临床应用历史。目前已知Tet对于多种肿瘤都具有良好的抗肿瘤作用[10-12],该药物可以激活胆囊癌和骨肉瘤细胞的Caspase-3蛋白从而诱导肿瘤细胞死亡[13-14],然而其是否具有抗视网膜母细胞瘤的作用目前仍未见有研究报道。本研究发现,WERI-Rb-1及Y79细胞受到Tet处理后,细胞活性明显下降,凋亡率明显上升,Tet具有良好的抗视网膜母细胞瘤的作用。ROS是细胞代谢的产物,在许多生理及病理过程中发挥着重要的作用,ROS诱导细胞凋亡是其作用之一[15-16]。本研究表明Tet可以引起肿瘤细胞内ROS的增多,进一步使用ROS清除剂NAC降低细胞内ROS含量后,细胞的凋亡率明显下降,说明Tet的诱导凋亡作用与ROS增多有关。PI3K/Akt信号通路是细胞内重要的调控机制,在细胞的增殖、凋亡和分化中发挥着重要的作用[17]。本研究发现,Tet能够显著下调WERIRb-1细胞Akt的磷酸化水平,抑制PI3K/Akt信号通路。有研究表明激活PI3K/Akt能够导致细胞内ROS的产生,而过多的ROS又能够进一步抑制PI3K/Akt通路[18-19]。为了探讨Tet所引起的ROS产生与PI3K/Akt抑制之间的关系,我们使用了NAC进行研究,结果表明Tet诱导了ROS的产生,过多的ROS又进一步抑制了WERI-Rb-1细胞PI3K/Akt信号通路。总之,Tet一方面能够通过诱导ROS直接诱导肿瘤细胞凋亡,另一方面其诱导产生的ROS也能抑制细胞PI3K/Akt信号通路发挥抗肿瘤作用。
本研究从体外水平验证了Tet的抗视网膜母细胞瘤作用,并初步阐明了其抗肿瘤的作用机制,Tet能够诱导产生ROS,抑制PI3K/Akt信号通路,从而丰富了Tet的抗肿瘤谱,拓宽了Tet的应用,为Tet的未来临床使用提供了实验依据。
[1] CHEN Y J. Potential role of tetrandrine in cancer therapy[J]. Acta Pharmacol Sin, 2002, 23(12): 1102-1106.
[2] KOH S B, BAN J Y, LEE B Y, et al. Protective effects of fangchinoline and tetrandrine on hydrogen peroxide-induced oxidative neuronal cell damage in cultured rat cerebellar granule cells [J]. Planta Med, 2003, 69(6): 506-512.
[3] LAI J H. Immunomodulatory effects and mechanisms of plantalkaloid tetrandrine in autoimmune diseases [J]. Acta Pharmacol Sin, 2002, 23(12): 1093-1101.
[4] LI S Y, LING L H, THE B S, et al. Anti-inflammatory and immunosuppressive properties of the bis-benzylisoquinolines: in vitro comparisons of tetrandrine and berbamine [J]. Int J Immunopharmacol, 1989, 11(4): 395-401.
[5] 李 勇, 赵 群, 檀碧波, 等. 粉防己碱对人胃癌耐药细胞锌指蛋白139、多药耐药基因表达的影响[J]. 中国中西医结合杂志, 2014, 34(1): 66-70.
[6] 李 敏, 方明治. 白头翁皂苷B4、粉防己碱对奥沙利铂耐药的结肠癌细胞的耐药逆转作用及其机制[J]. 中国癌症杂志, 2015, 25 (1): 38-44.
[7] SUN Y F, WINK M. Tetrandrine and fangchinoline, bisbenzylisoquinoline alkaloids from Stephania tetrandra can reverse multidrug resistance by inhibiting P-glycoprotein activity in multidrug resistant human cancer cells [J]. Phytomedicine, 2014, 21(8-9): 1110-1119.
[8] 赵堪兴, 杨培增, 主编. 眼科学 [M]. 8版. 北京: 人民卫生出版社, 2013: 228.
[9] SHIELDS C L, FULCO E M, ARIAS J D, et al. Retinoblastoma frontiers with intravenous, intra-arterial, periocular, and intravitreal chemotherapy [J]. Eye (Lond), 2013, 27(2): 253-264.
[10] QIU W, SU M, XIE F, et al. Tetrandrine blocks autophagic flux and induces apoptosis via energetic impairment in cancer cells [J]. Cell Death Dis, 2014, 13(5): e1123.
[11] QIN R, SHEN H, CAO Y, et al. Tetrandrine induces mitochondria-mediated apoptosis in human gastric cancer BGC-823 cells [J]. PLoS One, 2013, 8(10): e76486.
[12] GAO J L, JI X, HE T C, et al. Tetrandrine suppresses cancer angiogenesis and metastasis in 4 T1tumor bearing mice [J]. Evid Based Complement Alternat Med, 2013, 2013: 265061.
[13] ZHU R, LIU T, TAN Z, et al. Tetrandrine induces apoptosis in gall bladder carcinoma in vitro [J]. Int J Clin Pharmacol Ther, 2014, 52(10): 900-905.
[14] TAO L J, ZHOU X D, SHEN C C, et al. Tetrandrine induces apoptosis and triggers a caspase cascade in U2-OS and MG-63 cells through the intrinsic and extrinsic pathways [J]. Mol Med Rep, 2014, 9(1): 345-349.
[15] SENA L A, CHANDEL N S. Physiological roles of mitochondrial reactive oxygen species [J]. Molecular Cell, 2012, 48(2): 158-167.
[16] SINHA K, DAS J, PAL P B, et al. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis [J]. Arch Toxicol, 2013, 87(7): 1157-1180.
[17] SUN Z J, CHEN G, HU X, et al. Activation of PI3K/Akt/ IKK-alpha/NF-kappa B signaling pathway is required for the apoptosis-evasion in human salivary adenoid cystic carcinoma: its inhibition by quercetin [J]. Apoptosis, 2010, 15(7): 850-863.
[18] HEINZELMANN S, BAUER G. Multiple protective functions of catalase against intercellular apoptosis-inducing ROS signaling of human tumor cells [J]. Biol Chem, 2010, 391(6): 675-693.
[19] PAPAIAHGARI S, ZHANG Q, KLEEBERGER S R, et al. Hyperoxia stimulates an Nrf2-ARE transcriptional response via ROS-EGFR-PI3K-Akt/ERK MAP kinase signaling in pulmonary epithelial cells [J]. Antioxid Redox Signal, 2006, 8(1-2): 43-52.
Tetrandrine induces retinoblastoma cells apoptosis via ROS induction and PI3K/Akt inhibition
ZHANG Jing1, SHEN Yongqing2, QIU Wei3,4, MU Weihong1, SUN Donglan1, ZHANG Yanhua1(1. Prenatal Diagnosis Center, Fourth Hospital of Shijiazhuang, Shijiazhuang 050011, Hebei Province, China; 2. College of Nursing, Hebei University of Chinese Medicine, Shijiazhuang 050200, Hebei Province, China; 3. Department of Surgery, the People’s Hospital of Luquan District, Shijiazhuang 050200, Hebei Province, China; 4. Department of Urology, Beijing Friendship Hospital, Beijing 100050, China)
QIU Wei E-mail: qiuwei618@163.com
Background and purpose:Tetrandrine is a natural compound whose role in retinoblastoma remains unclear. This study investigated the effects of tetrandrine (Tet) on human retinoblastoma cells.Methods:CCK-8 assays were performed to analyze the effects of Tet on viability of retinoblastoma cells. The apoptosis rate was determined by Annexin V/PI assays. After staining with 2′,7′-dichlorofluorescin diacetate (DCFH-DA), cellular reactive oxygen species (ROS) was measured by flow cytometry. Akt and p-Akt were detected by Western blot.Results:Tet inhibited cell viability of retinoblastoma cells. After treatment with Tet (4, 8, 10 and 20 μmol/L) for 24 h, cell viability inhibition rates of WERI-Rb-I were 5.7%, 25.0%, 55.1% and 84.9%, whereas inhibition rates of Y79 cells were 2.4%,2.9%, 23.8% and 54.2% (P<0.01). In cells treated with 10 μmol/L of Tet for 12, 24 and 48 h, cell viability inhibition rates of WERI-Rb-I were 6.0%, 45.5% and 74.7%, whereas inhibition rates of Y79 cells were 2.9%, 19.4% and 43.3% (P<0.01). Tet induced retinoblastoma cell apoptosis. After treatment with Tet (10 μmol/L) for 24 and 48 h, apoptosis rates of WERI-Rb-I were (23.70±1.75)% and (34.83±3.15)%, respectively, whereas apoptosis rates of Y79 cells were (9.62±2.69)% and (14.97±1.50)%, respectively (P<0.01). Apoptosis inhibitor Z-VAD-FMK attenuated Tet-induced cell death (P<0.05). ROS levels were indeed increased in cells treated with Tet (10 μmol/L) for 6 and 12 h (P<0.01), while N-Acetyl-L-cysteine (NAC) decreased Tet-induced ROS (P<0.01). After ROS was inhibited by NAC, apoptosis rate was decreased compared with the control (P<0.01). Further study indicated that Tet inhibited PI3K/Akt pathway in retinoblastoma cells.Conclusion:Tet induces cell apoptosis via increasing ROS synthesis and inhibiting PI3K/Akt pathway.
Tetrandrine; Retinoblastoma; Apoptosis; Reactive oxygen species; PI3K/Akt
10.3969/j.issn.1007-3969.2015.12.006
R739.742
A
1007-3639(2015)12-0953-06
2015-05-09
2015-10-08)
河北省医学科学研究重点课题计划(编号:ZD20140032)。
仇 炜 E-mail:qiuwei618@163.com
