低强度超声对肝癌细胞MHCC97H迁移与侵袭能力影响的体外研究
2015-01-04
复旦大学附属中山医院康复医学科,上海 200032
低强度超声对肝癌细胞MHCC97H迁移与侵袭能力影响的体外研究
杨名珍,刘邦忠,石明芳,李 蕴,刘光华,王 平
复旦大学附属中山医院康复医学科,上海 200032
背景与目的:低强度超声(low intensity ultrasound, LIUS)能杀伤肿瘤细胞,促进肿瘤细胞的凋亡,但对肿瘤细胞迁移侵袭作用的影响仍不清楚。该研究旨在探讨LIUS对肝癌细胞MHCC97H迁移侵袭的影响及可能的机制。方法:实验根据超声照射强度的不同分为对照组(0 W/cm2)、0.5 W/cm2组、1.0 W/cm2组和1.5 W/cm2组;LIUS处理后划痕实验和Transwell小室体外迁移和侵袭实验检测肿瘤细胞的迁移和侵袭能力;显微镜及F-actin细胞骨架荧光染色观察处理后细胞骨架的变化;实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)及蛋白质[印]迹法(Western blot)检测各组MMP-2、MMP-9的表达变化。结果:LIUS(小于等于1.5 W/cm2)能促进肝癌细胞MHCC97H的迁移侵袭,划痕实验及Transwell迁移和侵袭实验都表明LIUS处理后肿瘤细胞迁移侵袭数量增加;光学显微镜及荧光显微镜发现LIUS处理后肝癌细胞的形态发生变化;RTFQ-PCR及Western blot的结果表明超声处理后MMP-2 mRNA 及蛋白表达水平上升,MMP-9的mRNA 表达水平上升。结论:LIUS可能通过改变肿瘤细胞的骨架及增加MMP-2的表达促进肝癌细胞MHCC97H的迁移及侵袭能力。
低强度超声;肝癌细胞;转移;基质金属蛋白酶
超声是指频率大于人耳能听到的频率(20~20 000 Hz)的声波,低强度超声(low intensity ultrasound,LIUS)通常指强度小于3 W/cm2的超声。超声的生物学效应包括机械效应、空化效应和热效应,目前的研究主要集中于促进肿瘤细胞凋亡及其机制[1-2]、化疗增敏[3]、增强基因治疗效率[4]。然而,LIUS对肿瘤细胞的侵袭转移能力的影响至今研究甚少,而对于恶性肿瘤而言转移和复发往往是患者死亡的主要原因,因此本研究的目的就是探究LIUS对肝癌细胞系MHCC97H的侵袭转移能力的影响及可能的机制。
肝细胞肝癌是最常见的恶性肿瘤之一。我国属于肝癌高发国家,发病人数占世界的50%以上。尽管近年来肝癌研究已取得很大进展,但患者的生存率仍然不高,5年生存率只有7%左右,根治性切除患者术后5年仍有40%~70%的复发率[5]。转移和复发是导致肝癌患者死亡的主要原因。本研究旨在探讨LIUS对肝癌转移的影响。
1 材料和方法
1.1 细胞和试剂
人肝癌细胞系MHCC97H来自复旦大学附属中山医院肝癌研究所,细胞培养所用高糖DMEM培养基、胎牛血清(FBS)、0.25%胰酶均购自美国Gibco公司,一抗MMP-2、MMP-9购自美国Abcam公司,β-actin购自美国SCT公司,二抗购自上海碧云天生物技术有限公司,Transwell小室(24 well insert, por size 8 μm)购自美国Corning公司,Matrigel基质胶购自美国BD公司,蛋白裂解液、彩色预染蛋白购自上海碧云天生物技术有限公司,TRIzol试剂购自美国Invitrogen公司,SYBR Premix Ex Taq购自宝生物工程(大连)有限公司。
超声波仪器BTL-5000物理治疗工作站-超声治疗仪(英国BTL实业公司)使用参数为:频率1 MHz,强度为0.5、1.0和1.5 W/cm2,作用时间为1 min,占空比为25%。
1.2 实验方法
1.2.1 细胞培养及实验分组
将人肝癌细胞系MHCC97H接种于含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的DMEM培养基中,置于37 ℃、CO2体积分数为5%的无菌培养箱中培养。取对数生长期的细胞用0.25%胰酶消化制成单细胞悬液,细胞悬液装入无菌聚乙烯离心管中。
超声探头与离心管之间涂以耦合剂,使之紧密接触。根据超声处理强度的不同分为4组:对照组(0 W/cm2)、0.5 W/cm2组、1.0 W/cm2组和1.5 W/cm2组。在频率1 MHz、不同处理强度下,作用1 min后进行后续实验。
1.2.2 划痕实验
将超声处理与不处理的细胞悬液接种于6孔板中,待细胞融合度达80%~90%时用无菌200 μL Tip枪头在板底部划等宽的直线。用PBS洗去漂浮细胞,将培养板放在37 ℃、CO2体积分数为5%的无菌培养箱中温育,分别在0、24、48和72 h显微镜下观察拍照,并比较0与72 h的划痕宽度,用细胞迁移率来表示,即(0 h的划痕宽度-72 h的划痕宽度)/0 h的划痕宽度。
1.2.3 细胞迁移侵袭Transwell小室实验
Transwell 迁移实验:将饥饿24 h后的细胞用胰酶消化,将不含血清的DMEM调整细胞密度至5×104个/mL,取200 μL细胞悬液加入到Transwell小室的上室,下室加500 μL含30%FBS的DMEM,小室放在24孔板中,在37 ℃、CO2体积分数为5%的无菌培养箱温育48 h。之后小室用4%多聚甲醛固定30 min,结晶紫染色30 min,光学显微镜下观察染色细胞的数量,任意取3个视野计数并做统计分析。
Transwell侵袭实验:将Matrigel基质胶与无血清的DMEM按1∶5稀释,取50 μL稀释的Matrigel基质胶加到上室,放入培养箱中3 h。Matrigel基质胶凝固之后的步骤同Transwell迁移实验。
1.2.4 细胞形态及F-actin染色观察细胞骨架
细胞经LIUS处理后温育在6孔板中,24 h后换液并在光学显微镜下观察细胞形态,100倍率拍照比较。
F-actin荧光染色:按照Abcam公司的F-actin细胞染色试剂盒(绿色荧光)提供的操作步骤对LIUS处理的细胞进行骨架染色。染色后利用荧光显微镜的蓝色荧光激发,在放大1 000倍条件下观察细胞的骨架变化,并拍照观察形态变化情况。
1.2.5 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测MMP-2、MMP-9的mRNA的表达
将LIUS处理后的细胞铺在6孔板中,细胞贴壁后用TRIzol提取总RNA,按照宝生物工程(大连)有限公司试剂盒的操作方法将总RNA逆转录为cDNA。RTFQ-PCR用SYBR Green染料为荧光检测信号,RTFQ-PCR在八联管中反应,每组每个基因设3个复孔。RTFQ-PCR引物见表1。
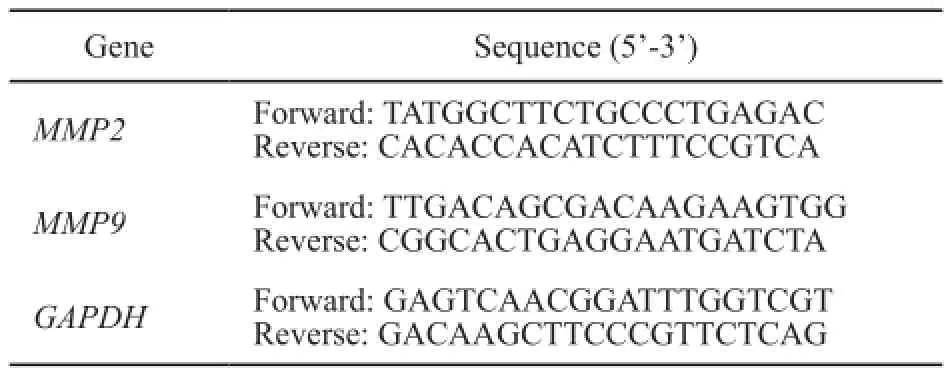
表1 GAPDH、MMP-2和MMP-9引物序列表Tab. 1 Primer sequence for GAPDH, MMP-2 and MMP-9
将RTFQ-PCR所得的目的基因的Ct值与相应的GAPDH的Ct值相减得ΔCt值,再将处理组的ΔCt值与对照组的ΔCt值相减得ΔΔCt值,数据采用2-ΔΔCt法进行分析。
1.2.5 蛋白质[印]迹法(Western blot)检测MMP-2、MMP-9的蛋白表达
各组细胞超声处理后在培养皿里培养24 h后,用RIPA细胞裂解液提取蛋白,冰上放置30 min。细胞充分裂解后,于12 000×g、4 ℃离心15 min,取上清液,用BCA法测蛋白浓度。将蛋白样品与5×上样缓冲液混匀,沸水煮5 min,按上海碧云天生物技术有限公司凝胶配制试剂盒说明配胶,上样量20 μg,依次经过电泳、PVDF转膜、5%脱脂牛奶封闭1 h之后加入一抗于4 ℃过夜。第2天加入一抗再次温育1 h后,TBST冲洗3次,每次5 min,然后室温敷二抗1.5 h,用TBST再冲洗3次,每次5 min。最后曝光显示条带。
1.3 统计学处理
采用SPSS 20.0统计软件进行统计分析。数据用χ±s
表示,各组之间的比较用t检验的方法。P<0.05为差异有统计学意义。
2 结 果
2.1 划痕实验表明低强度超声促进MHCC97H细胞迁移
处理与未处理的细胞铺板,待细胞长至80%~90%时做划痕实验,并观察3 d,比较0和72 h的划痕愈合率。由图1可见,低强度超声处理后的细胞划痕愈合能力比对照组(0 W/cm2)细胞快,并且1.5 W/cm2组划痕愈合最快,1.5 W/cm2组与1.0 W/cm2组、处理后各组与对照组之间差异有统计学意义(P<0.05),0.5 W/cm2组与1.0 W/cm2组间差异无统计学意义(P>0.05)。
2.2 Transwell小室细胞迁移侵袭结果
处理与未处理的细胞铺板,24 h后去掉因LIUS导致的死亡或凋亡的细胞,贴壁的细胞胰酶消化后行Transwell迁移和侵袭实验。实验结果如图2所示:Transwell小室上铺不带Matrigel基质胶显示的是细胞的迁移能力,Transwell小室上铺有Matrigel基质胶代表的是细胞的侵袭能力;各组细胞迁移数量的统计分析结果表明处理后细胞均比未处理细胞迁移增加,处理后各组与对照组相比差异有统计意义;各组细胞侵袭数量统计分析结果表明处理后细胞侵袭数量与未处理相比显著增加,且差异有统计学意义(P<0.05)。这表明LIUS提高了MHCC97H的体外迁移侵袭能力。
2.3 LIUS处理后细胞形态的改变
LIUS处理细胞24 h后分别在光学显微镜下和荧光显微镜下观察细胞形态和细胞骨架F-actin的变化。如图3A显示,处理后(尤其是1.5 W/cm2组)细胞之间变得疏松,连接不如对照组紧密,单个细胞的形态变得狭长伸出伪足。图3B荧光显色可见,对照组细胞之间有明显的紧密连接,处理后紧密连接减少,细胞骨架变得狭长、伸出伪足。
2.4 低强度超声处理对MMP-2、MMP-9 mRNA表达的影响
LIUS处理后细胞重新温育24 h,之后提取RNA,用Real-time RT-PCR的方法检测各组细胞中MMP-2、MMP-9的mRNA 的相对表达量。如图4所示,MMP-2 mRNA 的相对表达量,与对照组相比均提高且差异有统计学意义(P<0.05),另外本实验1.0 W/cm2组MMP-2 mRNA的表达量最高,且与0.5 W/cm2组相比,差异有统计学意义(P<0.05)。MMP-9的mRNA相对表达量,与对照组相比,处理后各组的表达量均有增加,且差异有统计学意义(P<0.05),但处理组各组之间表达差异无统计学意义(P>0.05)。

图1 划痕实验观察LIUS对MHCC97H迁移能力的影响Fig. 1 The influence of LIUS on the migration of MHCC97H through scratch assay
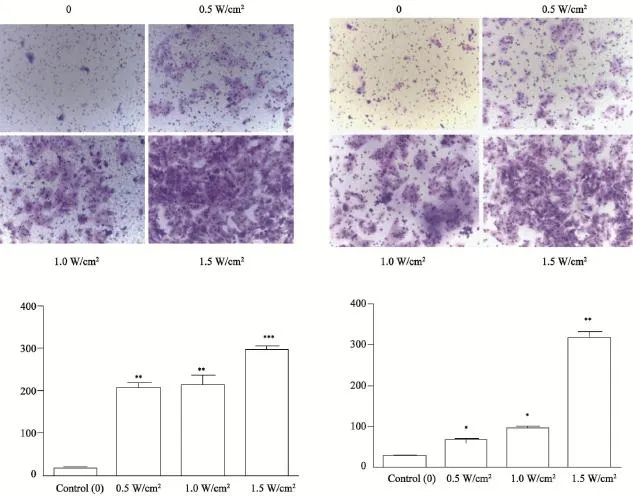
图2 Transwell体外迁移侵袭实验Fig. 2 Transwell migration and invasion assay in vitro

图3 细胞形态及F-actin染色表示细胞骨架的改变Fig. 3 Cell morphology and cytoskeleton changes by F-actin staining
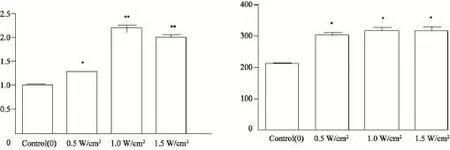
图4 LIUS处理对MMP-2、MMP-9 mRNA相对表达量的改变Fig. 4 The relative mRNA expression of MMP-2 and MMP-9 after LIUS irradiation
2.5 LIUS处理对MMP-2、MMP-9蛋白表达的影响
LIUS处理后细胞培养24 h后采用Western blot检测MMP-2、MMP-9的蛋白表达变化情况。如图5所示,MMP-2的蛋白表达受LIUS的影响,处理后细胞的表达量均比对照组增加,且1.0 W/cm2组是最高的;MMP-9的蛋白表达没有明显差异。
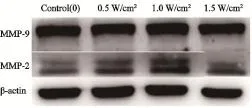
图5 LIUS对MMP-2、MMP-9的蛋白表达的影响Fig. 5 The protein expression of MMP-2 and MMP-9 after LIUS irradiation
3 讨 论
超声治疗是超声医学的重要组成部分。超声治疗是指应用超声能量作用于人体,产生相应的作用,改变机体的功能与组织状态,以达到治疗疾病的方法。LIUS一般指输出强度小于3 W/cm2,对人体组织不产生不可逆的损害,目前最常应用于临床康复理疗中。超声波治疗作用基础有3种效应:机械效应、热效应和空化效应。目前研究最多的是超声波的空化效应[6],空化效应指液体中的微小泡核在超声波作用下被激化,产生泡核的震荡、生长、收缩及崩溃等一系列动力学过程。
肝细胞肝癌是最常见的恶性肿瘤之一,是导致癌相关死亡的第三大原因[7],目前手术仍是治疗的主要方法。虽然近年来治疗方法有不断的改进,但肝癌患者的预后仍不佳,主要原因是转移复发。MHCC97H属于肝癌细胞系,来自复旦大学附属中山医院肝癌研究所,具有高侵袭性的特点,我们的研究主要观察超声处理后对于存活下的肝癌细胞的侵袭转移有何影响。
近年来,LIUS在肿瘤诊疗中的应用越来越多的被关注。一方面,超声能促进微泡(声敏剂)靶向治疗肿瘤,从而提高药物的敏感性及靶向浓度,达到治疗肿瘤的目的[8-9];另一方面,超声能抑制肿瘤的生长,体内、体外研究均证实超声治疗能有效杀伤肿瘤细胞、抑制肿瘤的生长[2,10],我们的研究也证实了这一点。然而,LIUS对于存活下来的肿瘤细胞的侵袭转移能力有何影响,很少有学者对此进行研究。有学者[11]提出高强度超声(high intensity ultrasound,HIUS)可能增加肿瘤转移的风险,但也有不同的观点,Xing等[12]用高强度聚焦超声(high intensity focused ultrasound,HIFU)对黑素瘤进行了处理,发现HIFU不增加肿瘤转移风险,而且可以抑制肿瘤免疫反应。LIUS对肿瘤细胞的侵袭转移的影响目前研究很少,并且和我们的研究得出了不同的结果。Wei等[13]用LIUS(21 KHz、46 mW/cm2、30 s)联合微泡对前列腺癌细胞PC-3侵袭转移性进行了研究,认为超声联合微泡抑制PC-3细胞的侵袭转移,并解释为这可能是通过降低金属基质蛋白酶MMP-2、MMP-9发挥作用的。吴欢等[14]利用1 MHz、0.3 W/cm2、60 s和1 MHz、0.6 W/cm2、30 s的超声参数,发现超声联合血呋啉单甲醚和SonoVue降低了乳腺癌细胞株MDA-MB-231的增殖能力和侵袭能力。这可能是因为所研究的肿瘤细胞类型不同所致,也可能与所用超声的强度、频率、处理时间、处理方式及观察时间点等的不同有关。本研究发现1 MHz、处理1 min,在0~2 W/cm2的强度下,随强度增加,超声对细胞的杀伤作用增强(结果中未表示);在2 W/cm2强度下,残存的细胞几乎很难生长,所以我们选取0~1.5 W/cm2的强度作研究。在本研究中,处理后细胞迁移侵袭能力增强,划痕实验、Transwell小室实验结果均表明1.5 W/cm2组细胞迁移能力最强且与其他两组间差异有统计学意义,但0.5 W/cm2组与1.0 W/ cm2组的差异不明显。在Western blot结果中,1.0 W/cm2组MMP-2的蛋白表达量是最高的,这说明MMP机制可能只是其中一个参与机制,而其具体机制还需进一步探讨。
基质金属蛋白酶(MMPs)是锌离子依赖型的蛋白水解酶家族,能够降解基底膜和细胞外基质大多数组分,在调节细胞外基质的合成和代谢中起重要作用。其中,与肝癌侵袭转移关系最密切的是MMP-2、MMP-9,它们都属于Ⅳ型胶原酶类[15]。本研究发现,经LIUS处理后的细胞MMP-2的mRNA和蛋白表达均增加,说明MMP-2可能参与促进肿瘤侵袭转移。有研究表明MMP-9既有抗肿瘤的作用也可促进肿瘤发展,可能与疾病阶段有关,在肿瘤早期阶段能促进肿瘤发展,在疾病晚期阶段能抑制肿瘤发展[16]。本研究结果发现,LIUS只改变了MMP-9的mRNA表达,可能是MMP-9蛋白表达与转录并不完全一致,没有发挥主要作用。
本研究还发现,经LIUS处理后的细胞形态发生了改变,在光学显微镜下可以看到细胞变长、失去正常上皮形态,这可能和细胞发生上皮间质转化有关。有研究表明,上皮间质转化是肝癌侵袭转移的关键[17]。在荧光显微镜下通过对F-actin进行染色,可以清楚地看到未处理细胞间的紧密连接,而处理后细胞间连接减少、细胞变形、细胞周围伸出细丝状的伪足。这种形态的改变可能是细胞侵袭迁移能力增强的一个原因。
本研究只在体外环境下探究了超声处理后细胞的侵袭转移能力的改变,在体内环境中是否也有相同的变化还需进一步探究。
综上所述,LIUS可以通过多种机制杀死肿瘤细胞、抑制肿瘤生长。LIUS对肝癌细胞MHCC97H的侵袭转移能力是促进的,这可能与LIUS增加了MMP-2的表达有关,同时可能与LIUS改变肿瘤细胞的形态有关。
[参 考 文 献]
[1] FENG Y, TIAN Z, WAN M. Bioeffects of low-intensity ultrasound in vitro: apoptosis, protein profile alteration, and potential molecular mechanism[J]. J Ultrasound Med, 2010, 29(6): 963-974.
[2] ZHANG Z, CHEN J, CHEN L, et al. Low frequency and intensity ultrasound induces apoptosis of brain glioma in rats mediated by caspase-3, Bcl-2, and survivin[J]. Brain Res, 2012, 1473(): 25-34.
[3] YOSHIDA T, KONDO T, OGAWA R, et al. Combination of doxorubicin and low-intensity ultrasound causes a synergistic enhancement in cell killing and an additive enhancement in apoptosis induction in human lymphoma U937 cells[J]. Cancer Chemother Pharmacol, 2008, 61(4): 559-567.
[4] WANG X L, ZHAO X Y, LI S, et al. A novel plasmid and SonoVue formulation plus ultrasound sonication for effective gene delivery in nude mice[J]. Life Sci, 2013, 93(16): 536-542.
[5] SHI J Y, GAO Q, WANG Z C, et al. Margin-infiltrating CD20(+) B cells display an atypical memory phenotype and correlate with favorable prognosis in hepatocellular carcinoma[J]. Clin Cancer Res, 2013, 19(21): 5994-6005.
[6] WOOD A K, SEHGAL C M. A review of low-intensity ultrasound for cancer therapy[J]. Ultrasound Med Biol, 2015, 41(4): 905-928.
[7] FORNER A, LLOVET J M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-1255.
[8] MASUI T, OTA I, KANNO M, et al. Low-intensity ultrasound enhances the anticancer activity of cetuximab in human head and neck cancer cells[J]. Exp Ther Med, 2013, 5(1): 11-16.
[9] LI H, FAN H, WANG Z, et al. Potentiation of scutellarin on human tongue carcinoma xenograft by low-intensity ultrasound[J]. PLoS One, 2013, 8(3): e59473.
[10] FENG Y, TIAN Z M, WAN M X, et al. Low intensity ultrasound-induced apoptosis in human gastric carcinoma cells[J]. World J Gastroenterol, 2008, 14(31): 4873-4879.
[11] FRY F J, JOHNSON L K. Tumor irradiation with intense ultrasound[J]. Ultrasound Med Biol, 1978, 4(4): 337-341.
[12] XING Y, LU X, PUA E C, et al. The effect of high intensity focused ultrasound treatment on metastases in a murine melanoma model[J]. Biochem Biophys Res Commun, 2008, 375(4): 645-650.
[13] WEI C, BAI W K, WANG Y, et al. Combined treatment of PC-3 cells with ultrasound and microbubbles suppresses invasion and migration[J]. Oncol Lett, 2014, 8(3): 1372-1376.
[14] 吴 欢, 许晓琳, 智 慧, 等. 声动力学治疗对MDAMB-231细胞增殖及侵袭能力的影响[J]. 中国医学影像技术, 2014, 30(2): 180-184.
[15] 郭 燕, 刘文超. 肝癌发生侵袭与转移分子机制的研究进展[J]. 现代肿瘤医学, 2014, 22(4): 932-936.
[16] MATUSIAK N, VAN WAARDE A, BISCHOFF R, et al. Probes for non-invasive matrix metalloproteinase-targeted imaging with PET and SPECT[J]. Curr Pharm Des, 2013, 19(25): 4647-4672.
[17] VAN ZIJL F, ZULEHNER G, PETZ M, et al. Epithelialmesenchymal transition in hepatocellular carcinoma[J]. Future Oncol, 2009, 5(8): 1169-1179.
An in vitro study of the effect of low intensity ultrasound on the migration and invasion of MHCC97H
YANG Mingzhen, LIU Bangzhong, SHI Mingfang, LI Yun, LIU Guanghua, WANG Ping (Department of Rehabilitation, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
LIU Bangzhong E-mail: liu.bangzhong@zs-hospital.sh.cn
Background and purpose:Low intensity ultrasound (LIUS) can kill cancer cells and promote their apoptosis. However, it is still unknown how it affects the migration and invasion of tumor cells. This study aimed to explore the effect of LIUS on human hepatocellular line MHCC97H in migration and metastasis and the possible mechanism in vitro.Methods:According to the intensity of ultrasonic irradiation, 4 experimental groups were established: control group (0 W/cm2), 0.5 W/cm2, 1.0 W/cm2and 1.5 W/cm2group. The migration and invasion ability of hepatocellular cells was detected by scratch assay and Transwell migration and invasion assay after the irradiation of LIUS. The changes of cytoskeleton after irradiation were observed by microscope and F-actin green fluorescence staining. The expressions of MMP-2 and MMP-9 were examined by real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot.Results:Low intensity ultrasound (≤1.5 W/cm2) promoted the migration and invasion of hepatocellular line MHCC97H. Scratch assay and Transwell assay showed much more cells under irradiation migrated through membrane than untreated. It was found that morphology of liver cancer cells changed after LIUS irradiation using optical microscope and fluorescence microscope. The results of RTFQ-PCR and Western blot showed upregulation of MMP-2 expression by LIUS in MHCC97H and high expression of MMP-9 mRNA.Conclusion:Low intensity ultrasound may promote the migration and invasion of MHCC97H through changing cytoskeleton and upregulating protein expression of MMP-2.
Low intensity ultrasound; Liver cancer cell; Migration; Matrix metalloproteinase
10.3969/j.issn.1007-3969.2015.12.002
R735.7
A
1007-3639(2015)12-0926-07
2015-05-29
2015-10-10)
刘邦忠 E-mail:liu.bangzhong@zs-hospital.sh.cn
