榄香烯脂质体对人胃癌细胞HGC-27的体内外作用的初步研究
2015-01-04
复旦大学附属中山医院中西医结合科,上海 200032
榄香烯脂质体对人胃癌细胞HGC-27的体内外作用的初步研究
顾喜喜,锁 涛,蔡定芳
复旦大学附属中山医院中西医结合科,上海 200032
背景与目的:近年来,许多研究表明榄香烯脂质体在临床治疗消化道肿瘤及其恶性胸腹水中应用广泛。本研究结合体内和体外实验旨在观察榄香烯脂质体对人胃癌细胞HGC-27生长的抑制作用。方法:在体外实验中,应用机器视觉-全自动活细胞观测分析系统(Cell-IQ)对不同浓度下的榄香烯脂质体进行观测,以筛选出对人胃癌HGC-27细胞产生抑制作用的最佳浓度,并通过流式细胞术分析在最佳浓度下,榄香烯脂质体对人胃癌细胞HGC-27凋亡的影响。在胃癌腹膜转移的裸鼠模型中,观察榄香烯脂质体、顺铂(cisplatin,DDP)等药物对裸鼠腹膜肿瘤指数(peritoneal cancer index,PCI)的影响,并用免疫组化检测CD31标记的肿瘤微血管密度(microvessel density,MVD)及血管内皮生长因子(vascular endothelial growth factor,VEGF)在肿瘤中的表达,以期对榄香烯脂质体抑制胃癌HGC-27细胞腹膜转移的机制进行探讨。结果:榄香烯脂质体作用于人胃癌细胞HGC-27后,Cell-IQ分析抑制作用随浓度增加,逐渐增强,以100 µg/mL为最佳,榄香烯脂质体浓度再增高,其抑制肿瘤作用不再增强。最佳作用时间为4~19 h。应用流式细胞术检测,100 µg/mL榄香烯脂质体作用于人胃癌HGC-27细胞24 h后,肿瘤细胞凋亡率为45%,对照组仅有0.019%。处理组的细胞凋亡率明显高于对照组。人胃癌腹膜转移裸鼠模型建立后给予榄香烯脂质体等药物干预,腹膜转移瘤PCI指数有明显差异,其中以联合治疗组下降明显,免疫组化检测发现CD31-MVD及VEGF蛋白表达与对照组差异无统计学意义(P>0.05)。结论:榄香烯脂质体对于人胃癌细胞有明确抑制作用,最佳质量浓度为100 µg/mL,最佳作用时间为4~19 h;榄香烯脂质体对人胃癌裸鼠腹腔转移有明确预防作用;榄香烯脂质体对人胃癌细胞抑制作用的主要机制可能为诱导凋亡。
榄香烯脂质体;胃癌;腹膜转移;HGC-27;Cell-IQ;凋亡
胃癌是消化道最常见的恶性肿瘤,多数确诊时已属中晚期,目前常规化疗、放疗对其治疗效果均差,胃癌手术后5年生存率仅20%~30%[1-2]。腹膜播散是胃癌转移复发及治疗失败的常见表现形式。在胃癌术后复发的患者中,发生腹膜转移的比例高达30%~50%[3-5]。即使是早期胃癌,根治手术后也有1.63%(4/308)的患者出现腹膜播散[6]。来自胃癌和结直肠癌的腹膜腔播散癌(peritoneal carcinomatosis,PC)患者的自然病程,平均仅为3~8个月[7-8]。发生腹膜转移后生存期短的主要原因是由于血-腹膜屏障的存在,常规的全身化疗药物很难进入,外科或肿瘤科医生一般仅行姑息性治疗。榄香烯脂质体(elemene liposome)是我国医药工作者自行开发的国家二类抗肿瘤新药,是从中药温郁金中提取的非细胞毒性抗肿瘤药。既往细胞学研究显示,榄香烯脂质体对于体外肿瘤细胞具有诱导凋亡,逆转肿瘤多药耐药,直接杀伤瘤细胞,增强免疫和抗血管生成等作用[9]。榄香烯脂质体已广泛应用于多种肿瘤的临床治疗中,对多种肿瘤细胞的增殖具有抑制作用。它具有低毒、高效和广谱等优点,不易产生耐药,而且能改善机体的免疫功能[10],特别是能够用于临床胸腹水的治疗。2010年在瑞典举行的第七届国际腹膜表面肿瘤学会议,出现了一种治疗PC的新理念,即对于那些高危发生腹膜转移的患者给予早期干预,或术后1年左右进行剖腹探查,或术中进行预防性腹腔灌注治疗进一步除灭显微镜下的残存肿瘤细胞,争取更好的预后。
有鉴于此,我们观察在最佳浓度下,榄香烯脂质体对人胃癌细胞HGC-27凋亡的影响。以及比较在腹膜转移早期应用榄香烯脂质体及常用腹腔化疗药物顺铂(cisplatin,DDP)对人胃癌HGC-27腹膜转移裸鼠模型的治疗作用。
1 材料和方法
1.1 实验材料
人胃癌HGC-27细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。4~6周龄无胸腺裸鼠37只,雄性,体质量18~20 g,在复旦大学附属中山医院SPF级动物中心内饲养。
榄香烯脂质体注射液(5 mg/mL)购自大连华立金港药业有限公司,DDP (10 mg/支)购自齐鲁制药有限公司,小牛血清、DMEM培养基购自上海博升生物科技有限公司,胰蛋白酶(trypsin)由上海华舜生物工程有限公司分装,Annexin Ⅴ和PI购自上海莱兹生物科技有限公司,48孔培养板购自丹麦NUNC公司,流式细胞仪购自美国Coulter公司,全自动活细胞观测分析系统(Cell-IQ)购自芬兰Chip-Man公司。
1.2 方法
1.2.1 分组
整个实验过程分批进行,每批细胞按所要检测的指标随机分为药物处理组和空白对照组。其中药物处理组设5个质量浓度,分别为:25、50、100、150和200 µg/mL。0 µg/mL为空白对照,即不加入药物。每孔设两个复孔,作用时间为48 h。
1.2.2 Cell-IQ基本细胞参数检测
使用48孔板,每孔接种5×104个细胞,加0.5 mL、10%胎牛血清(FBS)的DMEM培养基置37 ℃、CO2体积分数为5%培养箱中培养至对数生长期;待细胞贴壁后4 h后,按照实验设计分别加入25、50、100、150和200 µg/mL质量浓度的榄香烯脂质体,以0 µg/mL为对照组;将培养盖换成Cell-IQ专用培养盖(带进气孔和空气过滤器);使用消毒后的胶布密封培养板和培养盖;放入Cell-IQ专用培养箱;使用Cell-IQ Imaging软件,进行调焦记录,观察记录48 h;待记录结束后,使用Cell-IQ Analyser软件分析细胞的增长抑制曲线,筛选对榄香烯脂质体作用的最佳浓度。
1.2.3 Annexin Ⅴ/PI双染检测胃癌细胞HGC-27凋亡的影响
取对数生长期的胃癌细胞1×106个/mL接种于6孔培养板中,培养24 h,设3个复孔,分空白对照组和经Cell-IQ筛选得到的最佳榄香烯脂质体浓度组,检测24 h;细胞收集:悬浮细胞直接收集到10 mL的离心管中,每样本细胞数为5×106个/mL,350×g,离心5 min,弃去培养液;流式细胞仪数据分析判断:在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FITC-/PI-);右上象限是非活细胞,即凋亡晚期细胞,为(FITC+/PI+);而右下象限为凋亡早期细胞,显现(FITC+/PI-)。
1.2.4 接种与给药
预实验时9只裸鼠,接种1周后每周处死3只,剖腹探查了解成瘤情况,以腹腔肿瘤<1 mm时作为干预时间。预实验结果发现为第8天时肿瘤腹膜内已可见,约1 mm,选择接种1周后给药。调整细胞数为5×106个接种至裸鼠腹腔内。接种细胞后第8天,分组给药,每组7只,共4组,对照组自然病程,榄香烯脂质体组50 µg/g,DDP组为20 µg/g,联合用药组榄香烯脂质体50 µg/g+DDP 20 µg/g,以上药物均采用腹腔注射,每只裸鼠注射0.2 mL,每周1次,连续给药共3周。
1.2.5 饲养方法
实验动物全部饲养在中山医院实验动物中心动物房的空气层流架内,饲养条件为SPF级。
1.2.6 检测指标
第8周时,解剖动物,肉眼观察腹腔内转移瘤的局部生长、腹水、邻近淋巴结转移情况,并全面探查腹腔,取出可疑肿瘤组织、肿大淋巴结,用4%甲醛溶液固定、切片、染色后行光镜作常规病理组织检查,VEGF蛋白阳性表达为棕黄色颗粒,记分标准参照许良中等[11]的方法。CD31结果及MVD判定标准:采用抗CD31单克隆抗体标记血管内皮细胞,CD31定位于血管内皮细胞的细胞膜,棕色染色,计数MVD,由此来衡量血管生成的活跃程度,参照Weidner法[12]先在低倍镜(×100)下选取组织微血管数量最丰富的区域,然后在高倍镜(×400)视野范围计算3个视野血管的数目,取其平均值作为MVD。
改良裸鼠腹膜表面肿瘤指数参考PCI评分(华盛顿肿瘤研究中心)及Klaver等[13]的制定PCI指数,腹腔划分为8个区域,分为皮下、注射部位、大网膜、肝区、脾区、肠系膜、膈肌和壁腹膜,其中每个区域肿瘤大小分为4个等级,0分为肉眼未见明显肿瘤,1分为肿瘤最大直径1~2 mm,2分为肿瘤最大直径2~4 mm,3分为肿瘤最大直径大于4 mm,各个区域得分累计即为PCI指数。随后进行石蜡切片的制作。
1.3 统计学处理
统计学分析数据使用SPSS 17.0统计软件,多组数据间的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 机器视觉-全自动活细胞观测分析系统(Cell-IQ)分析结果
加入榄香烯脂质体24及48 h时,随着榄香烯脂质体质量浓度的上升,细胞死亡率逐渐升高,以100 µg/mL诱导的死亡率最高,质量浓度再上升坏死细胞不再增多(图1)。图2为HGC-27细胞用100 µg/mL榄香烯脂质体处理后24 h内的动态变化情况。加入100 µg/mL榄香烯脂质体后,胃癌HGC-27死亡细胞数逐渐上升,第4 h时超过正常细胞数,其中4~19 h作用最强,后逐渐下降。图3显示HGC-27细胞加入100 µg/mL榄香烯脂质体后不同时间细胞的死亡率。以榄香烯脂质体作用于HGC-27细胞后12 h的作用最强,细胞死亡率为52.16%±9.93%。综合数据分析显示,在加入100 µg/mL榄香烯脂质体12 h后对HGC-27肿瘤细胞的抑制作用最强。
2.2 流式细胞仪分析结果
我们选择流式细胞仪观察榄香烯脂质体促进胃癌HGC-27细胞凋亡的作用。图4荧光双参数点图显示,100 µg/mL榄香烯脂质体作用于人胃癌HGC-27细胞24 h后,肿瘤细胞凋亡率为45%,对照组仅有0.019%。处理组的细胞凋亡率明显高于对照组。从细胞凋亡时期来看,药物作用24 h后细胞凋亡以早期凋亡为主,提示榄香烯脂质体诱导细胞凋亡是其主要抗肿瘤机制之一。
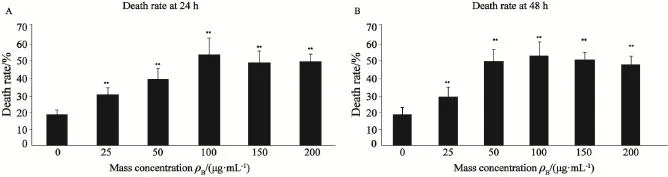
图1 不同浓度榄香烯脂质体作用HGC-27细胞的细胞死亡率Fig. 1 Elemene liposome inducing HGC-27 cell death in a concentration-dependent manner
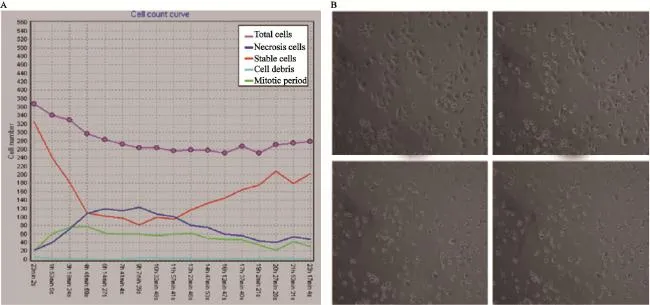
图2 100 µg/mL榄香烯脂质体加入HGC-27细胞后时间/细胞数曲线及cell-IQ图像Fig. 2 Dynamic changes of HGC-27 treated with 100 µg/mL elemene liposome
2.3 对裸鼠生长状态的影响
在造模4周时,对照组动物开始出现消瘦、倦怠,活动减少,而榄香烯脂质体组、DDP组及联合治疗组则到5周才开始出现类似情况。对照组在造模7周时,有裸鼠在上腹部开始出现可触及的肿块,而榄香烯脂质体组、DDP组、联合治疗组则较晚出现类似情况。动物饲养至8周,部分对照组裸鼠瘤体突出至腹壁,皮下可扪及,还可见明显的腹水症。有些裸鼠肋骨隐约可见,腹部膨隆,呈弓背状,出现明显消瘦、活动受限、倦怠乏力等衰竭症状。而联合治疗组裸鼠活动及生长状态明显好于对照组。
2.4 对裸鼠腹腔转移瘤的作用
实验结束时,处死所有实验动物,打开腹腔,发现腹腔内肿瘤多发转移,肠系膜、肝、大网膜等均现大小不等结节(图5)。从改良裸鼠PCI指数结果可见,DDP组、榄香烯脂质体组及联合治疗组的PCI指数分别为38、41和33,均较对照组明显下降(表1)。这说明榄香烯脂质体对腹腔种植瘤生长有明确抑制作用,其中尤以联合治疗组改善更加明显。
2.5 榄香烯脂质体对肿瘤组织CD31-MVD、VEGF表达的影响
实验结果显示,联合治疗组的CD31表达为3.50±0.97,与对照组的6.75±3.73比较,差异有统计学意义(P<0.05,表2)。证明榄香烯脂质体与DDP联用后能够在一定程度上抑制血管新生、发挥抗肿瘤和抑制肿瘤转移。实验结果显示,DDP组、榄香烯脂质体组、联合治疗组与对照组VEGF表达有一定差异,但差异无统计学意义(P>0.05,表2)。结合CD31检测结果提示,抗血管生成作用可能并非是榄香烯脂质体抑制肿瘤的主要机制。

图3 100 µg/mL榄香烯脂质体作用HGC-27细胞后不同时间细胞死亡率Fig. 3 Death rates of HGC-27 cells treated with 100 µg/mL elemene liposome at different time points

图4 Annexin Ⅴ/PI双染检测100 µg/mL榄香烯脂质体对胃癌HGC-27细胞凋亡的影响Fig. 4 Manifestation of HGC-27 cell death induced by 100 µg/mL elemene liposome after Annexin Ⅴ/PI double staining

图5 8周后后裸鼠腹腔种植瘤表现Fig. 5 Eight weeks after peritoneal implantation in nude mice
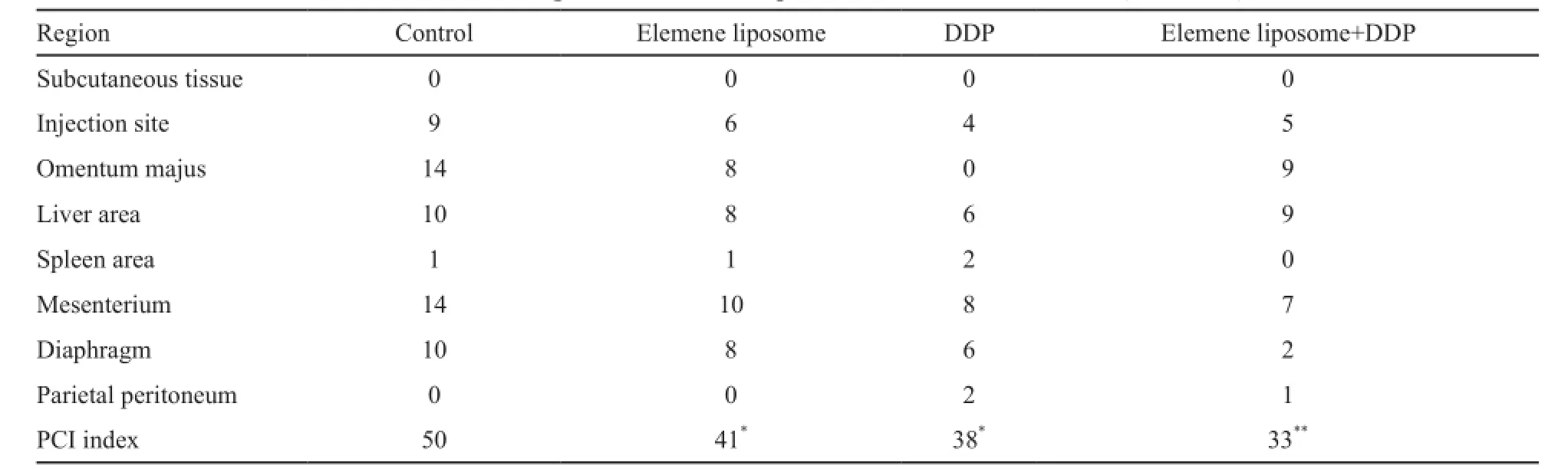
表1 改良Sugarbaker裸鼠腹膜表面肿瘤指数(PCI指数)Tab. 1 Modified sugarbaker nude mice peritoneal surface tumor index (PCI index)

表2 腹膜转移瘤组织中CD31-MVD和VEGF表达的影响Tab. 2 Expression of CD31-MVD and VEGF in peritoneal metastatic tumors
3 讨 论
传统细胞检测多以直接观察和手工记录为主,客观性较差,耗时费力,指标较少,对于重复性实验,结果容易出现较大差异,需要破碎细胞或对细胞造成一定程度的伤害,无法在活细胞生理条件下实时观察药物对细胞的相互作用。活细胞成像是近年来一种应用最先进的显微镜和计算机视觉系统分析活细胞动态过程的非侵入性技术,是分析活细胞的生长、增殖、分化、代谢和凋亡,以及其他各种生物学行为变化的新的观察研究手段[14]。机器视觉-全自动活细胞成像技术的联合使用在不影响细胞生长的同时,观察和记录活细胞的各种运动趋势及形态特征,同时分析多孔、多位点、多种类细胞的各项指标成为可能[15]。机器视觉的使用使实验获取更多最大的时间以及空间分辨率优势,并且能够降低分析成本[16]。
本研究应用Chipman公司生产的全自动活细胞观测分析系统(Cell-IQ)可在细胞培养的同时,利用活细胞成像和机器视觉技术,自动鉴定分析定量细胞的形态特征。我们应用Cell-IQ观察榄香烯脂质体对胃癌HGC-27细胞的作用发现,与既往的分析方法只有少数几个时间点的实验过程的资料不同,Cell-IQ系统能够连续跟踪和分析,具有强大的持续记录和分析功能,而且能够容纳两块培养板,兼容6、12、24、48及96孔培养板,可以同时进行两个细胞不同浓度的细胞检测,显著缩短了检测的人力成本和时间成本。
既往研究显示,诱导肿瘤细胞凋亡是榄香烯脂质体抗瘤作用机制的主要方面之一,这也是其不同于其他中药抗肿瘤药物的重要原因。从本实验结果来看,也确实证实了这一点。另外本研究结果显示,榄香烯脂质体作用于胃癌细胞HGC-27后最佳作用质量浓度是100 µg/mL,最佳作用时间为4~19 h。超过此时段,作用可能从诱导细胞凋亡转化为直接细胞毒作用。本研究为探索榄香烯脂质体诱导细胞凋亡的最佳作用浓度和时间,发挥药物的最佳效果,降低不良反应提供了实验基础。
关于腹腔播散肿瘤的治疗,由于医疗环境和诊疗常规的限制,目前国内仍然存在很大的争议,在患者选择、预后评价、临床证据、手术方式等方面,仍然没有达成共识。腹膜表面肿瘤工作多限于临床前的研究[17]。即使在开展腹腔治疗的一些欧美国家,发生腹膜转移后,只有10%~20%的患者能够获得积极的Sugarbaker方案治疗,而且手术成本非常高,因此在发生腹膜转移前进行早期干预和预测是必然的考虑。鉴于此,我们建立了腹膜表面肿瘤胃癌裸鼠模型,在肿瘤发生转移早期进行干预。本研究结果发现,对照组裸鼠各项指标均较治疗组差,联合治疗组生活状态明显好于对照组,第8周解剖后各组PCI指数也证实了这点,可见榄香烯脂质体对早期裸鼠胃癌腹膜转移有明确的抑制作用。上述实验结果进一步证明,Cell-IQ可以探索药物诱导凋亡的最佳作用浓度和最佳作用时间,为临床用药时如何发挥药物的最佳效应,降低化疗药物的不良反应提供实验基础。人胃癌裸鼠腹膜转移瘤模型与临床胃癌的发展进程十分相似,在胃癌腹膜转移早期给予榄香烯脂质体和常用腹腔化疗药物DDP进行干预治疗后发现有明确的疗效,值得临床进一步推广应用,另外也给腹膜转移性肿瘤的早期预防及治疗提供思路。
[1] WANEBO H J, KENNEDY B J, CHMIEL J, et al. Cancer of the stomach. A patient care study by the American College of Surgeons [J]. Ann Surg, 1993, 218(5): 583-592.
[2] MARUYAMA K, OKABOYASHI K, KINOSHITA T. Progress in gastric cancer surgery in Japan and its limits of radicality[J]. World J Surg, 1987, 11(4): 418-425.
[3] YOO C H, NOH S H, SHIN D W, et al. Recurrence following curative resection for gastric carcinoma[J]. Br J Surg, 2000, 87(2): 236-242.
[4] SCHWARZ R E, ZAGALA-NEVAREZ K. Recurrence patterns after radical gastrectomy for gastric cancer: prognostic factors and implications for postoperative adjuvant therapy[J]. Ann Surg Oncol, 2002, 9(4): 394-400.
[5] D’ANGELICA M, GONEN M, BRENNAN M F, et al.Patterns of initial recurrence in completely resected gastric adenocarcinoma [J]. Ann Surg, 2004, 240(5): 808-816.
[6] WU B, WU D, WANG M, et al. Recurrence in patients following curative resection of early gastric carcinoma[J]. J Surg Oncol, 2008, 98(6): 411-414.
[7] SADEGHI B, ARVIEUX C, GLEHEN O, et al. Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study[J]. Cancer, 2000, 88(2): 358-363.
[8] GLEHEN O, OSINSKY D, BEAUJARD A C, et al. Natural history of peritoneal carcinomatosis from non-gynecologic malignancies[J]. Surg Oncol Clin N Am, 2003, 12(3): 729-739.
[9] 高海德, 张佩禹, 赵荣宇, 等.榄香烯对小鼠瘤株Hca-A2/ p化疗的影响[J]. 中华肿瘤防治杂志, 2006, 7(13): 492-494.
[10] TANNOCK I F, LEE C M, TUNGGAL J K, et al. Limited penetration of anticancer drugs through tumor tissue: a potential cause of resistance of solid tumors to chemotherapy[J]. Clin Cancer Res, 2002, 8(3): 878-884.
[11] 许良中. 乳腺病理学[M]. 上海: 上海医科大学出版社, 1999: 359.
[12] WEIDNER N, SEMPLE J P, WELCH W R, et al. Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma[J]. N Engl J Med, 1991, 324(1): 1-8.
[13] KLAVER Y L, HENDRIKS T, LOMME R M, et al. Intraoperative hyperthermic intraperitoneal chemotherapy after cytoreductive surgery for peritoneal carcinomatosis in an experimental model[J]. Br J Surg, 2010, 97(12): 1874-1880.
[14] CHEN H, BAIC X, WANGX D. Application of probes in live cell imaging[J]. J Epithelial Biol Pharmacol, 2010, 3(1): 40-48.
[15] HARAGUCHI T. Live cell imaging: approaches for studying protein dynamics in living cells[J] . Cell Struct Funct, 2002, 27(5): 333-334.
[16] MYERS K R, LO K W, LYE R J, et al. Intermediate chain subunit as a probe for cytoplasmic dynein function: biochemical analyses and live cell imaging in PC12 cells[J]. J Neurosci Res, 2007, 85(12): 2640-2647.
[17] SUO T, MAHTEME H, QIN X Y. Hyperthermic intraperitoneal chemotherapy for gastric and colorectal cancer in Mainland China[J]. World J Gastroenterol, 2011, 17(8): 1071-1075.
Preliminary research on the effect of elemene liposome on gastric cancer cell HGC-27 and its mechanism
GU Xixi, SUO Tao, CAI Dingfang(Department of Integrative Medicine, Zhongshan Hospital,Fudan University, Shanghai 200032, China)
CAI Dingfang E-mail: dingfangcai@163.com
Background and purpose:In recent years, many studies have showed that elemene liposome is widely used in the treatment of digestive tract tumors, malignant pleural effusion and ascites. This study combined in vitro and in vivo experiments to observe the inhibitory effect of elemene liposome on the growth of human gastric cancer and the HGC-27 cell line.Methods:In order to screen the optimum concentration of elemene liposome, machine vision automatic live cell observation analysis system (Cell-IQ) was applied to detect the best inhibitory effect on human gastric cancer cell line HGC-27, and the flow cytometry was applied to further detect the apoptosis of HGC-27 treated with elemene liposome. The model of human gastric cancer peritoneal metastasis in nude mice was established to investigate the intervention of elemene liposome and cisplatin (DDP) on peritoneal cancer index (PCI). CD31 marker of tumor microvessel density (MVD) and the expression of vascular endothelial growth factor (VEGF) in tumor tissues were investigated to explore the mechanism underlying the inhibitory effect on peritoneal metastasis of HGC-27 cells in nude mice.Results:Cell-IQ analysis showed that the inhibitory effect of elemene liposome on HGC-27 presented in a positive concentration-dependent manner, which could not be further enhanced when the concentration exceeded 100µg/mL with the best reaction time between 4 and 19 hours. Flow cytometry showed that the early apoptosis rate was 45% in the elemene liposome group and only 0.019% in the control group. The early apoptosis rate was significantly higher in treatment group than that in control group (P<0.05). PCI was significantly lower in the group treated with elemene liposome plus DDP than that in control group (P<0.05) in the peritoneal metastasis of gastric cancer nude mice model. The expression of CD31-MVD and VEGF was not significantly different between the treated and control groups (P>0.05).Conclusion:Elemene liposome can inhibit human gastric cancer cells at the optimal concentration of 100 μg/mL with the best reaction time between 4-19 hours. Elemene liposome has a clear preventive effect on peritoneal metastasis of human gastric cancer in nude mice. Induction of apoptosis in gastric cancer cells may be the main mechanism underlying the inhibitory effect of elemene liposome on human gastric cancer cells.
Elemene liposome; Gastric cancer; Peritoneal metastasis; HGC-27; Cell-IQ; Apoptosis
10.3969/j.issn.1007-3969.2015.12.005
R735.2
A
1007-3639(2015)12-0945-08
2015-07-25
2015-10-26)
上海市卫生局中医药课题(2012L087A)。
蔡定芳 E-mail:dingfangcai@163.com
