CCL18通过与Nir1结合促进胶质瘤细胞侵袭的研究
2015-01-04陈萍萍田红艳李洪利史立宏任甜甜翟丽敏张宝刚
陈萍萍,田红艳,李洪利,史立宏,任甜甜,翟丽敏,张宝刚
1.潍坊医学院病理学教研室,山东 潍坊261053;
2.潍坊医学院医学研究实验中心,山东 潍坊261053;
3. 潍坊医学院药理学重点实验室,山东 潍坊261053
CCL18通过与Nir1结合促进胶质瘤细胞侵袭的研究
陈萍萍1,田红艳1,李洪利2,史立宏3,任甜甜1,翟丽敏1,张宝刚
1.潍坊医学院病理学教研室,山东 潍坊261053;
2.潍坊医学院医学研究实验中心,山东 潍坊261053;
3. 潍坊医学院药理学重点实验室,山东 潍坊261053
背景与目的:Nir1是CCL18的跨膜受体,CCL18能与之特异性结合而促进乳腺癌细胞的侵袭与转移,但其在胶质瘤细胞中的作用尚不清楚。该文旨探讨Nir1在胶质瘤侵袭中的作用及分子机制。方法:应用蛋白[质]印迹法(Western blot)检测Nir1在不同胶质瘤细胞系中的表达;利用siRNA技术抑制U251细胞中Nir1的表达;采用Western blot检测转染后Nir1蛋白的表达和转染前后U251细胞中Akt磷酸化的情况;使用体外侵袭实验检测转染后细胞的运动和侵袭能力;采用F-actin聚合实验检测F-actin的聚合能力。结果:Nir1在各胶质瘤细胞中均呈高表达;小RNA干扰技术沉默Nir1基因后,U251细胞中Nir1的蛋白表达量明显下降,侵袭并穿透Matrigel胶的细胞数目明显比对照组少(P=0.00);在CCL18刺激后细胞内的F-actin聚合量比对照组减少;Akt磷酸化试验结果显示,对照组细胞在CCL18的刺激下Akt更易发生磷酸化,实验组细胞无论是否存在CCL18,Akt磷酸化都受到抑制。结论:在胶质瘤细胞中存在Nir1蛋白高表达,通过与细胞膜上CCL18特异性结合来调节胶质瘤细胞的F-actin聚合和Akt的磷酸化进而调控胶质瘤细胞的运动和侵袭能力。
胶质瘤;Nir1;Akt;侵袭;siRNA
1.2.6 Akt磷酸化能力的检测实验
将实验设为2组:SiNir1/U251细胞和SCR/ U251细胞不接受CCL18刺激为一组,另一组为SiNir1/U251细胞和SCR/U251细胞用10 ng/mL的CCL18刺激5 min后,用冷PBS终止反应,裂解提取蛋白做Western blot实验,将所得结果进行分析。
1.3 统计学处理
所有数据采用SPSS 16.0统计软件进行分析。计量资料之间的比较采用独立样本t检验,定量数据采用χ±s。P<0.05为差异有统计学意义。
2 结 果
2.1 胶质瘤细胞中Nir1蛋白的表达
U251、LN-229和U87细胞进行培养待其长至90%满时,裂解提取蛋白做Western blot实验。灰度扫描结果显示,Nir1在U251、LN-229和U87细胞系中均有表达(图1)。
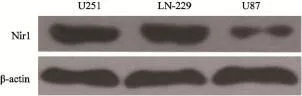
图1 U251、LN-229和U87细胞中Nir1的表达Fig. 1 The expression of Nir1 in U251, LN-229 and U87 cells
2.2 siNir1/U251细胞和SCR/U251细胞中Nir1蛋白的表达
用小RNA干扰技术沉默Nir1后,siNir1/ U251细胞中Nir1蛋白的表达下降(图2),提示细胞转染成功。
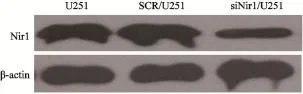
图2 siNir1/U251细胞和SCR/U251细胞中Nir1的表达Fig. 2 The expression of Nir1 in the siNir1/U251 and SCR/U251 cells
2.3 体外侵袭实验
在高倍镜下观察,随机取5个视野的siNir1/ U251和SCR/U251穿透Matrigel膜的细胞数分别为(16.33±2.26)和(44.47±2.03)。统计结果显示,siNir1/U251穿透Matrigel膜的细胞数目与SCR/U251穿透Matrigel膜的细胞数目相比明显减少。差异有统计学意义(t=35.89,P=0.000,图3)。
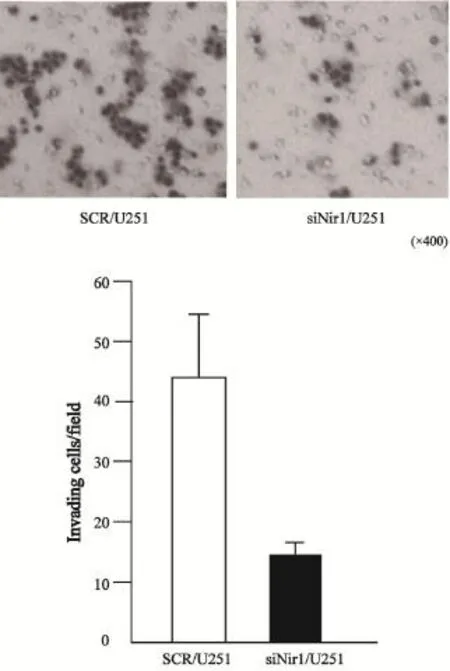
图3 Nir1对U251细胞侵袭力的影响Fig. 3 The influence of Nir1 on the invasion of U251cells
2.4 F-actin聚合实验
F-actin聚合实验结果显示,在CCL18刺激后的15 s到2 min内,siNir1/U251细胞内发生肌动蛋白聚合量比SCR/U251细胞明显减少(图4)。
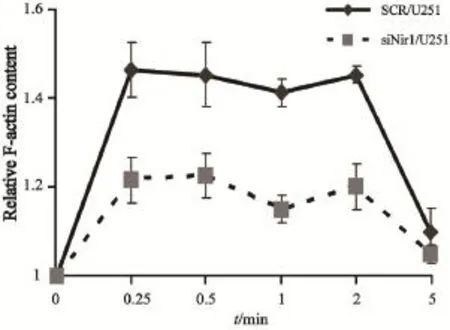
图4 细胞在CCL18刺激后不同时间的F-actin聚合量Fig. 4 Time course of relative F-actin content in cells after the stimulation of CCL18
2.5 Akt磷酸化能力的检测
为了研究Nir1蛋白表达降低影响F-actin聚合量的分子机制,本研究对2组细胞中Akt的磷酸化的能力进行了检测。结果显示,在SCR/U251细胞组中,在CCL18的刺激下更易发生A k t的磷酸化,但在Nir1表达降低的U251细胞组中无论是否有C C L 1 8的刺激,A k t磷酸化均受抑制(图5)。这表明在U251细胞中Nir1与CCL18特异性的结合增强了Akt磷酸化的能力,而降低U251细胞中Nir1的表达导致Akt磷酸化减少。
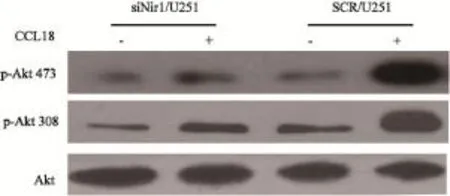
图5 Western blot检测CCL18刺激后Akt的磷酸化结果Fig. 5 Western blot analysis of the phosphorylation of Akt stimulated by CCL18
3 讨 论
胶质瘤是中枢神经系统中恶性程度极高的肿瘤,因其易侵袭周围正常的脑组织,导致手术难以完全切除。尽管现代诊疗技术已有了较高的发展,但胶质瘤患者的平均生存期仍然不超过15个月[10]。近几年发现,趋化因子不仅与炎性反应、免疫、血管生成以及器官的发育相关,而且许多趋化因子与其相应的受体结合参与了肿瘤的发生、发展和侵袭转移的过程[11]。然而,Nir1和CCL18对胶质瘤的运动和侵袭能力的影响尚未见报道。本研究结果显示,Nir1在胶质瘤细胞系中高表达,并且应用小RNA干扰技术降低了Nir1在胶质瘤U251细胞中表达。通过体外侵袭实验观察到Nir1表达降低的U251细胞,其侵袭迁移能力明显降低。细胞的运动能力与细胞的侵袭能力密切相关,而F-actin聚合是细胞运动的关键[16]。有文献[9]报道,Akt2的沉默可以减少F-actin聚合从而导致胶质瘤U87细胞的运动和侵袭能力降低。为了明确胶质瘤U251细胞在Nir1被抑制后运动能力的降低是否与F-actin聚合有关,本研究进行了F-actin聚合实验和Akt磷酸化能力的检测实验。结果显示,Nir1被抑制后,U251细胞的F-actin聚合明显减少,这是引起U251细胞运动能力降低的重要原因之一。而胶质瘤细胞Akt磷酸化能力的实验结果显示,在CCL18刺激下U251细胞更易发生Akt磷酸化;且在Nir1表达下降的U251细胞中无论是否存在CCL18,Akt磷酸化均受抑制,这说明U251细胞中Nir1与CCL18特异性的结合增强了Akt磷酸化的能力。Akt作为PI3K/Akt信号通路的组成部分,已被广泛关注,同时本课题组前期研究证明,Akt在胶质瘤的侵袭中有重要作用[17]。本研究结果显示,Nir1表达降低后导致胶质瘤细胞中Akt的磷酸化和F-actin聚合量的减少是胶质瘤细胞运动和侵袭能力减弱的重要原因。
综上所述,Nir1作为CCL18的受体在调控胶质瘤细胞的侵袭和运动能力方面起着重要的作用。应用小RNA干扰技术降低U251细胞中Nir1的表达,细胞的侵袭能力明显降低,并且这种调控可能是通过调控F-actin聚合和Akt的磷酸化实现的。更多与Nir1作用有关的调控机制有待进一步研究,这也将为胶质瘤的治疗提供新的思路。
[1] STEWART L A. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials [J]. Lancet, 2002, 359(9311): 1011-1018.
[2] LEV S, HERNANDEZ J, MARTINEZ R, et al. Identification of a novel family of targets of PYK2 related to drosophila retinal degeneration B (rdgB) protein [J]. Mol Cell Biol, 1999, 19(3): 2278-2288.
[3] CHEN P, LI K, LIANG Y, et al. High NUAK1 expression correlates with poor prognosis and involved in NSCLC cells migration and invasion [J]. Exp Lung Res, 2013, 39(1): 9-17.
[4] ZHANG B, YIN C, LI H, et al. Nir1 promotes invasion of breast cancer cells by binding to chemokine (C-C motif) ligand 18 through the PI3K/Akt/GSK3β/Snail signalling pathway [J]. Eur J Cancer, 2013, 49(18): 3900-3913.
[5] SCHRAUFSTATTER I U, ZHAO M, KHALDOYANIDI S K, et al. The chemokine CCL18 causes maturation of cultured monocytes to macrophages in the M2 spectrum [J]. Immunology, 2012, 135(4): 287-298.
[6] CHANG C Y, LEE Y H, LEU S J, et al. CC-chemokine ligand 18/pulmonary activation-regulated chemokine expression in the CNS with special reference to traumatic brain injuries and neoplastic disorders [J]. Neuroscience, 2010, 165(4): 1233-1243.
[7] 孙 磊, 刘雨清, 李小龙, 等. Gab2-Akt-ARK5通路在胶质瘤侵袭中的研究[J]. 中国肿瘤临床, 2014, 24(9): 551-554.
[8] 陈为一, 李小龙, 齐岳亮, 等. PTTG1影响胶质瘤细胞侵袭力机制的研究[J]. 中国癌症杂志, 2014, 24(5): 329-332.
[9] 张宝刚, 谷 峰, 李文良, 等. 小RNA干扰Akt2对U87恶性胶质瘤细胞迁移和侵袭能力的影响[J]. 解剖学报, 2009, 40(5): 691-695.
[10] TOKER A, YOELI-LERNER M. Akt signaling and cancer: surviving but not moving on [J]. Cancer Res, 2006, 66(8): 3963-3966.
[11] 欧周罗. 趋化因子与乳腺癌[J]. 中国癌症杂志, 2013, 23(8): 618-623, 636.
[12] ISLAM S A, LING M F, LEUNG J, et al. Identification of human CCR8 as a CCL18 receptor [J]. J Exp Med, 2013, 210(10): 1889-1898.
[13] MENG F, LI W, LI C, et al.CCL18 promotes epithelialmesenchymal transition, invasion and migration of pancreatic cancer cells in pancreatic ductal adenocarcinoma[J]. Int J Oncol, 2015, 46(3): 1109-1120.
[14] LI H Y, CUI X Y, WU W, et al. Pyk2 and Src mediate signaling to CCL18-induced breast cancer metastasis [J]. J Cell Biochem, 2014, 115(3): 596-603.
[15] CHEN J, YAO Y, GONG C, et al. CCL18 from tumorassociated macrophages promotes breast cancer metastasis via PITPNM3 [J]. Cancer Cell, 2011, 19(4): 541-555.
[16] MOUNEIMNE G, DESMARAIS V, SIDANI M, et al. Spatial and temporal control of cofilin activity is required for directional sensing during chemotaxis [J]. Curr Biol, 2006, 16(22): 2193-2205.
[17] ZHANG B, GU F, SHE C, et al. Reduction of Akt2 inhibits migration and invasion of glioma cells[J]. Int J Cancer, 2009, 125(3): 585-595.
Nir1 promotes invasion of glioma cells by binding to chemokine (C-C motif) ligand 18
CHEN Pingping1, TIAN Hongyan1, LI Hongli2, SHI Lihong3, REN Tiantian1, ZHAI Limin1, ZHANG Baogang1(1. Department of Pathology, Weifang Medical University, Weifang 261053, Shandong Province, China; 2. Medicine Research Center, Weifang Medical University, Weifang 261053, Shandong Province, China; 3. Research Center of Pharmacology, Weifang Medical University, Weifang 261053, Shandong Province, China)
ZHANG Baogang E-mail: zbg111@ hotmail.com
Background and purpose:Nir1 is a transmembrane receptor for chemokine (C-C motif) ligand 18. CCL18 specifically binds to Nir1 at the cellular membrane of breast cancer cells to exert its invasion and metastasis. However, the specific mechanism of Nir1 is not clear in glioma. This study probed the effect and mechanism of Nir1 in the invasion of glioma cells.Methods:Western blot was used to detect the expression of Nir1 in glioma cells. siRNA plasmid was used to transfect U251 cells. Western blot was used to analyze the expression of Nir1 and protein phosphorylation of Akt in the cells transfected by Nir1 plasmid. In vitro Matrigel invasion assay was used to detect the invasive ability in the cells that were transfected. F-actin polymerization assay was used to detect F-actin recognition ability in cells.Results:The expression of Nir1 was higher in all glioma cells. After transfection, the invasion of siNir1/ U251 was obviously decreased than the SCR/U251, F-actin content was reduced compared to the control group. Akt phosphorylation experiment result showed that the protein phosphorylation of Akt was enhanced in control group cells CCL18 following stimulation. However, the existence of CCL18 would affect the phosphorylation of Akt in siNir1/胶质瘤是人体中枢神经系统常见的恶性肿瘤,具有侵袭性高、手术完整性切除困难、易复发等特点[1]。因此,研究胶质瘤侵袭的分子机制对治疗该疾病有重要的意义。Nir1(PYK2 N-terminal domain-interacting receptor 1)也被命名为PITPNM3,亦被命名为非典型趋化因子受体6(ACKR6),是CC族趋化因子配基18(CCL18)的跨膜受体,已在人类乳腺癌细胞中发现表达[2-3],有研究[4]证明,CCL18是通过与乳腺癌细胞的细胞膜上Nir1的特异性结合而促进乳腺癌细胞的侵袭与转移。体内的CCL18主要由M2表型的巨噬细胞分泌[5],而脑内的CCL18主要是由来源于血液单核巨噬细胞系统的小胶质细胞分泌的[6]。在胶质瘤中Nir1与CCL18的关系及其对胶质瘤侵袭性的影响尚未见报道。因此,本研究采用蛋白[质]印迹法(Western blot)检测胶质瘤细胞Nir1的蛋白表达情况,用小RNA干扰技术降低胶质瘤细胞中Nir1蛋白的表达,并且体外侵袭实验检测到Nir1蛋白表达降低后,胶质瘤细胞的侵袭力降低。为了探讨Nir1影响胶质瘤细胞的侵袭和运动能力的分子机制,本研究采用F-actin聚合实验和Western blot实验对转染前后U251细胞F-actin的聚合能力和Akt磷酸化的情况进行了检测。1 材料和方法1.1 主要试剂U87、U251和LN-229细胞系购自美国模式培养物集存库(American Type Culture Collection,ATCC)细胞库,山羊抗人多克隆Nir1抗体购自美国Santa Cruz公司,CCL18购自美国Sigma公司,鬼笔环肽购自美国Invitrogen公司,一抗Akt、p-Akt购自美国Cell Signaling公司,RPMI-1640培养液购自美国Hyclone公司,胰蛋白酶、彩色预染蛋白和D0018质粒中量抽提试剂盒均购自上海碧云天生物技术有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,Matrigel基质胶购自威格拉斯生物技术(北京)有限公司,Transwell小室、细胞转染试剂购自北京康为世纪生物科技有限公司。1.2 方法1.2.1 细胞培养将U87、U251和LN-229细胞培养于RPMI-1640/F10培养基中,置于37 ℃、CO2体积分数为5%的培养箱中贴壁生长,取对数生长期的细胞做实验。1.2.2 质粒构建与细胞转染质粒Nir1 siRNAs由上海吉玛制药技术有限公司构建。当U251细胞的生长密度达到85%时,分别瞬时转染具有一段乱码序列的质粒和具有目标片段5’-GGGAGAAGUGGCUUCGUAATT-3’的质粒,将细胞分为对照组SCR/ U251和实验组siNir1/U251。转染步骤参照转染试剂说明书。1.2.3 Western blot检测对siNir1/U251细胞和SCR/U251细胞培养72 h后,裂解提取蛋白。制备凝胶,电泳,转膜,用5%脱脂奶粉封闭1 h,滴加一抗Nir1、Akt和pAkt(浓度均为1∶1 000)于4 ℃温育过夜,TBST洗膜后,结合二抗温育后暗室内曝光显影,具体操作参照孙磊等[7]文献。1.2.4 体外侵袭能力的检测按文献[8]操作,把细胞悬液加入到Transwell小室内,同时加入10 ng/mL的CCL18,下室内加入20%的胎牛血清,放入细胞培养箱培养24 h。将结果置于400倍显微镜下观察,5个高倍镜视野,计数Transwell小室下室面的细胞数。每个实验重复3次,取平均数作为实验结果。1.2.5 肌动蛋白聚合实验按文献[9]操作,细胞铺6孔板内,细胞用U251.Conclusion:Nir1 is high expression in glioma cells, and Nir1 binding to chemokine CCL18 promotes glioma cells invasion and metastasis through regulation the phosphorylation of Akt and F-actin polymerization .
Glioma; Nir1; Akt; Invasion; siRNA10 ng/mL的CCL18分别刺激15和30 s,1、2和5 min后固定,F-actin特异性荧光染料鬼笔环肽染色,清洗细胞,用甲醇萃取90 min,用荧光分光光度计对萃取物内荧光染料的相对含量进行检测。F-actin相对含量用下列公式计算:刺激时间F-actin值/未刺激F-actin值=刺激时间荧光值。每个实验重复3次,取平均数作为实验结果。
10.3969/j.issn.1007-3969.2015.12.001
R739.41
A
1007-3639(2015)12-0921-05
2014-11-05
2015-01-18)
国家自然科学基金(81072068);山东省中青年科学家科研奖励基金(博士基金)(2010BSB14050);潍坊医学院青年科技创新基金(K11QC1002);潍坊医学院附属医院青年创新基金(K12QC1002)。
张宝刚 E-mail:zbg111@hotmail.com
