长链非编码RNA-H19促小细胞肺癌细胞株A549 上皮-间质转化及侵袭
2015-01-04
沙洋县人民医院外三科,湖北 荆门 448200
长链非编码RNA-H19促小细胞肺癌细胞株A549 上皮-间质转化及侵袭
黄时军,杨 军,孙 辉
沙洋县人民医院外三科,湖北 荆门 448200
背景与目的:近年来研究发现长链非编码RNA(long non-coding RNA,lncRNA)可能在肿瘤的发生、发展中发挥着重要作用,其中H19在膀胱癌、胃癌、肝细胞癌等多种肿瘤中呈现异常过表达,并且能够促进肿瘤增殖,增加肿瘤细胞迁移和侵袭能力等。但H19在非小细胞肺癌中的表达及功能尚不十分清楚。本研究拟观察H19对非小细胞肺癌细胞株A549增殖、上皮-间质转化(epithelial-mesenchymal transition,EMT)及侵袭能力的影响。方法:在A549中通过转染质粒使H19过表达,通过细胞计数试剂盒(cell counting kit-8,CCK-8)检测H19过表达对A549细胞增殖能力的影响,通过Transwell检测其对A549细胞侵袭能力的影响,通过光学显微镜观察细胞的形态学变化,通过蛋白[质]印迹法(Western blot)检测EMT相关蛋白的变化,通过荧光素酶报告基因检测CDH1基因启动子活性的变化。结果:在A549中H19过表达后,细胞增殖能力有所增强(空白对照组D值为1.64±0.02,阴性对照组为1.59±0.04,过表达H19组为1.89±0.02,P<0.05),细胞的侵袭转移能力增强[阴性对照组(30±6)个/视野,过表达H19组(110±7)个/视野,P<0.05)],细胞发生伪足变长增多、细胞间隙增大等EMT特征的形态学变化,同时蛋白水平CDH1表达降低,而VIM及SNAI2的表达升高,伴有CDH1基因启动子活性下降60%以上(P<0.05)。结论:在非小细胞肺癌细胞株A549中H19过表达可诱使其发生EMT,并促进其增殖及侵袭能力。
长链非编码RNA;H19;非小细胞肺癌;侵袭;上皮-间质转化
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度超过200 nt的RNA,其本身并不转录编码成为蛋白质,但可以多种形式参与调控基因的表达。H19是一个编码2.3 kb的lncRNA,在哺乳动物中序列高度保守,也是最早被人们所认识的lncRNA之一。既往研究证实H19在胚胎发育中发挥重要作用,并在膀胱癌、胃癌、肝细胞癌等多种肿瘤中表达异常,参与肿瘤的增殖及侵袭转移等。但H19在非小细胞肺癌中的表达及功能尚不清楚。本文旨在研究H19对非小细胞肺癌细胞株A549 增殖、发生上皮-间质转化(epithelial-mesenchymal transition,EMT)及侵袭能力的影响。
1 材料和方法
1.1细胞及培养
人非小细胞肺癌细胞株A549由本实验室既往保存,培养于含10%胎牛血清的RPMI-1640培养基(武汉博士德生物工程有限公司)中,置于37 ℃、CO2体积分数为5%的温箱内培养。
1.2 主要试剂
抗CDH1、N-cadherin、VIM、SNAI1、SNAI2、ZEB1及GAPDH抗体均购自美国Cell Signaling Technology公司,预铺好Matrigel基质胶的Transwell(8 μm孔径)等其他耗材均购自武汉博士德生物工程有限公司。
1.3 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测H19过表达质粒的效应
P C R引物由深圳华大基因科技服务有限公司设计并合成。H19引物顺义链为5’-GCCTTGACGTGCTGGATCT-3’,反义链为5’-TCCGATGCTTTACTCAAGAAGTT-3’;U6引物顺义链为5’-GACGGACACCCTCACTA CTG-3’,反义链为5’-GACGTTCATGATTCAAG CATGC-3’。
利用LipofectamineTM2000转染试剂常规转染H19过表达质粒后,收集A549细胞。通过TRIzol一步法提取总RNA,按逆转录试剂盒(Fermentas,No.K1633,武汉博士德生物工程有限公司)操作说明合成cDNA,之后应用上述引物按RTFQ-PCR试剂盒(Fermentas)说明书进行PCR扩增,采用ABI7300检测并分析。
1.4 CCK-8增殖实验
收集转染后的各组A549细胞,以每孔1×103个的细胞密度接种于96孔板中,在培养箱中常规培养24、48及72 h。按上述时间点加入终浓度为10%的CCK-8试剂(武汉启动子生物有限公司),避光放置1 h后用酶标仪检测450 nm波长下的吸光度(D)值。
1.5 侵袭能力实验
收集转染后的各组A549细胞,用无血清RPMI-1640培养基重悬,以每孔5×104个的细胞密度加入到预铺好Matrigel基质胶的Transwell小室的上室内,下室加入600 mL完全培养液,培养箱中常规培养24 h取出上室,用4%多聚甲醛处理后用0.01%结晶紫染色,于200倍光学显微镜下计数穿膜细胞数,随即取5个视野,取平均值。每组实验设3个复孔,实验重复3次。
1.6 细胞形态学观察
采用普通光学显微镜观察H19过表达的A549细胞的形态学变化。
1.7 蛋白[质]印迹法(Western blot)检测
收集细胞,加入适量RIPA裂解获取细胞总蛋白液,加入适量SDS上样缓冲液于100 ℃水浴解交联。蛋白样品行聚丙烯酰胺凝胶电泳,PVDF膜转膜并用脱脂奶粉封闭非特异性结合,然后依次温育一抗及二抗后,用化学发光法显影,检测过表达H19后A549细胞中CDH1、N-cadherin、VIM、SNAI1、SNAI2及ZEB1等EMT相关蛋白水平的变化。
1.8 荧光素酶报告基因检测
将A549细胞以每孔1×105个细胞的密度接种于24孔板中,第2天当约70%的细胞融合时,利用LipofectamineTM2000共转染(含有CDH1启动子的荧光素酶质粒和H19表达质粒)细胞,常规培养48 h后,按照双荧光素酶报告基因检测试剂盒(Promega)在多功能光度计上测定并分析过表达H19后A549细胞中CDH1启动子活性的变化。
1.9 统计学处理
用SPSS 12.0统计学软件进行统计分析。实验数据以χ±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 转染H19质粒在A549细胞中成功过表达
转染H19质粒后,通过RTFQ-PCR检测A549细胞中H19的表达。结果显示,转染质粒后H19的表达较对照组升高20倍,验证了H19质粒可成功过表达H19(P<0.05,图1)。
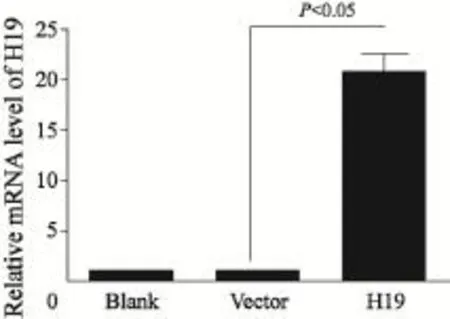
图1 H19过表达质粒在A549细胞中成功表达Fig. 1 H19 was successfully overexpressed in A549 cells
2.2 H19可促进A549的增殖能力
转染H19及对照空质粒(Vector)后,将细胞接种于按照上述方法检测A549细胞的增殖能力。结果显示,接种72 h后,过表达H19的细胞增殖能力有所增强:空白对照组D值为1.64±0.02,阴性对照组为1.59±0.04,H19过表达组为1.89±0.02。差异有统计学意义(P<0.05,图2)。
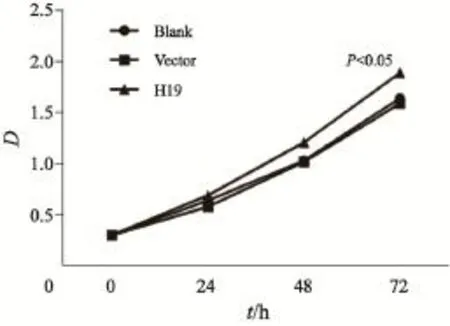
图2 过表达H19促进A549细胞增殖Fig. 2 H19 enhanced the proliferation of A549 cells
2.3 H19可促进A549的侵袭能力
转染H19及对照空质粒(Vector)后按照上述方法检测A549细胞的侵袭能力。结果提示,过表达H19后穿膜细胞数为(110±7)个/视野,较阴性对照组的(30±6)个/视野显著增加。差异有统计学意义(P<0.05,图2)。
2.4 H19诱导A549细胞发生形态学变化
采用普通光学显微镜观察转染H19质粒24 h后细胞形态学变化。结果发现,与对照质粒组及空白对照组相比,A549细胞H19过表达组发生明显的EMT变化,如细胞变长呈梭形,伪足变长增多,细胞间隙增大等(图3)。
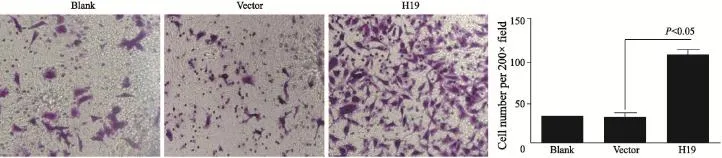
图3 H19促进A549侵袭能力Fig. 3 H19 enhanced the invasion of A549 cells
2.5 H19影响EMT相关蛋白的表达
将细胞裂解提取总蛋白后行Western blot检测发现,过表达H19后上皮性标志CDH1蛋白表达明显减少,相对应的是间质性标志N-cadherin及VIM的表达明显增加。本研究同时检测了与EMT相关的转录因子的表达,其中SNAI2的表达明显增加,而SNAI1及ZEB1的表达无明显变化(图4)。
2.6 H19对CDH1基因启动子活性的影响
转染H19过表达质粒及CDH1基因启动子质粒后检测其荧光素酶活性。结果如图5所示,H19对CDH1基因启动子活性具有明显的抑制作用,荧光素酶活性下降60%以上。差异有统计学意义(P<0.05)。

图4 H19诱导A549发生形态学改变Fig. 4 H19 induced the cell morphology changes of A549 cells

图5 H19促进EMT相关蛋白变化Fig. 5 H19 induced the EMT process of A549 cells

图6 H19抑制CDH1启动子活性Fig. 6 H19 depressed the promoter activity of CDH1
3 讨 论
随着人类基因组计划的完成,人们发现基因组中除了约20 000个蛋白编码基因(只占全基因组的2%左右),同时还含有大量的非编码RNAs(non-coding RNAs,ncRNAs)[1]。ncRNAs可以通过表观遗传学修饰、转录调控、蛋白质翻译、蛋白质降解等多种机制参与、影响细胞的生物学进程,其中针对microRNA(微RNA)功能的研究已经取得了很多成果,但对lncRNA的研究尚在起步阶段[1-3]。
H19作为一个具有反式转录调控功能的lncRNA,最初在胚胎发育相关研究中被发现,引起了人们的兴趣[4]。近年来,一系列的研究发现,H19在膀胱癌、胃癌、肝细胞癌等多种肿瘤中呈现异常的过表达,而且在多个体内、体外实验中发现,H19过表达促进肿瘤的增殖,增加肿瘤细胞的迁移和侵袭能力,减低对化疗药物的敏感性,提示H19在肿瘤的发生、发展中扮演重要的角色。但H19在非小细胞肺癌中的表达及功能尚不十分清楚[5-7]。
本研究在非小细胞肺癌细胞株A549中,通过转染质粒使H19过表达,观察并验证了H19的功能。结果发现,H19过表达的细胞增殖能力有所增强。进而我们通过预铺好Matrigel基质胶的Transwell小室模拟肿瘤转移时需要穿透的组织细胞基底膜,结果显示,H19过表达可增加A549细胞的穿膜个数,即H19过表达促进了A549细胞的侵袭能力。本研究结果还发现,A549过表达H19后细胞从椭圆形变成长梭形,伪足增多变长,细胞间隙也相应变大,而这些形态学改变是EMT的特征表现。EMT作为一种复杂而且重要的生物学效应,广泛参与到多种病理生理进程,包括恶性肿瘤的侵袭转移[1,4]。肿瘤细胞发生EMT后,细胞的极性消失,运动及侵袭能力增加,从侧面解释H19过表达对A549细胞侵袭能力的促进作用。为了证实H19通过使细胞发生EMT从而促进细胞的侵袭能力,本研究采用Western blot检测H19对细胞中EMT相关蛋白如CDH1、N-cadherin及VIM等水平的影响。结果发现,上皮标志CDH1表达降低,间质标志N-cadherin及VIM表达增高,而作为调控EMT的重要转录因子之一的SNAI2的表达也明显增加,提示H19可能通过调控SNAI2进而促进非小细胞肺癌A549细胞EMT及侵袭。
综上所述,在非小细胞肺癌细胞株A549中H19过表达可诱使其发生EMT,并促进其侵袭能力的升高,在H19过表达后EMT相关转录因子SNAI2的表达明显升高,提示SNAI2可能参与H19介导的EMT变化。但H19调控SNAI2的具体分子机制尚待阐明。本文提示H19可能参与非小细胞肺癌的发生、发展,为非小细胞肺癌的临床治疗提供了新的药物靶点及监测指标。
[1] PRENSNER J R, CHINNAIYAN A M. The emergence of lncRNAs in cancer biology[J]. Cancer Discov, 2011, 1(5): 391-407.
[2] CALIN G A, CROCE C M. MicroRNA-cancer connection: the beginning of a new tale[J]. Cancer Res, 2006, 66(15): 7390-7394.
[3] 季 青,李 琦. 长链非编码RNA在肿瘤发生、发展中的作用研究现状[J]. 中国癌症杂志, 2011, 21(3): 232-235.
[4] DOHERTY A S, MANN M R, TREMBLAY K D, et al. Differential effects of culture on imprinted H19 expression in the preimplantation mouse embryo[J]. Biol Reprod, 2000, 62(6): 1526-1535.
[5] YANG F, BI J, XUE X, et al. Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells[J]. FEBS J, 2012, 279(17): 3159-3165.
[6] LUO M, LI Z, WANG W, et al. Long non-coding RNA H19 increases bladder cancer metastasis by associating with EZH2 and inhibiting E-cadherin expression[J]. Cancer Lett, 2013, 333(2): 213-221.
[7] ZHANG L, YANG F, YUAN J H, et al. Epigenetic activation of the MiR-200 family contributes to H19-mediated metastasis suppression in hepatocellular carcinoma[J]. Carcinogenesis, 2013, 34(3): 577-586.
[8] 石永利, 吴鸿雁, 樊祥山, 等. 上皮-间叶转变相关蛋白在非小细胞肺癌中的表达及其预后意义[J]. 中国癌症杂志, 2011, 21(5): 342-347.
lncRNA-H19 induces epithelial-mesenchymal transition and enhances the invasion of non-small cell lung cancer cells
HUANG Shijun, YANG Jun, SUN Hui (Third Department of Surgery, People’s Hospital of Shayang County, Jinmen 448200, Hubei Province, China)
SUN Hui E-mail: 859338010@qq.com
Background and purpose:In recent years, the studies have indicated that long non-coding RNAs (lncRNAs) may play important roles in the initial stage and development of tumors. H19 is one of those lncRNAs, which is already proved to overexpress in a variety of tumors such as bladder cancer, stomach cancer and hepatocellular carcinoma (HCC). And H19 also could promote tumor proliferation and increase tumor cell migration and invasion ability, but neither the expression nor the function of H19 in non-small cell lung cancer(NSCLC) are clarified. This study aimed to observe the effects of H19 on the proliferation, epithelial-mesenchymal transition (EMT) and invasion ability of NSCLC cell line A549.Methods:H19 was overexpressed by plasmids transfection, then the effect of H19 on the proliferation of A549 was measured by cell counting kit-8(CCK-8), the invasion of A549 cells was detected by Transwell assay, and the changes of cell morphology were observed with an optical microscope, and the expression of EMT-related proteins was detected by Western blot, and the promoter activity of CDH1 was measured by luciferase assay.Results:The proliferation of A549 cells was increased under the overexpression of H19(D value in blank group was 1.64±0.02, in negative control group was 1.59±0.04, in overexpression of H19 group 1.89±0.02, P<0.05), the invasion ability of A549 cells was dramatically enhanced [negative control group (30±6)/vision, overexpression of H19 group (110±7)/vision, P<0.05], and the A549 cells developed longer pseudopodia and had wider intercellular spaces. All these morphology changes indicated that the cells were undergoing the process of EMT, and meantime, the expres-sion of CDH1 was decreased, along with the expression of VIM and SNAI2 elevated, which were also related to the progression of EMT, and H19 also could depress the promoter activity of CDH1 by 60% (P<0.05).Conclusion:The overexpression of H19 induces the EMT, and enhances the proliferation and invasion ability of A549 cells.
Long non-coding RNA; H19; Non-small cell lung cancer; Invasion; Epithelial-mesenchymal transition
10.3969/j.issn.1007-3969.2015.12.004
R734.2
A
1007-3639(2015)12-0940-05
2014-07-08
2015-02-08)
孙 辉 E-mail:859338010@qq.com
