亚实性肺结节在ⅠA期肺癌影像诊断中的价值
2015-01-04黄浩哲李国栋许立超李文涛王升平
黄浩哲,李国栋,许立超,李文涛,王升平
1. 复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
亚实性肺结节在ⅠA期肺癌影像诊断中的价值
黄浩哲1,李国栋1,许立超1,李文涛1,王升平2
1. 复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:亚实性肺结节(subsolid pulmonary nodule,SSPN)作为一种特征性而非特异性的肺部病灶与早期肺癌关系密切,为探讨其对ⅠA期肺癌的诊断价值,本研究将分析不同性质SSPNs的CT诊断及鉴别诊断要点。方法:收集2008年4月—2014年4月在复旦大学附属肿瘤医院行CT引导Hookwire定位下胸腔镜手术(video assisted thoracic surgery,VATS)治疗的405例孤立性肺结节(solitary pulmonary nodule,SPN)患者的临床及影像学资料。根据磨玻璃影(ground-glass opacity,GGO)成分含量将SPNs分为单纯型磨玻璃影(pure ground-glass opacity,pGGO)、混合型磨玻璃影(mixed ground-glass opacity,mGGO)和实性结节(solid nodule,SN)3组,并统计各组恶性率。根据术后病理结果,再将SSPNs分为ⅠA期肺癌组和良性组,分析对比影响SSPN良、恶性的影像学特征。结果:共纳入405例SPN患者,其中SSPNs有367例(包括124例pGGOs和243例mGGOs),且在ⅠA期肺癌中的发生率明显高于良性组[95.9%(257/268) vs 80.3%(110/137),P<0.001]。SSPN的总恶性率为70.0%(257/367),且mGGO的恶性率(72.0%)要高于pGGO(66.1%)和SN(28.9%)。恶性SSPN多发生于中年女性肺上叶,且病灶边界不清、边缘毛刺、分叶和胸膜凹陷征的发生率高于良性组(P<0.05)。结论:SSPN是肺癌的重要征象,且以mGGO的恶性倾向最高。若中年女性伴有肺上叶的SSPN,且病灶边界不清、边缘出现毛刺、分叶或胸膜凹陷时,应高度怀疑恶性。
亚实性肺结节;磨玻璃影;ⅠA期肺癌;影像诊断
肺癌是全球肿瘤致死的首要病因[1]。2010年数据显示,在我国,肺癌以19.59%的总发病率和24.87%的总死亡率占据首位[2]。虽然肺癌的5年生存率仅有15%,但Ⅰ期肺癌患者经胸腔镜手术(video assisted thoracic surgery,VATS)后的5年生存率可达到97%[3],所以早期肺癌的诊断显得至关重要。研究证实,亚实性肺结节(subsolid pulmonary nodule,SSPN)与早期肺癌的关系密切[4],并且随着低剂量螺旋CT的发展和普及,SSPN的检出率日益增高[5-6]。所以本研究将探讨SSPN在ⅠA期肺癌影像诊断中的价值,为早期肺癌的正确诊断提供依据。
1 资料和方法
1.1 患者资料
收集2008年4月—2014年4月在复旦大学附属肿瘤医院行CT引导Hookwire定位下VATS治疗的405例孤立性肺结节(solitary pulmonary nodule,SPN)患者的临床及影像学资料。SPN是指被肺组织包绕的单发类圆形,且最大直径≤3 cm的病灶[7]。本研究SPN入组标准:①胸部薄层CT显示单发结节;②SPN最大径≤3 cm且无淋巴结及远处转移,即符合国际抗癌联盟最新版ⅠA期肺癌标准(T1aN0M0和T1bN0M0);③术后病理诊断明确;④患者5年内无肺内或肺外恶性肿瘤史。所有患者或其法定代理人均签署知情同意书,本研究通过复旦大学附属肿瘤医院伦理委员会批准。
1.2 CT扫描方法
所有患者在术前进行全肺薄层CT扫描,不同型号的CT机(Philips brilliance 64和Siemens sensation 64)均采用1 mm的层厚,不可使用较厚的层厚扫描病灶,因为有些实性结节(solid nodule,SN)在较厚(如5 mm)层厚CT扫描时,常表现为SSPN[6];并在肺窗(WW 1 600 Hu,WL-600 Hu)和纵隔窗(WW 350 Hu,WL 35 Hu)下分别测量SSPN非实性和实性成分大小[8],同时评估病灶边缘征象以及内部结构。
1.3 阅片方法
由两位具有20年胸部影像诊断经验的放射科医师,采用盲法在患者术前1周内进行阅片诊断,并记录SPN的大小、部位、边缘征象(边界、毛刺、分叶、胸膜凹陷征及血管集束征)和内部征象(钙化和空洞)。若两位医师存在分歧,则由第三位高年资影像学医师对病灶进行评估。将所有SPN根据磨玻璃影(groundglass opacity,GGO)成分率公式[(DGGO−D)/ DGGO×100%[6-7],其中DGGO代表包含GGO在内的病灶最大径,D代表除去GGO成分的实性成分最大径]分为GGO≥90%,10%<GGO<90%和GGO≤10%共3组,分别代表单纯型磨玻璃影(pure ground-glass opacity,pGGO)、混合型磨玻璃影(mixed ground-glass opacity,mGGO)和实性结节(solid nodule,SN)。GGO是指局灶性密度增高影,其边界可清楚或不清,透过病灶可见支气管和血管纹理等肺实质结构[4]。pGGO是指密度浅淡的局部病灶区,内部见支气管或血管影,无实性成分,仅在肺窗下可见[9];而mGGO则同时包含了磨玻璃成分和实性成分,掩盖了支气管和血管纹理,实性部分在纵隔窗下可见[9];SSPN包括pGGO和mGGO[9](图1);SN是指由于肺组织间隙塌陷而覆盖了肺实质结构的病灶区[10];
1.4 统计学处理
采用SPSS 21.0 统计学软件进行统计分析,计量资料用±s 表示,进行t检验;计数资料用百分数表示,采用χ2检验;P<0.05为差异有统计学意义。
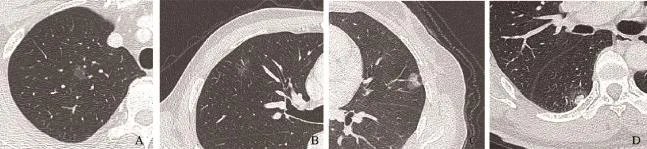
图1 SSPNs的影像学表现Fig. 1 Imaging features of SSPNs
2 结 果
2.1 pGGO、mGGO和SN的恶性率
本研究共纳入405例SPN患者,男性147例,女性258例,年龄23~80岁,平均年龄(53.9±10.8)岁,其中包括38例SN和367例SSPN,后者又包括124例pGGO和243例mGGO,共涵盖137例良性病变(包括38例炎性病变、29例肺组织纤维化、24例不典型增生、19例肉芽肿、17例错构瘤、5例增生淋巴结、4例硬化性血管瘤和1例平滑肌脂肪瘤)和268例ⅠA期肺癌(包括265例肺腺癌、2例神经内分泌癌和1例肺鳞癌)。SSPN、pGGO、mGGO、SN和SPN的恶性率见表1,SSPN和SN两组恶性率比较,差异有统计学意义(P<0.05),在SSPN中,mGGO组的恶性率最高。按不同最大径将mGGO分为≤2 cm和2~3 cm两组,分析病灶大小对mGGO恶性率的影响,证实2~3 cm的mGGO比≤2 cm的mGGO恶性率高(表2)。
2.2 不同分期ⅠA期肺癌pGGO和mGGO分布情况
将268例ⅠA期肺癌按不同分期分为最大径≤2 cm的T1aN0M0组和最大径2~3 cm的T1bN0M0组,统计得出两组分别有226例和42例SPN,其中SSPN各占95.6%(216/226)和97.6%(41/42),差异无统计学意义(P=0.85)。然而两组pGGO和mGGO分布差异有统计学意义(P=0.003),即T1aN0M0组以pGGO多见,而T1bN0M0组以mGGO多见。两组pGGO及mGGO分布情况见表3。
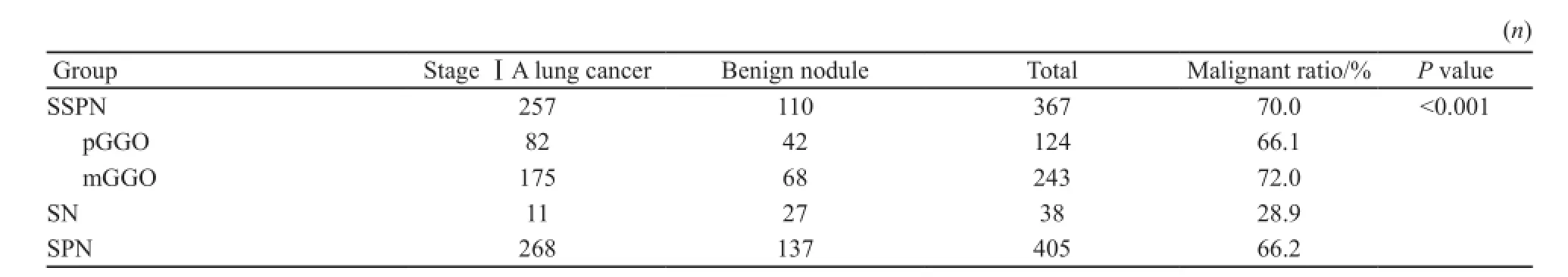
表1 pGGO、mGGO和SN的恶性率Tab. 1 Malignant ratios of pGGO, mGGO and SN lesions
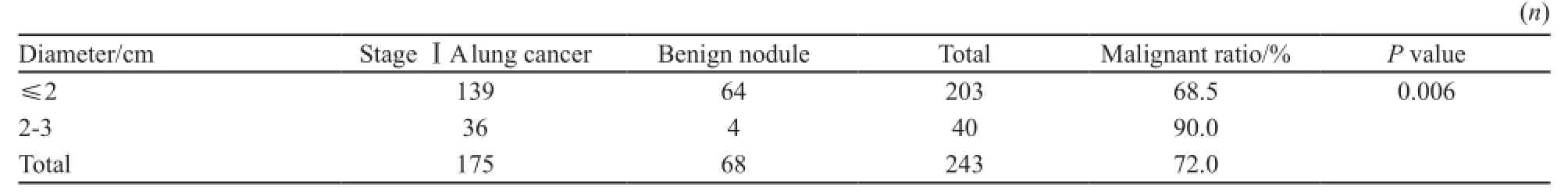
表2 不同直径mGGO的恶性率Tab. 2 Malignant ratios of different diameters of mGGO lesions
2.3 ⅠA期肺癌与良性病灶之间SSPN的比较
在C T表现为S S P N的病灶有3 6 7例(90.6%),其中ⅠA期肺癌257例,良性病灶110例。SSPN在ⅠA期肺癌中发生率高于良性病灶[95.9%(257/268) vs 80.3%(110/137),P<0.001]。表现为SSPN的ⅠA期肺癌和良性病变的患者,在年龄[(54.8±10.4)岁vs (51.6±11.4)岁,P=0.01]、性别[男/女:84/173 vs 48/62,P=0.045]以及病灶最大径[(13.37±6.1)mm vs (10.79±4.8)mm,P<0.001]方面差异有统计学意义。同时,通过对比两组病灶的CT影像学特征,研究发现ⅠA期肺癌组SSPN多发生于肺上叶,边界不清,多伴有毛刺征、分叶征以及胸膜凹陷征(P<0.05),而病灶内部钙化没有良性SSPN发生率高。两组间血管集束征和空洞的发生率差异无统计学意义(P>0.05),良、恶性SSPN影像学特征比较分析见表4。
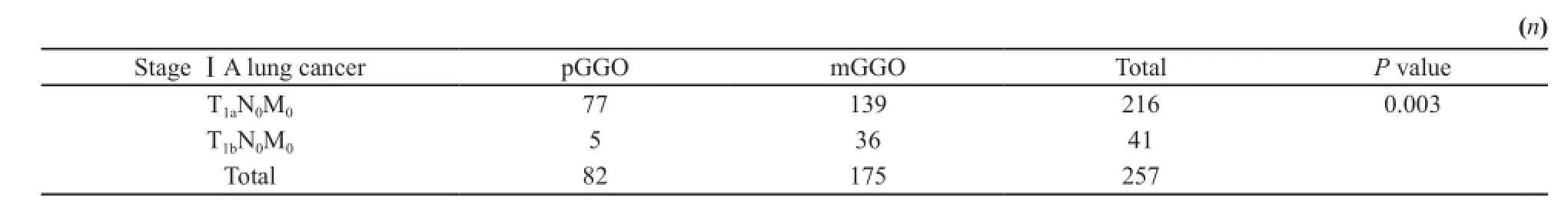
表3 不同分期ⅠA期肺癌pGGO及mGGO分布Tab. 3 Percentage diagnosis frequency of stage ⅠA lung cancer in pGGO and mGGO lesions
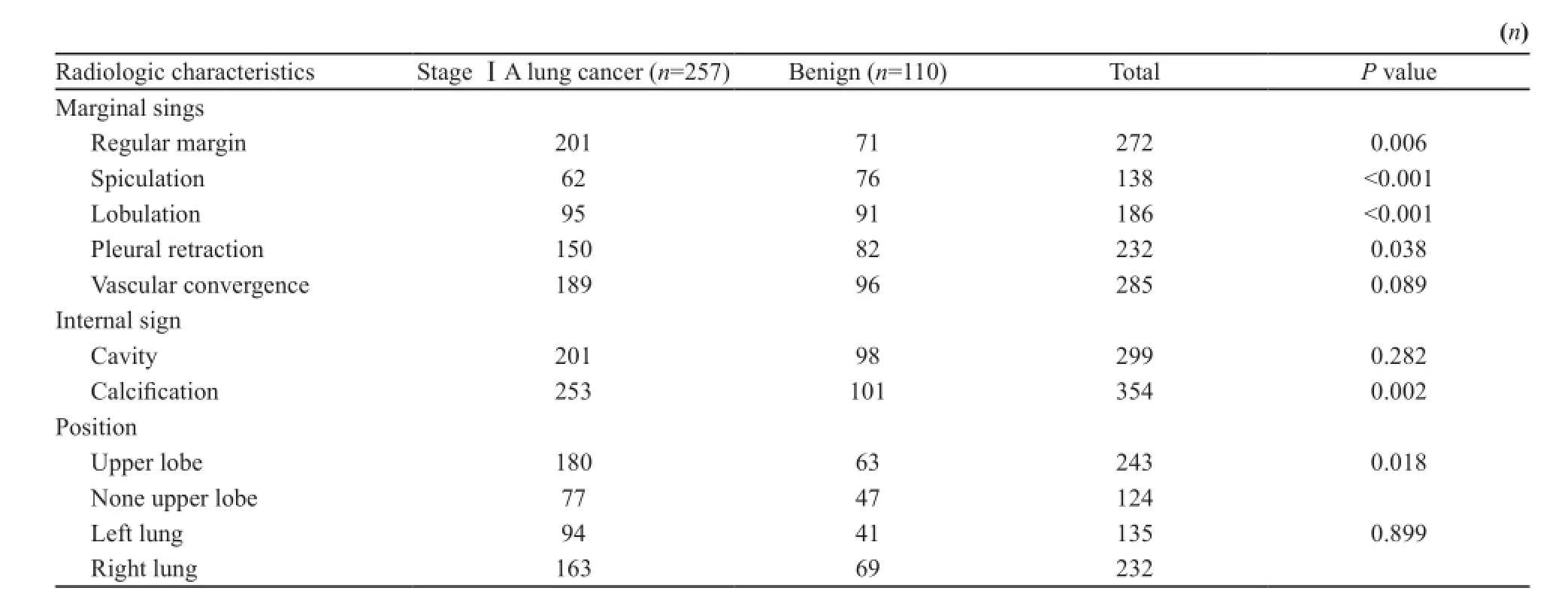
表4 良、恶性SSPN影像学特征比较Tab. 4 The comparison of imaging features in benign and malignant SSPN
3 讨 论
SSPN可以由肿瘤、炎性反应、不典型增生、肉芽肿、肺纤维化、淋巴结等[4,8,10]多种病理状态造成的肺泡含气量下降或肺泡不完全充填而形成,所以它是一种特征性而非特异性的影像学表现,其良、恶性的正确诊断,对于临床治疗决策以及患者的预后意义重大。
目前,CT是早期发现和早期诊断肺癌最有效的手段。研究证实,低剂量CT对肺癌(尤其是ⅠA期和ⅠB期肺癌)的检出率高于胸片,而且可降低55~74岁、既往或现在有吸烟史的高危患者约20%的肺癌致死率,明显优于胸片的6.7%[11-12]。在405例最大径≤3 cm SPN患者中,有90.6%的病灶表现为SSPN,恶性率为70.0%,在文献报道的60%~76%范围内[5,13];而剩余的SN恶性率仅为28.9%,明显低于SSPN的恶性率(P<0.001),与Lee等[14-15]所得的结论相符;而且,本研究同样证实了Henschke等[16]的结论,即mGGO的恶性率高于pGGO(72.1% vs 65.9%);不仅如此,我们又进一步将mGGO按大小分为≤2 cm和2~3 cm两组,结果发现直径2~3 cm的mGGO恶性率比直径≤2 cm的mGGO高(P=0.006),所以病灶大小也是影响SSPN良、恶性的重要因素[17]。
pGGO病理基础是病理组织沿肺泡壁伏壁生长,不伴有肺泡结构的破坏,肺泡含气充分。随着病理组织增多,肺泡逐渐塌陷,病灶逐渐演变为含实性成分的mGGO,因此,pGGO和mGGO其实是同一疾病在不同阶段的表现,所以在T1aN0M0时,病灶多表现为pGGO;而当病灶发展到T1bN0M0时,又以mGGO多见。而且大量研究表明,对于ⅠA期肺腺癌,测量实性成分与GGO成分比值非常重要,因为病灶中实性成分越多,病灶越可能为侵袭性腺癌,且预后越差;而GGO则成为患者预后良好的有利因素[6,18-19]。
本研究通过对比表现为SSPN的ⅠA期肺癌和良性病变的临床及影像学特征发现,ⅠA期肺癌患者的年龄比良性组略大,且以女性多见。在CT影像学特点上,ⅠA期肺癌的SSPN多位于肺上叶,边界多不清楚,边缘伴有毛刺征、呈分叶状,周围可见胸膜凹陷征,且上述征象的发生率均高于良性SSPN(P<0.05);而良性SSPN钙化的发生率比ⅠA期肺癌高(P=0.018)。在257例ⅠA期肺癌中,发现4例病灶有点状细小钙化,术后病理证实为实体型为主的浸润性腺癌;而在110例良性病变中,有9例病灶伴有钙化征象,包括7例错构瘤和2例肉芽肿性病变。有相关研究证实,结节钙化可作为判断肺结节良、恶性病变的独立的保护因素[20-21]。但近期也有研究发现,含有钙化的SPN也可能为恶性肿瘤[22-23]。良性病变(包括肺结核、错构瘤等)的钙化多表现为分层或爆米花样,以结节中央多见;而恶性结节钙化则多呈偏心性分布的砂砾状高密度影,但是在较小肺癌病灶内的发生率相对较低。
因此,若中年女性患者在肺上叶检查到SSPN,且病灶边界不清,伴有毛刺、分叶、胸膜凹陷征中的一种或几种征象,则提示恶性的可能性大,建议通过纤维支气管镜、肺穿刺活检或VATS等有创检查及时明确病理诊断。
虽然本研究得到的结论对鉴别良、恶性SSPN具有较高的准确性,但仍存在一定的局限性:样本量还不够大,所纳入的研究病种尚不够全面。因为本研究对象为在我院行CT引导下Hookwire定位后经VATS治疗的患者,存在一定的选择性偏倚。此外,没有充分利用其他临床资料。因此,如能进一步增加研究患者数,减少选择性偏倚,并结合患者其他临床资料,对良、恶性SSPN的判断将会更加准确。
[1] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 [J] . Int J Cancer, 2010, 127(12): 2893-2917.
[2] CHEN W, ZHANG S, ZENG H, et al. Report of incidence and mortality in China, 2010 [J] . China Cancer, 2014, 23(1): 1-10.
[3] KASEDA S, AOKI T, HANQAI N, et al. Better pulmonary function and prognosis with video-assisted thoracic surgery than with thoracotomy [J]. Ann Thorac Surg, 2000, 70(5): 1644-1646.
[4] WANG Y X, GONG J S, SUZUKI K, et al. Evidence based imaging strategies for solitary pulmonary nodule [J] . J Thorac Dis, 2014, 6(7): 872-887.
[5] LI F, SONE S, ABE H, et al. Malignant versus benign nodules at CT screening for lung cancer: comparison of thin-section CT findings[J] . Radiology, 2004, 233(3): 793-798.
[6] 陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23(1): 1-10.
[7] OST D, FEIN A M, FEINSILVER S H, et al. Clinical practice. The solitary pulmonary nodule[J]. N Engl J Med, 2003, 348(25): 2535-2542.
[8] NAIDICH D P, BANKIER A A, MACMAHON H, et al. Recommendations for the management of subsolid pulmonary nodules detected at CT: a statement from the Fleischner Society [J]. Radiology, 2013, 266(1): 304-317.
[9] GODOY M C, NAIDICH D P. Subsolid pulmonary nodules and the spectrum of peripheral adenocarcinoma of the lung: recommended interim guidelines for assessment and management [J]. Radiology, 2009, 253(3): 606-622.
[10] ORTA R, PAGANINI L, DAVIES K M, et al. Subsolid pulmonary nodules at multislice computed tomography: Characteristics and differential diagnosis with lung adenocarcinoma [J]. Revista Argentina Radiol, 2013, 77(2): 1-11.
[11] National Lung Screening Trial Research Team, ABERLE D R, BERG C D, et al. The national lung screening trial: overview and study design [J]. Radiology, 2011, 258(1): 243-253.
[12] National Lung Screening Trial Research Team, ABERLE D R, ADAMS A M, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening [J]. N Engl J Med, 2011, 365(5): 395-409.
[13] NAKATA M, SAEKI H, TAKATA I, et al. Focal ground-glass opacity detected by low-dose helical CT [J]. Chest, 2002, 121(5): 1464-14647.
[14] LEE H J, GOO J M, LEE C H, et al. Predictive CT findings of malignance in ground-glass nodules on thin-section chest CT: The effects on radiologist performance [J]. Eur Radiol, 2009, 19(3): 552-560.
[15] LEE S M, PARK C M, GOO J M, et al. Transient partsolid nodules detected at screening thin-section CT for lung cancer: comparison with persistent part-solid nodules [J]. Radiology, 2010, 255(1): 242-251.
[16] HENSCHKE C I, YANKELEVITZ D F, MIRTCHEVA R, et al. CT screening for lung cancer: frequency and significance of part-solid and nonsolid nodules [J]. AJR Am J Roentgenol, 2002, 178(5): 1053-1057.
[17] ORTA R, PAGANINI L, DAVIES K M, et al. Subsolid pulmonary nodules at multislice computed tomography: Characteristics and differential diagnosis with lung adenocarcinoma [J]. Revista Argentina Radiologia, 2013, 77(2): 107-117.
[18] VAZQUEZ M, CARTER D, BRAMBILLA E, et al. Solitary and multiple resected adenocarcinomas after CT screening for lung cancer: histopathologic features and their prognostic implications [J]. Lung Cancer, 2009, 64(2): 148-154.
[19] TSUTANI Y, MIYATA Y, NAKAYAMA H, et al. Prognostic significance of using solid versus whole tumor size on highresolution computed tomography for predicting pathologic malignant grade of tumors in clinical stage ⅠA lung adenocarcinoma: a multicenter study [J]. J Thorac Cardiovasc Surg, 2012, 143(3): 607-612.
[20] 杨德松, 李运, 姜冠潮, 等. 孤立性肺结节良恶性判断数学预测模型的临床验证及应用 [J]. 中华胸心血管外科杂志, 2012, 28(2): 82-85.
[21] 李运, 隋锡朝, 杨德松, 等. 孤立性肺结节的危险因素[J]. 中华胸心血管外科杂志, 2010, 26(3): 161-164.
[22] 秦卫. 孤立性肺结节的良恶性鉴别诊断进展[J]. 中国胸心血管外科临床杂志, 2011, 18(2): 153-156.
[23] HAEDERS S W, MADSEN H H, RASMUSSEN T R, et al. High resolution spiral CT for determining the malignant potential of solitary pulmonary nodules:refining and testing the test [J]. Acta Radiol, 2011, 52 (4): 401-409.
The value of subsolid pulmonary nodules in imaging diagnosis of stage ⅠA lung cancer
HUANG Haozhe1, LI Guodong1, XU Lichao1, LI Wentao1, WANG Shengping2(1.Department of Interventional Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Department of Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LI Wentao E-mail: liwentao98@126.com
Background and purpose:With characteristic but non-specific features, subsolid pulmonary nodules (SSPN) is closely associated with early lung cancer. This study aimed to estimate the imaging value of SSPN in stage ⅠA lung cancer, and summarized the radiological features of various SSPNs, retrospectively.Methods:The clinical data and imaging data of 405 patients with solitary pulmonary nodules (SPNs) from Apr. 2008 to Apr. 2014 at Fudan University Shanghai Cancer Center were collected. According to ground-glass opacity (GGO) proportion, SPNs were divided into 3 groups: pure ground-glass opacity (pGGO), mixed ground-glass opacity (mGGO) and solid nodule (SN). The malignant ratios were calculated based on the postoperatively pathological results. Besides, SSPNs were classifed into stage ⅠA lung cancer group and benign lesions group aiming at identifying the differentiating computed tomography (CT) features.Results:Of the enrolled 405 SPN patients, there were 367 SSPNs (including 124 pGGOs and 243 mGGOs) whose incidence in stage ⅠA lung cancer group was signifcantly higher than those in benign group [95.9% (257/268) vs 80.3% (110/137), P<0.001]. The total malignant ratio of SSPN was 70.0% (257/367), mGGO had a higher malignant ratio (72.0%) than those of pGGO (66.1%) and SN (28.9%). The malignant SSPNs were frequentlydetected in upper lobe of middle-aged women with a higher incidence of irregular edge, spiculation, lobulation and pleural retraction than benign group (P<0.05).Conclusion:SSPN is one of the signifcantly malignant indicators, and mGGO has the highest malignant tendency. Senility, female, irregular edge, spiculation, lobulation, pleural retraction and pulmonary upper lobe distribution are demonstrated the signifcant discriminators from benign lesions.
Subsolid nodule; Ground-glass opacity; Stage ⅠA lung cancer; Imaging diagnosis
10.3969/j.issn.1007-3969.2015.03.007
R734.2
A
1007-3639(2015)03-0199-06
2014-09-05
2015-02-06)
上海申康医院发展中心局级课题(SHDC12012112);上海市科委课题(KW1231)。
李文涛 E-mail:liwentao98@126.com
