人慢性粒细胞白血病bcr-abl基因反义寡核苷酸对K562细胞株的凋亡诱导作用研究
2015-01-04平娟赵娜王保全申智慧阴明星庞晓斌陈传波
平娟,赵娜,王保全,申智慧,阴明星,庞晓斌,陈传波
1.河南大学淮河临床学院,河南 开封475001;
2.郑州大学附属肿瘤医院血液科,河南 郑州 450009;
3.河南大学药学院化学生物学实验室,河南 开封 475004
人慢性粒细胞白血病bcr-abl基因反义寡核苷酸对K562细胞株的凋亡诱导作用研究
平娟1,赵娜2,王保全1,申智慧2,阴明星2,庞晓斌3,陈传波1
1.河南大学淮河临床学院,河南 开封475001;
2.郑州大学附属肿瘤医院血液科,河南 郑州 450009;
3.河南大学药学院化学生物学实验室,河南 开封 475004
背景与目的:随着人类基因组计划的完成,人们的研究重点已转向基因功能的研究,反义核酸技术无疑为这项宏伟工程提供了一个新的发展方向。目前,国内关于反义寡核苷酸诱导K562细胞凋亡的实验研究很少。本实验在体外构建针对人慢性粒细胞白血病(chronic myelogenou leukemia,CML)bcr-abl融合基因mRNA的反义寡核苷酸,探讨bcr-abl反义寡核苷酸对K562细胞凋亡的诱导作用。方法:以bcr-abl融合基因mRNA翻译起始点融合前区19个寡核苷酸为作用靶点,设计反义寡核苷酸,以其反义寡核苷酸序列转染人慢性粒细胞K562细胞,采用Hoechst染色法观察不同浓度寡核苷酸对K562细胞株的凋亡情况,采用蛋白[质]印迹法(Western blot)检测自噬凋亡蛋白LC3-Ⅱ的表达情况,采用流式细胞术(flow cytometry,FCM)检测细胞周期变化,采用JEM-4000EX电镜术检测细胞凋亡形态变化,通过DNA琼脂糖凝胶电泳检测K562细胞凋亡情况。结果:Hoechst染色结果显示,bcr-abl反义寡核苷酸能显著促进K562细胞的凋亡,且呈现一定的浓度依赖性。Western blot检测结果显示,bcr-abl反义寡核苷酸各浓度组凋亡自噬蛋白LC3-Ⅱ表达水平明显高于对照组,差异有统计学意义(P<0.05)。FCM检测结果显示,bcr-abl反义寡核苷酸作用于K562细胞后,细胞周期阻滞于G0/G1期。各组G0/G1期、S期细胞数量与对照组相比,差异有统计学意义(P<0.05)。在JEM-4000EX电镜下可见明显的新月型凋亡小体。DNA琼脂糖凝胶电泳显示,10、30 µmol/mL bcr-abl反义寡核苷酸组可以明显观察到以180~200 bp碱基对整倍数出现明暗间隔的DNA梯状条带。结论:Bcr-abl反义寡核苷酸可显著诱导K562细胞凋亡,为临床上基因治疗人CML提供一定的参考。
人慢性粒细胞白血病;Bcr-abl基因;反义寡核苷酸;K562细胞;凋亡诱导
慢性粒细胞白血病(chronic myelogenou leukemia,CML)是特征性bcr-abl融合基因分子生物学遗传异常行为,其编码的bcr-abl融合蛋白可持续诱导多条细胞信号转导通路的异常激活,最终导致CML的发生[1-2],由于CML特定的分子遗传学特征,是理想的分子靶向治疗模型。目前临床上有很多治疗CML的药物及方法,如酪氨酸激酶抑制剂可诱导90%以上患者血液学完全缓解,但部分患者会出现耐药,第二代酪氨酸激酶抑制剂(如达沙替尼和尼洛替尼等)虽然能抑制大部分激酶活性,但对个别激酶突变体无效,造血干细胞移植虽然是目前唯一彻底治愈CML的主要手段,但大多数患者并不适用,主要原因是缺乏合适的供体[3-4]。因此,寻找治疗CML的新方法成为医学工作者面临的新课题。
反义核酸技术是近年发展起来的一项新技术。反义寡核苷酸是一段与靶基因的某段序列互补的天然存在或人工合成的核苷酸序列,可以通过碱基配对与细胞内核苷酸特异性结合形成杂交分子,从而在转录和翻译水平上调节靶基因的表达,具有合成方便、序列设计简单、容易修饰、选择性高和亲和力强等优点,绝大多数DNA由2条碱基序列互补的单链组成,生物信息以核苷酸不同顺序编码在DNA链上,基因组形成单顺反子结构,在DNA双链上被转录为RNA的称为正义链,其对应的是反义链,精心设计一段与正义链互补,一般由7~40个核苷酸组成的反义链,将会阻断基因转录,将含有反义序列的载体导入细胞内,可干扰特定基因的表达[5-6]。本实验利用这一原理,在基因位点、前体mRNA、mRNA和蛋白水平上,通过干扰特定基因功能来限制细胞增殖、分化和凋亡,取得了很好的实验效果。因此,反义核酸技术未来可能会成为一个新的治疗CML的新方向。
1 材料和方法
1.1 材料与仪器
K562细胞系购自中国医学科学院细胞库,DMEM培养基购自美国Gibco公司,胎牛血清购自美国Invitrogen公司,RPMI-1640培养基购自美国Hyclone公司,DNA-Ladder试剂盒和琼脂糖购自生工生物工程(上海)股份有限公司,PCR仪购自美国BioRad公司,JEM-4000EX透射电子显微镜和紫外光分光光度计购自日本岛津公司,流式细胞仪购自北京卓川电子科技有限公司,兔抗人LC3-Ⅱ抗体购自美国GeneTex公司,辣根过氧化物酶标记的羊抗兔二抗购自美国Pierce公司,阳离子脂质体购自美国Gibco公司。bcrabl反义寡核苷酸包括:5’-AAGCGAGUUCAA AAGCCCUUCAGCGGCCAGUA-3’[采用针对bcr-abl融合基因mRNA翻译起始点的反义寡核苷酸,选择bcr-abl融合基因mRNA融合区域前19个寡核苷酸为作用靶点,委托生工生物工程(上海)股份有限公司合成],5’-AATTAAAAAATTCGT CTCAAGTTTTCGGGTCTCTTGAATTCCCGAAAA CTTGAGACGGGC-3’[无义寡核苷酸序列,由生工生物工程(上海)股份有限公司合成],上述寡聚物均为全硫代修饰。
1.2 方法
1.2.1 细胞培养
将K562细胞株用含10%的胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI-1640培养基,置于37 ℃、CO2体积分数为5%、饱和湿度的条件下培养,1~2 d换液1次,每隔2~3 d按1∶4传代1次,收集对数期生长的细胞。
1.2.2 阳离子脂质体转染K562细胞
分别将浓度为1 0、1 5、2 0、2 5和30 µmol/mL的有义和无义寡核苷酸与5~30 µL脂质体转染试剂混合于2 mL的无血清的RPMI-1640培养液中,各接种2×107个细胞,培养过夜,充分转染后加入胎牛血清,调整终浓度至10%,继续培养24~48 h后进行相关指标检测。
1.2.3 采用Hoechst33342染色法观察K562细胞凋亡形态
取对数生长期细胞,以1×106个细胞/孔,每孔体积3 mL,接种于6孔板,分别用10、15、20、25和30 µmol/mL的bcr-abl反义寡核苷酸培养,并设空白对照组,48 h后加入Hoechst33342,使其终浓度为10 mg/mL,培养箱内继续温育30 min后收集细胞,避光,PBS洗涤后以4%甲醛固定,调整细胞浓度为2× 108个/L,将细胞悬液滴于载玻片,加盖盖玻片,稍干后在紫外荧光显微镜下观察,正常活细胞体积较大、形态完整、染色均一、蓝色荧光相对较弱,凋亡细胞体积变小、核固缩、核裂解、形状不规则、荧光强度增强,每个样品计数200个细胞,计算凋亡细胞百分比。
1.2.4 采用蛋白[质]印迹法(Western blot)检测自噬相关蛋白的表达
取对数生长期细胞,培养2 4 h后,448×g离心收集细胞,加入细胞裂解液,冰水浴1 h,离心后收集上清液,考马斯亮蓝法测定各组细胞质总蛋白,经琼脂糖凝胶电泳处理后,湿转至醋酸纤维素薄膜,以BSA封闭2~3 h,然后加入1∶200稀释的兔抗人LC3-Ⅱ,4 ℃温育过夜,以pH为7.6的PBS缓冲液洗涤4~6次,每次5 min,然后加入1∶200稀释的HRP标记二抗于37 ℃放置2 h,DAB显色试剂盒显色,拍照记录,以β-actin为内参,采用凝胶成像系统测定各条带积分光密度值。
1.2.5 采用流式细胞术(flow cytometry,FCM)检测细胞周期
取对数生长期的细胞,以1×106个/mL接种于6孔板,实验组加入浓度为20、25和30 µmol/mL的寡核苷酸复合物,对照组加入等体积的0.9%的NaCl溶液,24 h后终止培养,收集细胞,用75%的冷乙醇(用PBS配制)4 ℃固定过夜,PBS洗涤4~5次后,112×g离心10 min,加入400 µL Annexin-FITC(5 μg/mL),于4 ℃避光染色30 min,然后再加500 μL的PI (4 μg/mL)工作液,混匀,室温放置10 min,采用FCM分析DNA及细胞周期的变化。
1.2.6 通过DNA琼脂糖凝胶电泳检测K562细胞凋亡
收集药物处理24 h后的各浓度组细胞,加细胞裂解液(10 mmol/L Tris-HCl,10 mmo/L EDTA,10 mmol/L NaCl,0.5% SDS,0.5 mg/mL的蛋白酶K)消化细胞,用饱和酚抽提后,加2.5倍体积的无水乙醇沉淀DNA,TE缓冲液溶解DNA,行1.5%琼脂糖凝胶电泳。
1.2.7 使用JEM-4000EX透射电子显微镜观察K562细胞形态
以bcr-abl反义寡核苷酸3个不同浓度(10、20和30 µmol/mL)作用于K562细胞48 h后,分别制备成超薄切片,在JEM-4000EX透射电子显微镜下观察细胞超细微结构及凋亡小体。
1.3 统计学处理
所有数据均采用SPSS 15.0统计软件进行分析,统计学推断采用单因素方差分析,实验数据经方差齐性分析及正态性检验结果显示,实验数据方差齐且符合正态性检验,所有数据均用方差分析统计,P<0.05为差异有统计学意义。
2 结 果
2.1 K562细胞凋亡的形态学变化情况
不同浓度的bcr-abl反义寡核苷酸作用K562细胞后在紫外荧光显微镜下观察其形态学改变,对照组细胞形态大小基本一致,细胞呈圆形、光亮,而经30 µmol/mL的bcr-abl反义寡核苷酸干预48 h后细胞总数明显减少,细胞大小形态不一,体积皱缩缩小,细胞质浓缩致密,随着反义寡核苷酸浓度的增加,凝集染色荧光强度增强(图1、2)。
2.2 自噬相关蛋白的表达情况
LC3-Ⅱ蛋白是目前发现的唯一定位在自噬体和自噬体溶酶体膜上的蛋白质,被认为是比较特异的自噬诊断指标。当细胞发生自噬时,LC3-Ⅰ经泛素加工修饰过程,形成LC3-Ⅱ,其含量和自噬泡的数量成正比。Western blot检测结果显示,作用48 h后,bcr-abl反义寡核苷酸各浓度组的K562细胞LC3-Ⅱ蛋白均出现不同程度的表达,出现了LC3-Ⅱ蛋白阳性表达,并且随着药物浓度的增高,蛋白条带逐渐增加和增粗(图3)。
2.3 K562细胞周期动力学检测结果
FCM检测结果显示,不同浓度的bcr-abl反义寡核苷酸作用于K562细胞后,K562细胞周期分布发生了明显变化,随着药物浓度的增加,G0/G1期细胞比例逐渐增加,S期细胞明显减少,G2/M期细胞增多,并且各药物组G0/G1期和S期细胞与对照组相比,差异有统计学意义(P<0.05,表1)。提示bcr-abl反义寡核苷酸通过阻滞K562细胞G0/G1期,从而抑制细胞的生长增殖。

图1 不同浓度bcr-abl反义寡核苷酸复合物对K562细胞生长的影响Fig. 1 The effect of different concentrations of bcr-abl antisense oligonucleotides on K562 cells

图2 不同浓度bcr-abl反义寡核苷酸复合物对K562细胞凋亡促进作用Fig. 2 The effect of different concentrations of bcr-abl antisense oligonucleotides on the apoptosis of K562 cells
2.4 DNA琼脂糖凝胶电泳检测的K562细胞凋亡情况
DNA琼脂糖凝胶电泳结果显示,不同浓度的bcr-abl反义寡核苷酸作用于K562细胞48 h后,10和30 µmol/mL浓度组可以明显的看到以180~200 bp碱基对整倍数出现明暗间隔的DNA梯状条带,而对照组无此现象,呈单一条带,说明K562细胞形态完整,提示在实验浓度范围内,CML的K562细胞发生细胞凋亡(图4)。
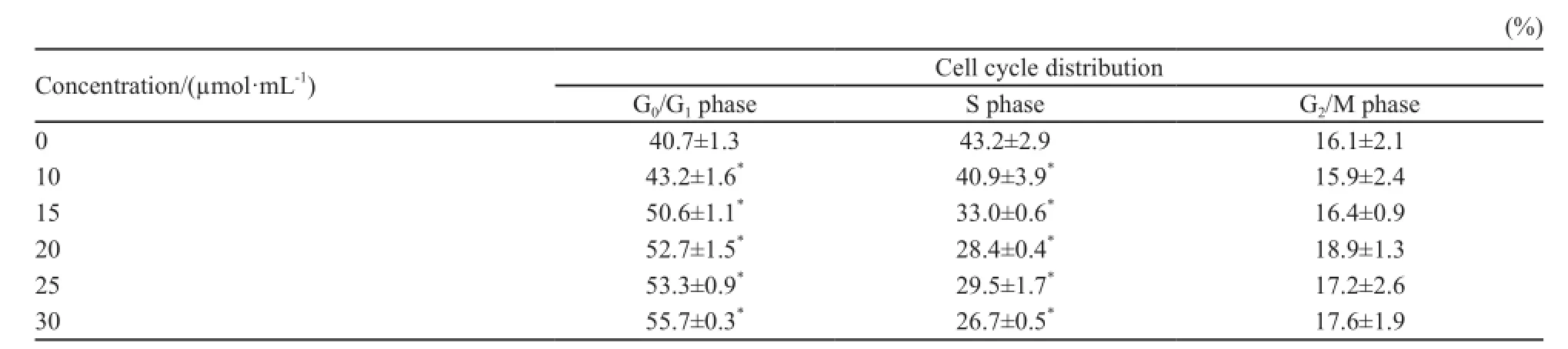
表1 流式细胞术检测不同浓度的bcr-abl反义寡核苷酸对K562细胞周期的影响Tab. 1 The influence of different concentrations of bcr-abl antisense oligonucleotides on the cell cycle of K562 cells by FCM

图3 Western blot检测自噬相关蛋白LC3-Ⅱ蛋白表达Fig. 3 The analysis of LC3-Ⅱ protein expression by Western blot method
2.5 K562细胞形态学观察
正常细胞在JEM-4000EX透射电子显微镜下呈圆形或椭圆形,常染色质丰富,分布均匀,细胞核较大,呈圆形或长杆型,细胞膜完整,细胞质内细胞器结构清楚,而bcr-abl反义寡核苷酸低浓度组(10 µmol/mL)的细胞体积缩小,细胞膜完整,但细胞质变少,细胞器结构不清楚,细胞核内染色质开始分散并凝聚成簇,有些染色质已经出现边聚等早期凋亡现象,随着药物浓度的增加(20和30 µmol/mL)和作用时间的延长,细胞膜出现破裂,细胞器结构不清楚或边界不完整,染色质凝聚、边集现象更突出,凋亡细胞增多,凋亡特征更明显,并可见典型的新月型凋亡小体(图5)。
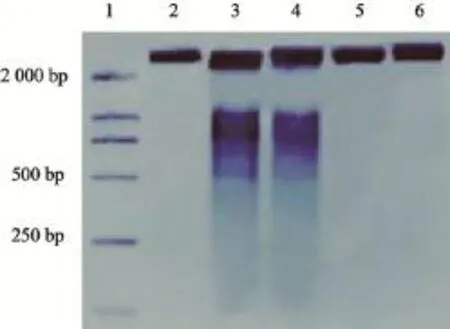
图4 各组K562细胞的DNA琼脂糖凝胶电泳图Fig. 4 The DNA agarose gel electrophoresis of K562 cells

图5 K562细胞JEM-4000EX透射电子显微镜图Fig. 5 The JEM-4000EX electron microscopy of K562 cells
3 讨 论
目前关于CML的治疗临床上大多采用传统的姑息治疗和近年来发展起来的分子靶向治疗、干细胞移植及放化疗措施[7-8]。传统的姑息治疗主要以马利兰和羟基脲等为基础的治疗药物,可诱导血液学缓解,但是其控制细胞遗传学的作用极其有限。近年来,随着肿瘤分子生物学的研究进展,肿瘤药物的治疗逐渐向开发新的、特定的针对肿瘤细胞分子生物学等方面倾斜,伊马替尼、尼洛替尼等药物是新开发的抗肿瘤药物,临床上治疗效果十分显著,但长期应用会有不少患者出现耐受性。CML是一种发生在造血干细胞上以粒细胞慢性增殖为主要特征的恶性克隆性疾病,其特点是产生大量不成熟的白细胞,这些细胞在骨髓内聚集,抑制骨髓的造血功能,并且能通过血液在全身扩散,导致患者出现贫血、容易出血、感染及器官浸润等症状。长期以来,该病一直成为困扰医学工作者的一个难题[9-10]。因此,探讨有效预防和治疗CML的新策略,是目前CML研究的关键课题。
当前国内、外大量研究证实[11-12],从95%的CML患者骨髓和外周血细胞中都可以找到ph染色体,即特征性的染色体异位t(9;22)、(q34;q11)及融合基因bcr-abl,融合基因表达bcr-abl融合蛋白,该蛋白能激活酪氨酸激酶的活性,和CML的发病密切相关,本研究以脂质体为载体,用bcr-abl反义寡核苷酸体外转染人CML的K562细胞,取得了很好的实验效果,Hoechst33342染色结果显示,30 μmol/mL反义核酸作用48 h后,可明显促进CML的K562细胞凋亡,Western blot检测结果显示,LC3-Ⅱ蛋白表达呈现阳性,并且随着反义核酸浓度的增加,蛋白条带逐渐增加,其蛋白含量差异和对照组相比,差异有统计学意义。FCM检测结果显示,bcr-abl反义寡核苷酸组能使K562细胞阻滞在G0/G1期。DNA琼脂糖凝胶电泳显示,在实验浓度范围内,CML的K562细胞发生细胞凋亡。但反义核酸技术作为一项新技术仍有很多不足之处,主要表现在基因导入系统技术、基因表达的可控性和更多的好的治疗基因3个方面。另外,大量反义寡核苷酸的制备、体内代谢和不良反应等也需要临床医学工作者的进一步研究[13]。
[1] 王兴丽, 杨文华, 史哲新. 慢性粒细胞白血病分子靶向治疗研究进展[J]. 浙江中西医结合杂志, 2012, 22(3): 46-51.
[2] 陈波斌, 林果为. 慢性粒细胞白血病的发病机制和分子靶向治疗的研究进展[J]. 国外医学: 输血及血液学分册, 2004, 27(3): 239-243.
[3] 李娟, 陆莉, 蒲育栋. BCR-ABL探针在慢性粒细胞白血病中的应用[J]. 中国优生与遗传杂志, 2009, 17(12): 33-37.
[4] 干定云, 陈燕. 慢性粒细胞白血病分子靶向治疗的新进展[J]. 临床血液学杂志, 2006, 19(3): 190-192.
[5] 沈君, 王开泰, 陆红娟. 慢性粒细胞白血病的诊断与治疗[J]. 中国实用内科学杂志, 2008, 28(1): 203-206.
[6] 王莎, 柴玉波, 刘飞. Bcr-abl融合基因特异性siRNA对K562细胞生物学特性的影响[J]. 中华医学杂志, 2005, 85(3): 198-202.
[7] 蒙渡, 张梅. 慢性粒细胞白血病的治疗新进展[J]. 现代肿瘤医学, 2006, 14(7): 905-907.
[8] 魏慧. 慢性粒细胞白血病的诊断和治疗进展[J]. 长江大学学报, 2011, 8(8): 225-231.
[9] DEINIGER M W, GOLDMAN J M, MELO J V, et al. The molecular biology of chronic myeloid leukemia[J]. Blood, 2010, 96(3): 343-356.
[10] CORTS J E, JONES D, O’BRIEN S, et al. Results of dasatinib therapy in patiens with early chronic-phase chronic myloid leukemia[J]. J Chinoncol, 2010, 28(3): 398-404.
[11] LUCAS C M, WANG L, AUSTIN G M, et al. A populations stufy of imatinibin chronic myeloid leukemia demonstrates lower efficacy than in clinical trials[J]. Leukemia, 2008, 22(10): 1963-1966.
[12] SAUSSELS S, LAUSEKER M, GRATWOHL A, et al. Allogenetic hematopoietic stem cell transplantation for chronic myeloid leukemia in the imatinib era: evaluation of its impact with in a sub group of randomized German CML study Ⅳ[J]. Blood, 2010, 115(10): 1880-1885.
[13] GARCIA-MANERO G, FADER1 S, O BRIEN S, et al. Chronic myelogenous leukemia: a review and update of therapeutic strategies[J]. Cancer, 2003, 98(3): 437-457.
The apoptosis induction on K562 cells by the CML bcr-abl gene antisense oligonucleotides
PING Juan1, ZHAO Na1, WANG Baoquan1, SHEN Zhihui2, YIN Mingxing2, PANG Xiaobin3, CHEN Chuanbo1(1.The Huaihe Clinical College of Henan University, Kaifeng Henan 475001, China; 2.Department of Hamatology, the Cancer Hospital Affliated to Zhengzhou University, Zhengzhou Henan 450009, China; 3.The Chemical Biology Laboratory, College of Pharmacy, Henan University, Kaifeng Henan 475004, China)
CHEN Chuanbo E-mail: chenchuanbo@henan.edu.cn
Background and purpose:As the development of the completion of the human genome project (HGP), the research focus is turning to the gene function research. At present, the domestic experimental research on the apoptosis of K562 cells induced by antisense olignonucleotides is rare. This study was aimed to investigate the effect of human chronic myelogenou leukemia (CML) bcr-abl fusion gene antisense oligonucletides on autophagy and apoptosis of CMLK562 cells in vitro.Methods:By liposome as the carrier, K562 cells were transfected with the bcr-abl gene antisense olignonucleotides. Hoechst staining method was used to observe the apoptosis inducing effect of differentconcentrations of oligonucleotides, the expressions of LC3-Ⅱ, autophagy-related protein, were determined by the Western blot method, the cell cycles were determined by fow cytometry (FCM), and JEM-4000EX electron microscope technology was used to detect the apoptosis morphological changes. The apoptosis was detected by DNA agarose gel electrophoresis.Results:Hoechst staining results showed that the bcr-abl gene antisense oligonucletides signifcantly promoted the apoptosis of K562 cells in a certain concentration dependent manner. Western blot showed that the expression level of LC3-Ⅱ was obviously higher in bcr-abl gene antisense oligonucletides transfected group than the control group, showing a promoting effect on cell autophagy. FCM test results showed that bcr-abl gene antisense oligonucleotides transfected K562 cells showed obvious cell cycle arrest, visible obvious apoptosis morphology under the electron microscope, and DNA Ladder showed obvious apoptosis fragments.Conclusion:The bcr-abl gene antisense olignonucleotides can signifcantly induce the cell apoptosis of K562. This study provides a new method for CML therapy.
Chronic myelogenou leukemia; Bcr-abl gene; Antisense oligonucleotides; K562 cells; Apoptosis induction
10.3969/j.issn.1007-3969.2015.03.002
R733.7
A
1007-3639(2015)03-0167-06
2014-09-10
2014-11-17)
河南开封市科技局项目(1403018);国家自然科学基金项目(81273652)。
陈传波 E-mail:chenchuanbo@henan.edu.cn
