颗粒蛋白前体调控胃癌细胞增殖与衰老的效应研究
2015-01-04李媛媛王红艳吴晓燕宋瑞卉李敬
李媛媛,王红艳,吴晓燕,宋瑞卉,李敬
1.潍坊医学院形态学实验室,山东 潍坊261053;
2.潍坊医学院病原生物学教研室,山东 潍坊261053;
3.山东省高校免疫学重点实验室,山东 潍坊261053;
4.潍坊医学院基础医学院,山东 潍坊261053
颗粒蛋白前体调控胃癌细胞增殖与衰老的效应研究
李媛媛1,王红艳2,3,吴晓燕2,宋瑞卉1,李敬4
1.潍坊医学院形态学实验室,山东 潍坊261053;
2.潍坊医学院病原生物学教研室,山东 潍坊261053;
3.山东省高校免疫学重点实验室,山东 潍坊261053;
4.潍坊医学院基础医学院,山东 潍坊261053
背景与目的:颗粒蛋白前体(progranulin,PGRN)是一种新型生长因子,在细胞迁移、细胞周期进展及肿瘤形成过程中发挥着重要作用。PGRN在多种恶性肿瘤细胞中高表达,不仅参与肿瘤的生长过程,还与肿瘤的发生、演变过程关系密切。本研究旨在探讨PGRN在胃癌组织中的表达,及其对胃癌BGC823细胞增殖与衰老的影响。方法:利用免疫组化方法检测胃癌组织及癌旁组织中PGRN的表达;利用实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)干扰胃癌细胞株BGC823中PGRN的表达;通过四甲基偶氮唑盐(MTT)法、细胞克隆形成和细胞衰老检测实验,探讨PGRN对BGC823细胞增殖与衰老的影响。结果:PGRN在胃癌组织中高表达。PGRN表达降低后,胃癌细胞的增殖与克隆形成能力均显著降低。PGRN-siRNA细胞的克隆形成率为(25.3±3.1)%,对照组细胞的克隆形成率为(72.1±5.7)%,正常组细胞的克隆形成率为(80.3±4.0)%。两两比较,对照组与正常组间差异无统计学意义(P>0.05),实验组与其他两组间差异均有统计学意义(P均<0.05)。干扰PGRN表达能够明显促进BGC823细胞衰老。PGRN-siRNA细胞衰老阳性率为(27.6±2.1)%,对照组细胞衰老阳性率为(3.2±1.3)%,正常组细胞衰老阳性率为(1.9±1.2)%。两两比较,对照组与正常组间差异无统计学意义(P>0.05),实验组与其他两组间差异均有统计学意义(P均<0.05)。结论:PGRN可作为新的胃癌标志物,为临床胃癌的靶向治疗提供新的思路。
胃肿瘤;颗粒蛋白前体;siRNA;细胞衰老
胃癌是严重危害人类健康的常见恶性肿瘤,发病率高且预后差。近年来随着人们对恶性肿瘤病因及发病机制等方面的研究,胃癌和其他恶性肿瘤一样被认为是一种基因性疾病,胃癌的发生、演变与多种癌基因的异常表达有关[1-2]。因此,研究胃癌相关基因对于揭示胃癌的发病机制与探讨有效的防治方法具有重要意义。
颗粒蛋白前体(progranulin,PGRN)是一种独立的、新型生长因子,在体内大部分组织和器官中表达,对调节机体的生长发育及修复损伤等过程起着重要作用。目前,多项研究表明,PGRN在多种恶性肿瘤中高表达,如宫颈癌、乳腺癌和胶质母细胞瘤等[3-5]。在动物实验中,通过降低PGRN mRNA的表达可以明显降低肿瘤形成的风险[6],然而关于PGRN在胃癌中的表达及生物学意义鲜有报道。
细胞衰老是指细胞处于不可逆的周期停滞状态,但在相当长一段时间内依然保持代谢活性,典型特征是β-半乳糖苷酶染色呈阳性。本研究通过检测PGRN在胃癌组织中的表达及对胃癌细胞增殖与衰老的影响,为胃癌的临床靶向治疗提供新的实验依据。
1 材料和方法
1.1 临床资料
临床标本取自潍坊医学院附属医院经外科手术切除的胃癌及癌旁组织各50例,标本均经病理确诊。
1.2 材料和试剂
山羊抗人PGRN单克隆抗体购自美国Santa Cruz公司;细胞转染试剂LipofectimineTM2000购自美国Invitrogen公司;实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测试剂盒购自立陶宛Fermentas公司,PCR试剂购自宝生物工程(大连)有限公司,衰老检测试剂盒购自上海碧云天生物技术有限公司,RPMI-1640培养基、胎牛血清等细胞培养产品购自美国Gibco公司。PGRN siRNA序列5’-r(GGCCACUCCUGCAUCUUUA)dTdT-3’及对照组siRNA序列由上海吉玛制药技术有限公司合成。PGRN引物顺义链:5’-GGACAGTACTGAAGACTCTG-3’;反义链:5’-GGATGGCAGCTTGTAATGTG-3’。内参β-actin引物顺义链:5’-AGTTGCGTTACACCCTTTCTTG-3’;反义链:5’-CACCTTCACCGTTCCAGTTTT-3’。所有引物均由生工生物工程(上海)股份有限公司合成。
1.3 方法
1.3.1 免疫组化
胃癌及癌旁组织标本经固定、脱水、透明、包埋处理后切片,按照PGRN检测试剂盒说明书,采用山羊超敏二步法进行免疫组化染色,PBS替代一抗作为阴性对照,DAB显色,苏木素复染,脱水,透明,封片。结果判断:以细胞质中出现棕黄色颗粒为PGRN阳性表达,高倍镜下每张切片随机选取10个视野,计数PGRN阳性细胞数,根据其平均数求PGRN阳性表达率。
1.3.2 细胞培养
人胃癌细胞株BGC823置于37 ℃、CO2体积分数为5%的恒温培养箱中常规培养;培养基为含10%胎牛血清的改良型RPMI-1640。
1.3.3 siRNA转染[7]及转染细胞株的建立
选取对数生长期细胞,经胰酶消化,接种于6孔细胞培养板中,每孔细胞数为1×105个,当细胞融合度达50%时开始转染。步骤如下:每孔取5 μL siRNA溶于250 μL OPTI-MEM中,混匀常温放置5 min;取5 μL LipofectamineTM2000溶于250 μL OPTI-MEM中,混匀常温放置5 min;然后将两种混合液混匀,常温放置15 min,加入培养板,转染后置于培养箱中常规培养72 h。转染细胞株分别为对照组细胞和实验组PGRN-siRNA细胞。
1.3.4 利用qRT-PCR检测RNA干扰效果
收集正常细胞、对照组细胞和实验组PGRN-siRNA细胞,利用TRIzol试剂提取总RNA,具体步骤按说明书进行操作,提取完测定浓度,置于-80 ℃冰箱内保存备用;利用提取的RNA合成cDNA;用qRT-PCR仪进行扩增,反应条件为:94 ℃ 5 min,94 ℃ 40 s,55 ℃ 40 s,72 ℃ 60 s,共30个循环;72 ℃6 min终止反应。扩增产物经2%琼脂糖凝胶电泳,EB染色,紫外透射仪观察。
1.3.5 BGC823细胞增殖活性检测
将正常细胞组、对照组细胞和实验组PGRN-siRNA细胞接种于96孔板中,分别培养72 h;加入四甲基偶氮唑盐(MTT)继续培养4 h,加入DMSO室温摇床震荡10 min,检测570 nm吸光度(D)值,实验重复3次。
1.3.6 BGC823细胞克隆形成能力的检测[8]
将正常组、对照组和实验组PGRN-siRNA细胞常规培养72 h;无菌PBS冲洗,胰酶消化,将细胞悬液做梯度倍数稀释,计数;取300个细胞接种于6孔板中,分散均匀,各做3复孔;放置于37 ℃、CO2体积分数为5%的培养箱中培养2周;当6孔板中出现肉眼可见的克隆时,终止培养;吸出培养基,PBS洗涤1次,每孔加入500 μL甲醇固定5 min;吸出固定液,PBS洗涤,加适量吉姆萨染液染色10 min;PBS洗涤、干燥,低倍镜下计数>50个细胞的克隆数,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。
1.3.7 BGC823细胞衰老检测[9]
应用β-半乳糖苷酶(SA-β-gal)染色法,步骤如下:将正常、对照组和实验组PGRN-siRNA细胞常规培养72 h;吸出6孔板中的培养基,PBS洗涤1次;每孔加入固定液1 mL,室温固定15 min;再吸出固定液,PBS洗涤3次;吸出PBS,每孔加入1 mL现配置的染色工作液;保鲜膜封住培养板,在37 ℃普通温箱中温育过夜;光学显微镜随机选取1 000个细胞,计数衰老细胞所占细胞百分比。
1.4 统计学处理
采用SPSS 16.0统计软件进行结果分析,实验组与对照组间差异采用χ2或t检验,多样本间比较采用SNK法。P<0.05为差异有统计学意义。
2 结 果
2.1 PGRN在胃癌组织中的表达明显高于癌旁组织
通过免疫组化染色方法检测PGRN在胃癌及癌旁胃黏膜组织标本中的表达。免疫组化染色结果显示,在50例癌旁胃黏膜标本中,PGRN阳性表达率为16.7%,在50例胃癌标本中,PGRN阳性表达率为87.4%。两者比较差异有统计学意义(P<0.01,图1)。
2.2 抑制PGRN表达导致BGC823细胞增殖能力与克隆形成能力均降低
通过干扰BGC823细胞PGRN后,利用MTT法和克隆形成实验测定PGRN对细胞增殖的影响。结果显示,实验组PGRN-siRNA细胞与对照组细胞和正常细胞组比较,实验组细胞中PGRN mRNA明显低于其他两组,细胞形态发生改变,PGRN受到抑制的BGC823细胞增殖能力和克隆形成能力均显著降低,克隆形成数目减少,体积减小。PGRN-siRNA细胞的克隆形成率为(25.3±3.1)%,对照组细胞的克隆形成率为(72.1±5.7)%,正常组细胞的克隆形成率为(80.3±4.0)%。两两比较,对照组与正常组间差异无统计学意义(P>0.05)。实验组细胞与其他两组间差异均有统计学意义(P均<0.05,图2、3)。
2.3 抑制PGRN表达导致BGC823细胞衰老程度增加
SA-β-gal是一种细胞衰老标志物,细胞老化时,细胞内会产生绿色沉淀。应用SA-β-gal染色,实验组细胞衰老程度和数量明显增加,衰老阳性率为(27.6±2.1)%,对照组细胞衰老阳性率为(3.2±1.3)%,正常组细胞衰老阳性率为(1.9±1.2)%。两两比较,对照组与正常组间差异无统计学意义(P>0.05),实验组与其他两组间差异均有统计学意义(P均<0.05,图4)。 (DAB, ×100)

图1 PGRN在胃癌及癌旁组织中的表达Fig. 1 Expression of PGRN in adjacent normal and cancerous gastric tissues
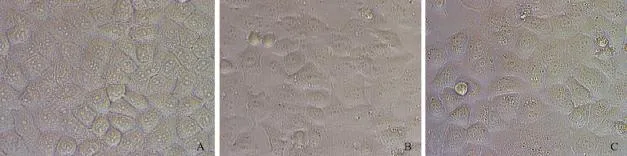
图2 干扰PGRN表达对BGC823细胞形态的影响Fig. 2 Morphology changes with siRNA and control in BGC823 cells

图3 干扰PGRN表达致BGC823细胞增殖和克隆形成减少Fig. 3 Inhibition of PGRN in BGC823 cells decreased the proliferation and clonogenic capacity

图4 干扰PGRN表达致BGC823细胞衰老程度增加Fig. 4 Inhibition of PGRN in BGC823 cells promoted senescence
3 讨 论
胃癌是当今世界最常见的恶性肿瘤之一,病死率高,目前胃癌的发生机制仍不明确,尚无有效针对胃癌的治疗手段。因此,探索新型的治疗途径,找到有效的治疗方法势在必行。
近年来,随着分子生物学领域的快速发展,控制细胞生长和分化的许多标志物被逐渐认识。PGRN就是一种新型、分泌性生长因子,除在机体中调节各种上皮细胞的增殖外,还和恶性肿瘤的发生、发展、侵袭及预后息息相关。Pizarro等[10]研究发现,PGRN能够促进肿瘤血管的生成与肿瘤细胞的侵袭。Han等[11]认为,PGRN可作为一个独立的晚期卵巢上皮细胞癌预后标志物,这与Carlson等[12]的研究结果一致。Carlson等[12]曾报道在卵巢上皮细胞癌患者中,越高的PGRN导致患者的生存率越低。目前,对于PGRN作用机制的研究还非常少。Frampton等[13]认为,PGRN是通过介导去乙酰化酶1(sirtuin1,SIRT1)导致胆管增生和胆管癌细胞过度增殖。Swamydas等[14]则认为是溶血磷脂酸(lysophosphatidic acid,LPA)激活PGRN引起ERK信号转导通路的变化,促进乳腺癌细胞的侵袭。然而关于PGRN在胃癌中的表达及生物学意义却极少报道。
本研究发现,PGRN在胃癌组织和胃癌细胞BGC823中亦存在高表达,通过siRNA干扰技术降低细胞中PGRN的表达,PGRN-siRNA细胞与正常细胞和对照组细胞比较,PGRN-siRNA细胞形态发生改变,细胞变的大而平,细胞内颗粒明显增多,对照组细胞未见明显改变,细胞轮廓清晰、生长良好。通过检测细胞的增殖与克隆形成能力,发现干扰PGRN表达后的BGC823细胞的增殖能力与克隆形成能力明显降低,说明PGRN与胃癌细胞的增殖密切相关。为探讨PGRN对BGC823细胞增殖影响的原因,本研究采用SA-β-gal染色法进一步检测。SA-β-gal是一种细胞衰老标志物,细胞衰老被认为是一种程序性的细胞反应,使细胞不可逆的分裂停滞。近年来的研究显示,细胞衰老是一种抑制肿瘤发生、发展的重要方式[15]。细胞衰老可抑制肿瘤恶变,还可以增强化疗药物及肿瘤治疗的疗效[16-17]。在本研究中,实验组与对照组和正常组细胞比较,衰老细胞程度和数量显著增加,表明PGRN是BGC823细胞衰老过程中的重要调控因子,在BGC823细胞衰老发生过程中发挥着重要作用,通过衰老途径可以影响胃癌细胞的增殖。当前人们对细胞的衰老机制,以及细胞衰老在恶性肿瘤发生过程中的作用了解还很少,仍需进一步探索。
综上所述,恶性肿瘤高表达PGRN与肿瘤发生、转移和低生存率密切相关。PGRN可能是一个新的生物标志物,是临床胃癌治疗的新的靶向目标,对今后胃癌的诊断和临床治疗具有广阔的应用前景。
[1] JIA S, JIA Y, WEEKS H P, et al. Down-regulation of WAVE2, WASP family verprolin-homologous protein 2, in gastric cancer indicates lymph node metastasis and cell migration[J].Anticancer Res, 2014, 34(5): 2185-2194.
[2] CHENG T Y, WU M S, LIN J T, et al. Formyl peptide receptor 1 expression is associated with tumor progression and survival in gastric cancer[J]. Anticancer Res, 2014, 34(5): 2223-2229.
[3] WANG M, LI G, YIN J, et al. Progranulin overexpression predicts overall survival in patients with glioblastoma[J]. Med Oncol, 2012, 29(4): 2423-2431.
[4] LU Y, ZHENG L, ZHANG W, et al. Growth factor progranulin contributes to cervical cancer cell proliferation and transformation in vivo and in vitro[J]. Gynecol Oncol, 2014, 134(2): 364-371.
[5] KOO D H, PARK C Y, LEE E S, et al. Progranulin as a prognostic biomarker for breast cancer recurrence in patients who had hormone receptor-positive tumors: a cohort study[J]. PLoS One, 2012, 7(6): e39880.
[6] CHEN X Y, LI J S, LIANG Q P, et al. Expression of PC cell-derived growth factor and vascular endothelial growth factor in esophageal squamous cell carcinoma and their clinicopathologic significance[J]. Chin Med J (Engl), 2008, 121(10): 881-886.
[7] SHIRAZI A N, PAQUIN K L, HOWLETT N G, et al. Cyclic peptide-capped gold nanoparticles for enhanced siRNA delivery[J]. Molecules, 2014, 19(9): 13319-13331.
[8] NINIB B, AFSAR R, NINA W S, et al. Detection of human cytomegalovirus in medulloblastomas reveals a potential therapeutic target[J].J Clin Invest, 2011,121(10): 4043-4055.
[9] GEORGAKOPOULOU E A, TSIMARATOU K, EVANGELOU K, et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues [J]. Aging (Albany NY), 2013, 5(1): 37-50.
[10] PIZARRO G O, ZHOU X C, KOCH A, et al. Prosurvival function of the granulin-epithelin precursor is important in tumor progression and chemoresponse[J]. Int J Cancer, 2007, 120: 2339-2343.
[11] HAN J J, YU M, HOUSTON N, et al. Progranulin is a potential prognostic biomarker in advanced epithelial ovarian cancers[J]. Gynecol Oncol, 2011, 120(1): 5-10.
[12] CARLSON A M, MAURER M J, GOERGEN K M, et al. Utility of progranulin and serum leukocyte protease inhibitor as diagnostic and prognostic biomarkers in ovarian cancer[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(10): 1730-1735.
[13] FRAMPTON G, UENO Y, QUINN M, et al. The novel growth factor, progranulin, stimulates mouse cholangiocyte proliferation via sirtuin-1-mediated inactivation of FOXO1[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(11): 1202-1211.
[14] SWAMYDAS M, NGUYEN D, ALLEN L D, et al. Progranulin stimulated by LPA promotes the migration of aggressive breast cancer cells[J]. Cell Commun Adhes, 2011, 18(6): 119-130.
[15] DOHI Y, IKURA T, HOSHIKAWA Y, et al. Bach1 inhibits oxidative stress-induced cellular senescence by impeding p53 function on chromatin[J]. Nat Struct Mol Biol, 2008, 15(12): 1246-1254.
[16] ZHU Z L, YAN B Y, ZHANG Y, et al. Cytoplasmic expression of p33(ING1b) is correlated with tumorigenesis and progression of human esophageal squamous cell carcinoma[J]. Oncol Lett, 2013, 5(1): 161-166.
[17] BANDEY I, CHIOU S H, HUANG A P, et al. Progranulin promotes Temozolomide resistance of glioblastoma by orchestrating DNA repair and tumor stemness[J]. Oncogene, 2014. doi: 10.1038/onc.2014.92.[Epub ahead of print]
Effects of progranulin on proliferation and senescence in gastric cancer cells
LI Yuanyuan1, WANG Hongyan2,3, WU Xiaoyan2, SONG Ruihui1, LI Jing4 (1.Department of Morphology, Weifang Medical University, Weifang Shandong 261053, China; 2.Department of Microbiology, Weifang Medical University, Weifang Shandong 261053, China; 3.Key Lab for Immunology in Universities of Shandong Province, Weifang Shandong 261053, China; 4.Basic Medical College, Weifang Medical University, Weifang Shandong 261053, China)
WANG Hongyan E-mail: sdwfwhy@163.com
Background and purpose:Progranulin (PGRN) is a novel growth factor that plays an important role in the tumorigenicity, tumor cell migration and cell cycle. Its expression in many malignant tumor cells is high. It is not only involved in tumor cell growth, but also closely related with the occurrence and evolution of tumor. This study was to investigate the expression of PGRN in gastric cancer and the effects on proliferation and senescence in gastric cancer cell line BGC823.Methods:Immunohistochemical method was used to detect the expression of PGRN in gastric cancer tissues and adjacent normal tissues; Quantitative real-time polymerase chain reaction (qRT-PCR) was used to detect the expression of PGRN in PGRN-siRNA BGC823 cells; MTT method, cell colony formation and cell senescence experiments were used to explore the effects of PGRN on proliferation and senescence in BGC823cell.Results:PGRN protein levels were high in gastric cancer tissues; Knocking down the PGRN gene in BGC823 decreased the proliferation and clonogenic capacity, cloning effciency in PGRN-siRNA group was (25.3±3.1)%, in the control group was (72.1±5.7)%, and in the normal cells was (80.3±4.0)%, there was no signifcant difference between normal group and control group, but there were signifcant differences among PGRN-siRNA group and the other two groups (P<0.05); Knocking down the PGRN gene in BGC823 cells could promote cell senescence. The positive rate of aging in PGRN-siRNA group was (27.6±2.1)%, in the control group was (3.2±1.3)%, and in the normal group was (1.9±1.2)%, there was no signifcant difference between normal group and control group. But there were signifcant differences among PGRN-siRNA group and the other two groups (P<0.05).Conclusion:PGRN can be used as a new marker for gastric cancer, and provide new ideas to the treatment of gastric cancer.
Gastric neoplasms; Progranulin; siRNA; Cell senescence
10.3969/j.issn.1007-3969.2015.03.003
R735.2
A
1007-3639(2015)03-0173-06
2014-08-07
2014-11-10)
国家自然科学基金资助项目(81201262);山东省医药卫生科技发展计划项目(2011HZ114)。
王红艳 E-mail:sdwfwhy@163.com
