miR-222通过下调DDIT4抑制肾癌细胞自噬
2015-01-04
河北医科大学第四医院泌尿外科,河北 石家庄 050011
miR-222通过下调DDIT4抑制肾癌细胞自噬
倪晓辰,赵志红,马永良,任宗涛,刘彬,张爱莉
河北医科大学第四医院泌尿外科,河北 石家庄 050011
背景与目的:微小RNA(microRNA,miRNA,miR)在肿瘤的发生、发展中具有重要的作用。miR-222在多种肿瘤组织中表达上调,而其在肾癌(renal cell carcinoma,RCC)中的表达及其作用机制尚不清楚。本研究拟通过检测RCC组织及相应癌旁组织中miR-222的表达情况,探讨miR-222在RCC中的作用。并在体外条件下,通过检测miR-222的下游作用靶点,探讨miR-222的抗RCC作用机制。方法:采用实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测RCC组织和癌旁组织中miR-222的表达;采用CCK-8法检测细胞的增殖活力;采用蛋白[质]印迹法(Western blot)检测DDIT4蛋白及LC3-Ⅱ的表达;采用荧光素酶实验验证miR-222的作用靶点;转染EGFP-LC3后在激光共聚焦显微镜下观察细胞自噬状态。结果:qRTPCR检测结果显示,miR-222在RCC组织中表达明显上调。在人肾透明细胞癌786-O细胞株中敲低miR-222表达后显著抑制细胞的增殖活力,而过表达miR-222可增强786-O细胞的增殖活力(P<0.01)。在786-O细胞中敲低miR-222后,其靶基因DDIT4蛋白的表达显著上调,过表达miR-222后,DDIT4表达明显下调。荧光素酶实验结果表明,DDIT4为miR-222的直接作用靶点。RCC组织的DDIT4表达下调。在786-O细胞中抑制miR-222表达后,LC3-Ⅱ的表达水平显著上调,自噬体数目显著增加。结论:miR-222在RCC中高表达,并可能通过靶向抑制DDIT4的表达参与调控RCC细胞自噬。
miR-222;肾癌;DDIT4;自噬
微小RNA(microRNA,miRNA,miR)是一类胞内小分子RNA,它们通过与mRNA的3’UTR区结合使靶基因沉默,从而抑制miRNA调控靶基因的表达。随着近年来对miRNA研究的逐步深入,越来越多的研究证实,miRNA在多种疾病的发生、发展过程中起到关键性的调控作用。因此,miRNA的功能研究对于认识疾病的发展过程及寻求疾病治疗的新靶点具有重要的临床意义。
肾癌(renal cell carcinoma,RCC)是泌尿系统常见的恶性肿瘤之一,在恶性肿瘤患者中,RCC患者比例大约占到了2%,每年全世界新发RCC患者超过200 000例[1],据估计2014年全美新发肾脏肿瘤患者将会达到63 920例,而死于肾脏肿瘤的患者数量更将会达到13 860例[2]。因此,研究RCC细胞中的关键分子的作用机制,对于深入了解该疾病的发展过程以及靶向治疗有重要意义。以往的研究表明,miR-222在乳腺癌[3]、甲状腺癌[4]、脑胶质瘤[5]和胃癌[6]等多种肿瘤中都具有显著的调控作用,说明miR-222在肿瘤的发生、发展过程中发挥着重要作用。关于miR-222在RCC中的功能尚不清楚。本研究通过检测miR-222在RCC组织中的表达及干扰人肾透明细胞癌786-O细胞株中miR-222的表达为模型,探讨miR-222在RCC细胞中的作用机制,为RCC的分子靶向治疗提供实验依据。
1 材料和方法
1.1 组织标本采集
RCC组织取自河北医科大学第四医院2013年3月1日—2013年5月8日住院并进行RCC根治性切除,术后病理证实为RCC的患者共23例,其中男性16例,女性7例,平均年龄为(67±7.5)岁。各组织标本分为RCC组织和相应癌旁组织,手术切下后迅速冻存于液氮保存备用。本研究遵循伦理学标准并得到河北医科大学第四医院伦理委员会批准及受试者的知情同意。
1.2 主要试剂
人RCC细胞786-O及人胚肾小管上皮细胞HEK 293购自北京协和细胞资源中心;EGFPLC3质粒由日本大阪大学Tamotsu Yoshimori教授惠赠;RPMI-1640及DMEM高糖培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;LipofectamineTM2000、High Capacity cDNA逆转录试剂盒及TaqMan miRNA检测试剂盒购自美国Life Technologies公司;miRNeasy迷你试剂盒购自德国Qiagen公司;双荧光素酶检测试剂盒购自美国Promega公司;miR-222类似物、抑制物及其阴性对照购自上海吉玛公司;CCK-8购自日本东仁化学研究所;本研究所使用抗体均购自美国Cell Signaling Technology公司。
1.3 组织总RNA提取及实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)
将各组织取出并研磨,使用miRNeasy迷你试剂盒按照试剂盒说明提取组织总RNA之后,采用High Capacity cDNA逆转录试剂盒进行逆转录反应,使用TaqMan miRNA检测试剂盒进行qRT-PCR检测,U6作为各组样品的内参,以miR-222与U6的比值作为该样品中miR-222的相对表达强度。
1.4 细胞培养及转染
786-O、HEK 293细胞分别培养于含有10%胎牛血清的RPMI-1640培养基或DMEM高糖培养基中,置于37 ℃、CO2体积分数为5%、饱和湿度的细胞培养箱中常规培养。miR-222类似物、抑制物及其阴性对照和EGFP-LC3质粒均使用LipofectamineTM2000,并按使用说明进行转染,转染后分别进行蛋白[质]印迹法(Western blot)检测或使用激光共聚焦显微镜观察。
1.5 CCK-8细胞增殖实验
将对数生长期的细胞接种于96孔板内,每孔100 μL细胞悬液,待细胞贴壁分别转染miR-222类似物、抑制物及其阴性对照,温育48 h后,每孔分别加入10 μL CCK-8,置于细胞培养箱内继续温育,实时观察,适时终止,450 nm酶标仪比色。
1.6 Western blot检测
将细胞或组织总蛋白裂解后定量,将等量蛋白上样于SDS-PAGE中电泳。之后将蛋白恒流电转移至硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,之后用相应一抗于4 ℃下温育过夜。第2天,用TBST溶液洗膜,之后用辣根过氧化物酶标记的相应二抗室温封闭1 h。洗膜后,用化学发光仪检测目的条带的表达。
1.7 双荧光素酶实验
分别将含有野生型及突变型DDIT4 3’UTR的报告基因质粒、pRL-TK质粒、miR-222类似物及其对照转染入HEK 293细胞中,48 h后按照双荧光素酶检测试剂盒使用说明进行操作,并在多功能酶标仪上分别检测萤火虫及海肾荧光素酶的活性。以萤火虫荧光强度与海肾荧光强度比值反映各组的相对荧光值。
1.8 统计学处理
2 结 果
2.1 RCC组织的miR-222表达上调
提取RCC组织及相应癌旁组织的总RNA进行qRT-PCR检测,结果显示,RCC组织的miR-222表达水平较对照组显著上调,差异有统计学意义(P<0.01,图1)。
2.2 miR-222调控RCC细胞增殖
CCK-8细胞增殖试验结果显示,在对786-O细胞转染miR-222类似物48 h后,细胞的增殖活力明显增强,而转染了miR-222抑制物antagomiR-222 48 h之后,细胞的增殖活力较对照组受到了明显的抑制,差异有统计学意义(图2,P<0.01)。
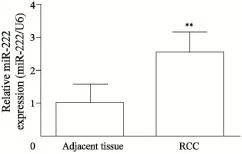
图1 miR-222在RCC及癌旁组织的表达情况Fig. 1 Differential expression of miR-222 in RCC and adjacent tissues
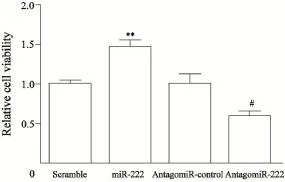
图2 miR-222调控786-O细胞增殖Fig. 2 The effects of miR-222 on proliferation in 786-O cells
2.3 miR-222调控DDIT4蛋白在RCC细胞中的表达
为了进一步探讨miR-222的作用靶点,我们使用了TargetScan预测系统进行预测,发现DDIT4可能是miR-222的潜在靶点。为了验证这一假设,我们首先将miR-222类似物、抑制物及相应对照分别转染到人肾透明细胞癌786-O细胞内。结果表明在抑制了miR-222之后,786-O细胞DDIT4蛋白的表达量较对照组显著升高,而过表达miR-222之后,DDIT4的表达量明显下调(P<0.01,图3A、B)。为进一步探讨DDIT4是否为miR-222的直接作用靶点,我们分别将含有野生型及突变型DDIT4 3’UTR的荧光报告基因质粒转染到HEK 293细胞中,结果显示,miR-222可显著抑制转染有野生型DDIT4 3’UTR质粒细胞的荧光强度,而对于转染有突变型DDIT4 3’UTR质粒细胞的荧光强度无明显影响(图3C)。Western blot检测结果表明,RCC组织中DDIT4蛋白的表达量较相应癌旁组织明显下降(图3D),差异有统计学意义(P<0.05,图3E)。上述结果说明,DDIT4可能是miR-222的作用靶点,其表达量受miR-222的负调控。
2.4 miR-222参与调控RCC细胞自噬
已有文献报道DDIT4可以激活自噬,并可影响肿瘤细胞生长[7]。由于miR-222可以抑制DDIT4的表达,所以我们推测miR-222可能具有抑制细胞自噬的作用。为了验证这一假设,我们将编码EGFP-LC3融合蛋白的质粒pEGFP-LC3和miR-222抑制物共转染至786-O细胞,激光共聚焦显微镜观察细胞自噬状况,结果显示,共转染miR-222抑制物的细胞内的绿色荧光点数较对照组显著增多(P<0.01,图4A、B)。 Western blot检测结果表明,转染了miR-222抑制物的786-O细胞,LC3-Ⅱ型蛋白的表达量较对照组显著升高(图4C、D)。结果表明,miR-222可抑制肾癌细胞自噬。
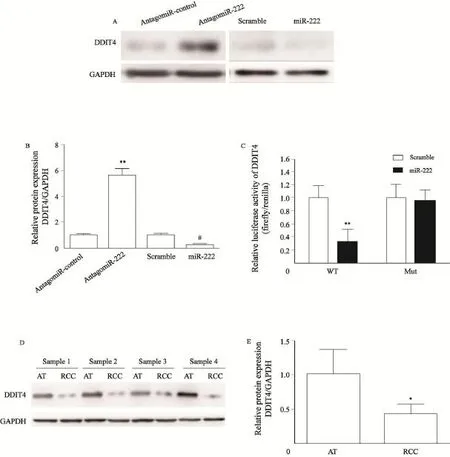
图3 miR-222调控RCC细胞DDIT4蛋白的表达Fig. 3 miR-222 regulated DDIT4 expression in RCC cell
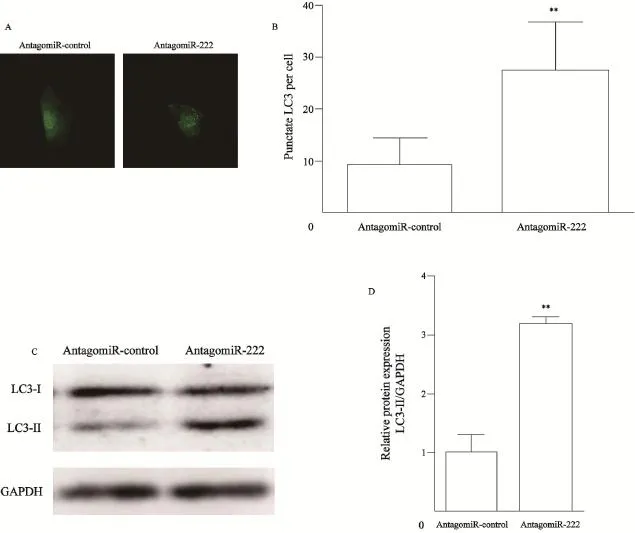
图4 miR-222抑制786-O细胞自噬Fig. 4 miR-222 inhibited autophagy in 786-O cells
3 讨 论
miRNA是一类在细胞内起到调控作用的非编码小分子RNA,能与靶基因的3’UTR结合,通过抑制翻译过程或促进靶基因mRNA降解来调控靶基因蛋白的表达[8]。miRNA在肿瘤的发生、发展过程中发挥着重要的调控作用,深入研究miRNA在肿瘤中的调控机制,对肿瘤的诊断和治疗都具有非常重要的意义。miR-222已知在多种肿瘤中存在着表达异常[3-6]。Zhang等[9]报道,miR-222的高表达与膀胱癌的不良预后呈正相关。Quintavalle等[10]的研究结果表明,miR-222能够调控脑胶质瘤细胞甲基转移酶的表达,导致细胞基因损伤修复障碍,从而引起细胞死亡。Yang等[11]的研究结果表明,miR-222能够通过靶向抑制p27基因的表达阻断肝癌细胞周期,并抑制肝癌细胞的增殖。以往的研究表明miR-222在肿瘤中的功能复杂而重要,在肿瘤的诊断、治疗和预后方面都具有潜在的应用价值。在本研究中,我们发现miR-222在RCC组织中表达量较癌旁组织显著上升,miR-222能够负向调控下游靶基因DDIT4蛋白的表达。DDIT4能够激活TSC1/2复合物,从而抑制mTOR信号通路,继而激活细胞自噬[12]。已有研究表明与miR-222同簇的miR-221可以通过靶向抑制DDIT4促进肝癌的发生和肝癌细胞的生长[13],而关于miR-222调控细胞自噬以及与DDIT4的关系目前未见报道,本研究发现RCC中高表达的miR-222可以通过直接与DDIT4 3’UTR结合并负向调控DDIT4抑制RCC细胞自噬。
自噬是细胞最基本的生理过程之一,具有维持细胞能量代谢和细胞内环境稳态的作用。在自噬过程中,自噬泡内待降解的物质被溶酶体内的酸性水解酶水解成为核酸、氨基酸、脂肪酸和糖原等小分子物质,这些小分子物质被重新释放到细胞内,参与细胞的物质再循环或细胞代谢功能[14]。目前已知多种疾病都与自噬功能障碍密切相关[15]。自噬在肿瘤中的功能非常复杂,目前还不是十分清楚,有假说提出,正常生理状态下的自噬可以清除细胞内原发的引起DNA损伤的物质,如活性氧、受损伤的线粒体和错误折叠的蛋白质等,从而维持基因组DNA的完整性和稳定性,进而抑制肿瘤的发生[16]。而我们的研究表明,在肾癌组织中,miR-222表达量显著上调,并可通过抑制DDIT4的表达抑制细胞自噬。因此,我们推测miR-222在RCC组织中的高表达在一定程度上可能促进了RCC的发生、发展。利用自噬治疗肿瘤已经成为近年来肿瘤治疗研究领域的新热点,如雷帕霉素、氯喹及其衍生物羟基氯喹等,目前部分研究已经处于进行临床试验,并有望应用于临床[17]。
本研究首次在人RCC组织中进行了miR-222的检测,发现miR-222在RCC组织中表达量明显上调,RCC细胞的高miR-222水平可以抑制其下游作用靶点DDIT4蛋白的表达,从而抑制RCC细胞自噬。因此,本研究结果表明miR-222的高表达在RCC发生、发展过程中起到重要的调控作用,可能是RCC治疗的潜在靶点。通过药物调控miRNA等表观遗传因素可能是治疗RCC的有效途径。
[1] BASTIEN L, CULINE S, PAULE B, et al. Targeted therapies in metastatic renal cancer in 2009[J]. BJU Int, 2009, 103(10): 1334-1342.
[2] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[3] CHEN W X, HU Q, QIU M T, et al. miR-221/222: promising biomarkers for breast cancer[J]. Tumour Biol, 2013, 34(3): 1361-1370.
[4] JIHUZONO T, KAWAMOTO M, YOSHITAKE H, et al. The miR-221/222 cluster, miR-10b and miR-92a are highly upregulated in metastatic minimally invasive follicular thyroid carcinoma[J]. Int J Oncol, 2013, 42(6): 1858-1868.
[5] HAO J, ZHANG C, ZHANG A, et al. miR-221/222 is the regulator of Cx43 expression in human glioblastoma cells[J]. Oncol Rep, 2012, 27(5): 1504-1510.
[6] CHUN-ZHI Z, LEI H, AN-LING Z, et al. MicroRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J]. BMC Cancer, 2010, 10: 367.
[7] BEN SAHRA I, REGAZZETTI C, ROBERT G, et al. Metformin, independent of AMPK, induces mTOR inhibition and cell-cycle arrest through REDD1[J]. Cancer Res, 2011, 71(13): 4366-4372.
[8] BARTEL D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233.
[9] ZHANG D Q, ZHOU C K, JIANG X W, et al. Increased expression of miR-222 is associated with poor prognosis in bladder cancer[J]. World J Surg Oncol, 2014, 12(9): 241.
[10] QUINTAVALLE C, MANGANI D, ROSCIGNO G, et al. MiR-221/222 target the DNA methyltransferase MGMT in glioma cells[J]. PLoS One, 2013, 8(9): e74466
[11] YANG Y F, WANG F, XIAO J J, et al. MiR-222 overexpression promotes proliferation of human hepatocellular carcinoma HepG2 cells by downregulating p27[J]. Int J Clin Exp Med, 2014, 7(48): 893-902.
[12] DEYOUNG M P, HORAK P, SOFER A, et al. Hypoxia regulates TSC1/2-mTOR signaling and tumor suppression through REDD1-mediated 14-3-3 shuttling[J]. Genes Dev, 2008, 22(2): 239-251.
[13] PINEAU P, VOLINIA S, MCJUNKIN K, et al. miR-221 overexpression contributes to liver tumorigenesis[J]. Proc Natl Acad Sci U S A, 2010, 107(1): 264-269.
[14] MIZUSHIMA N, KOMATSU M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-741.
[15] CHOI A M, RYTER S W, LEVINE B. Autophagy in human health and disease[J]. N Engl J Med, 2013, 368(19): 1845-1846.
[16] WHITE E. Deconvoluting the context-dependent role for autophagy in cancer[J]. Nat Rev Cancer, 2012, 12(6): 401-410.
[17] KIMURA T, TAKABATAKE Y, TAKAHASHI A, et al. Chloroquine in cancer therapy: a double-edged sword of autophagy[J]. Cancer Res, 2013, 73(1): 3-7.
miR-222 can inhibit the autophagy of renal cell carcinoma cells through down-regulating the expression of DDIT4
NI Xiaochen, ZHAO Zhihong, MA Yongliang, REN Zongtao, LIU Bin, ZHANG Aili (Department of Urology, the Fourth Hospital of Hebei Medical University, Shijiazhuang Hebei 050011, China)
ZHANG Aili E-mail: z13930409899@163.com
Background and purpose:MicroRNA (miRNA, miR) plays an important regulatory role in cancer. miR-222 is reported to be up-regulated in various tumors, but its role in renal cell carcinoma (RCC) remains unclear. In this study, we detected the expression of miR-222 in both RCC and adjacent tissue samples. The aim of this study was to investigate the role of miR-222 in RCC.Methods:The expression levels of miR-222 in RCC tissue samples were quantified by quantitative real-time polymerase chain reaction (qRT-PCR). DDIT4 and LC3-Ⅱ protein expressions were determined by Western blot. Dual luciferase assay was performed to verify the target of miR-222. EGFP-LC3 microscopy assay was performed to assess autophagy.Results:Results from qRT-PCR showed that the expression of miR-222 was up-regulated in RCC tissues. Knockdown of miR-222 with specifc antagomiR decreased the cell viability of 786-O cells, whereas overexpression of miR-222 increased the cell viability (P<0.01). The levels of DDIT4 were upregulated in 786-O cells transfected with miR-222 antagomiR, whereas overexpression of miR-222 induced the downregulation of DDIT4 expression. Data from dual luciferase assay indicated that miR-222 directly targeted the expression of DDIT4. Consistently, the expression of DDIT4 in RCC tissues was down-regulated compared with adjacent tissues. Knockdown of miR-222 in 786-O cells induced a signifcant increase of autophagosome formation and LC3 lipidation.These results supported that miR-222 could inhibit autophagy in RCC cells, which may affect the clinical characteristcs of RCC.Conclusion:miR-222 is up-regulated in RCC and can inhibit the autophagy of RCC cells through downregulating the expression of DDIT4.
miR-222; Renal cell carcinoma; DDIT4; Autophagy
10.3969/j.issn.1007-3969.2015.03.001
R737.11
A
1007-3639(2015)03-0161-06
2014-08-30
2014-11-14)
河北省医学科学研究重点课题计划(20110142)。
张爱莉 E-mail:z13930409899@163.com
