缺氧微环境对人肺癌高转移细胞株95D失巢凋亡的研究
2015-01-02
(沈阳市第四人民医院肿瘤内科,沈阳 110031)
缺氧微环境对人肺癌高转移细胞株95D失巢凋亡的研究
王艳,陈新,高旭灵
(沈阳市第四人民医院肿瘤内科,沈阳 110031)
目的研究缺氧微环境对人巨细胞肺癌高转移细胞系95D失巢凋亡的影响。方法对95D悬浮培养,建立人肺癌高转移细胞株95D失巢凋亡抵抗细胞模型,实验组进行缺氧培养,对照组正常有氧培养,MTT检测缺氧微环境对于失巢凋亡抵抗95D细胞系生长的影响,流式细胞仪检测2组细胞的凋亡情况,Transwell实验检测2组细胞侵袭能力,Western blot检测缺氧对于失巢凋亡抵抗95D细胞中HIF-1α、VEGF和MMP-2蛋白表达的影响。结果缺氧微环境下失巢凋亡抵抗细胞组生长率为52.9%;凋亡率(40.4%)明显高于非缺氧培养组(21.7%),差异有统计学意义(P<0.05);侵袭能力降低,穿过膜细胞数(40.1±6.7)明显低于对照组(12.5±7.9),差异有统计学意义(P<0.05);缺氧微环境下失巢凋亡抵抗95D细胞中HIF-1α表达上调,侵袭转移相关蛋白VEGF和MMP-2表达下调。结论在人肺癌高转移细胞株95D失巢凋亡过程中,缺氧微环境能从一定程度上抑制失巢凋亡抵抗细胞的生长,缺氧微环境能降低失巢凋亡抵抗细胞的生存能力和转移能力,但这可能是缺氧后早期表现。
肺癌;95D;缺氧;失巢凋亡
缺氧是晚期实体性肿瘤的特征性微环境,目前研究表明[1,2]缺氧与肿瘤的发生发展密切相关,人恶性实质肿瘤内部存在一定的缺氧区域,其对于肿瘤生物学行为有重要的影响。乳腺癌是呈浸润生长的实体肿瘤,缺氧微环境是部分乳腺癌细胞生存的真实微环境[3]。肺癌是世界上最常见的恶性肿瘤之一,已成为我国城市人口恶性肿瘤死亡原因的第1位。肺癌中占大多数病理类型的非小细胞肺癌,约75%患者发现时已处于中晚期,5年生存率很低。“失巢凋亡”是一种特殊形式的细胞程序性死亡,是由于细胞与细胞外基质或相邻细胞脱离接触而诱发的特殊形式的凋亡,当细胞离开原发部位,细胞失去细胞外基质联系后,生存能力下降而诱发凋亡,部分细胞获得逃逸失巢凋亡的能力,便能长时间存活,这是恶性肿瘤进展和癌细胞扩散转移的关键步骤[4~6]。本研究将悬浮状态下的人巨细胞肺癌细胞系95D缺氧培养,探讨人巨细胞肺癌细胞系95D缺氧与失巢凋亡的相关性及缺氧后缺氧相关蛋白HIF-1α、侵袭转移相关蛋白VEGF和MMP-2表达情况。
1 材料与方法
1.1 主要试剂
高糖DMEM培养基购自美国Gibico公司,poly-HEMA购自美国Sigma公司,细胞凋亡荧光Hoechst33342/PI双染试剂盒购自南京凯基生物公司,Matrigel胶购自美国BD公司,兔抗人HIF-1α多克隆抗体(sc-10790)和兔抗人β-actin单克隆抗体均购自美国Santa cruz公司,即用型鼠抗人VEGF单克隆抗体和即用型鼠抗人MMP-2单克隆抗体购自福建迈新公司。
1.2 poly-HEMA包被培养板的制备及人肺癌高转移细胞株95D失巢凋亡的诱导
将poly-HEMA溶于95%乙醇后反复吹打,将其配成终浓度为50 mg/mL的poly-HEMA工作液,并将其加入培养6孔培养板,将poly-HEMA包被培养板放入超净台内干燥24 h乙醇挥发完全后紫外照射消毒。人巨细胞肺癌细胞系95D采用含15%胎牛血清的高糖DMEM培养基,置于37℃、5%CO2和95% O2的培养箱中传代培养。取对数生长期人肺癌高转移95D细胞以5×105/孔接种于poly-HEMA包被培养板悬浮培养细胞。
1.3 实验分组
将对照组细胞于37℃、5%CO2和95%O2的培养箱中悬浮培养,实验组于37℃、7.5%CO2、2.5%O2和90%N2的缺氧培养箱中悬浮培养,隔日换液(换液时须离心细胞后弃上清)。悬浮培养4 d后,将悬浮培养细胞离心收集,用培养基重悬后接种于普通培养瓶,待长成单层消化离心收集贴壁细胞,此为失巢凋亡抵抗细胞。
1.4 MTT法研究缺氧微环境对于失巢凋亡抵抗95D细胞系生长的影响
将2组人肺癌高转移细胞株95D悬浮培养4 d后离心收集,以2×103/孔浓度接种于96孔培养板上,均于5%CO2和95%O2的培养箱中培养24 h。待24 h后细胞贴壁后,每孔加入20 μL(5g/L)MTT溶液,再继续培养4 h,弃上清液加入200 μL DMSO,振荡10 min,用酶标仪测定490 nm处各孔的吸光度值。计算生存率,实验组生存率的公式为:生存率(%)=实验孔A490 nm值/对照孔A490 nm值×100。
1.5 流式细胞仪检测缺氧微环境对于失巢凋亡抵抗95D细胞凋亡的影响
2组悬浮培养4 d后的95D失巢凋亡抵抗细胞,换无血清培养液培养12 h,使得细胞周期同步化,制成单细胞悬液后离心弃上清,用细胞凋亡荧光Hoechst33342/PI双染试剂盒进行染色,流式细胞仪检测细胞凋亡情况。
1.6 Transwell研究缺氧微环境对于失巢凋亡抵抗95D细胞系侵袭能力的改变
采用Transwell实验,2组细胞用无血清DMEM培养基饥饿12 h,将细胞浓度调整为1×105/mL,将200 μL细胞悬液接种于铺满Matrigel胶的Transwell趋化小室上室,其下室为含高浓度血清的DMEM培养基。培养24 h后棉签擦去Matrigel胶和上室内的细胞,乙醇固定后结晶紫染色,倒置显微镜高倍镜下随机选取8个高倍视野(×400)计数穿过膜的细胞数并拍照,以高倍视野下穿过膜细胞数评估细胞侵袭能力。
1.7 Western blot检测缺氧对于失巢凋亡抵抗95D细胞中HIF-1α、VEGF和MMP-2蛋白表达的影响
2组悬浮培养4 d后的95D失巢凋亡抵抗细胞,用凯基全蛋白提取试剂盒4℃匀浆后提取蛋白,BRADFORD法测定蛋白浓度后定量。蛋白变性后行聚丙烯酰胺凝胶电泳,并转移至PDVF膜,50 g/L脱脂奶粉室温封闭1 h,然后分别与兔抗人HIF-1α多克隆抗体(1∶200)、即用型鼠抗人VEGF单克隆抗体、即用型鼠抗人MMP-2单克隆抗体和兔抗人βactin单克隆抗体(1∶250)室温作用2 h,然后与辣根过氧化物酶标记的羊抗兔IgG抗体或羊抗鼠IgG抗体室温作用1 h,应用发光试剂盒显示蛋白质条带。用Bio-Rad图像分析系统照相,行Image-Pro软件分析,以HIF-1α、VEGF、MMP-2蛋白条带积分灰度值(integrated density value,IDV)与β-actin蛋白条带IDV的比值表示其相对蛋白含量。
1.8 统计学处理
采用SPSS 15.0统计软件。数据以x±s表示,组间比较用t检验和单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 缺氧微环境对失巢凋亡抵抗95D细胞生长率的影响
对照组与缺氧微环境组比较A490有统计学差异(P<0.05),缺氧微环境组生存率为52.9%,见表1。
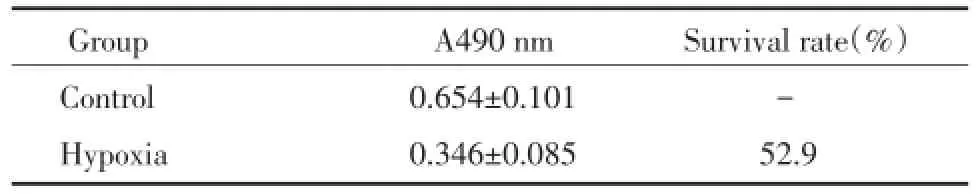
表1 缺氧培养对失巢凋亡抵抗95D细胞生长率的影响Tab.1 The hypoxia effect on the growth rate of anoikis-resistant 95D cells
2.2 缺氧微环境对失巢凋亡抵抗95D细胞凋亡率的影响
流式细胞分析结果表明缺氧培养组凋亡细胞(Annexin V+/PI-)率平均值为40.4%,正常培养组95D细胞凋亡率平均值21.7%,2组细胞凋亡率比较有统计学差异(P<0.05),见图1。
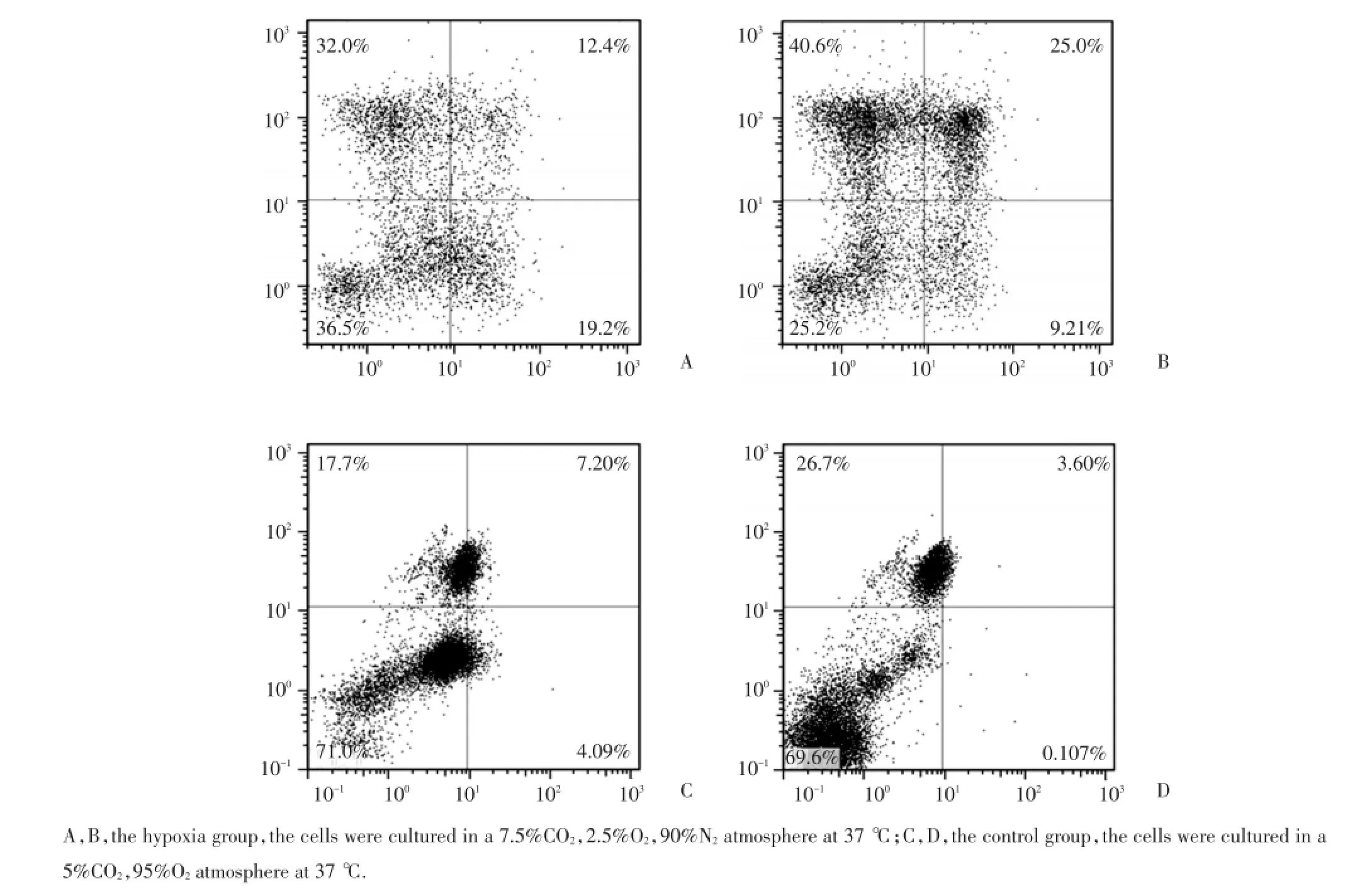
图1 流式细胞仪检测细胞凋亡Fig.1 The apoptosis of 95D detected by flow cytometer
2.3 缺氧微环境对失巢凋亡抵抗95D细胞侵袭能力的影响
2组细胞培养24 h后,缺氧培养组每高倍视野下穿膜细胞数(40.1±6.7)明显高于对照组(12.5± 7.9),差异有统计学意义(P<0.05),见图2。
2.4 缺氧对失巢凋亡抵抗95D细胞HIF-1α、VEGF和MMP-2蛋白表达的影响
Western blot结果显示:对照组、缺氧组HIF-1α/ β-actin相对蛋白表达量为0.211±0.010、0.469± 0.087,对照组、缺氧组VEGF/β-actin相对蛋白表达量为0.776±0.072、0.567±0.034,对照组、缺氧组MMP-2/β-actin相对蛋白表达量为1.126±0.079、0.803±0.036,缺氧后2组细胞HIF-1α、VEGF和MMP-2蛋白表达有差异(P<0.05),缺氧组失巢凋亡抵抗细胞95D中HIF-1α表达上调(图3)。缺氧组侵袭转移相关蛋白VEGF和MMP-2表达下调(图3)。
3 讨论
失巢调亡是指细胞脱离细胞外基质黏附或细胞与细胞间接触后发生的一种程序化死亡,是由于细胞与细胞外基质或相邻细胞脱离接触而诱发[7,8]。失巢凋亡抵抗在肿瘤的恶性转移中起重要作用[9]。每天都有成千上万的肿瘤细胞脱离原发灶进入血液循环,但是只有非常少的细胞具有失巢凋亡抵抗能力从而存活下来,最终在其他器官形成转移灶[10]。局部缺氧是实体肿瘤恶性增殖过程中普遍存在的现象,特别是对于非小细胞肺癌这种实体性肿瘤,在肿瘤实质中心部位的细胞能够摄取的氧来源于内部的微血管,位于肿瘤实质中心且与微血管距离较远的肿瘤细胞,可能处于一个相对缺氧的状态,位于肿瘤实质不同部位的细胞存在不同的微环境中可能具有不同的生物学行为。
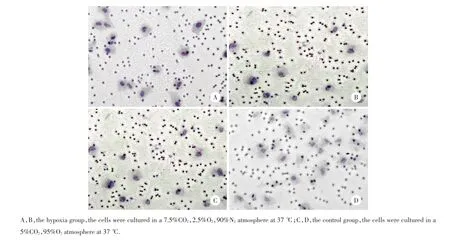
图2 Transwell实验检测95D细胞侵袭能力Fig.2 The 95D invasive ability detected by Transwell test
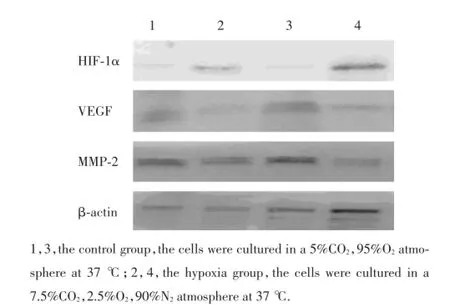
图3 Western blot检测2组细胞HIF-1α、VEGF和MMP-2蛋白表达情况Fig.3 The expression of HIF-1α,VEGF and MMP-2 in the hypoxia group and the control group by Western blot
研究表明,一个生长的实体瘤,当其体积达到达到3 mm3时,机体所能供给的营养和氧气已无法满足增殖旺盛的肿瘤细胞群的需要,势必导致瘤体内缺氧现象的发生[11]。本研究将悬浮状态下的高转移人巨细胞肺癌细胞系95D缺氧培养,以研究人巨细胞肺癌细胞系95D中缺氧与失巢凋亡的相关性。结果发现缺氧微环境组生存率和侵袭能力明显低于非缺氧培养组,且缺氧微环境组凋亡率明显高于非缺氧培养组,表明缺氧微环境能降低失巢凋亡抵抗细胞的生存能力和转移能力,且缺氧后HIF-1α表达上调,侵袭转移相关蛋白VEGF和MMP-2表达下调。现有研究表明肿瘤细胞对于缺氧微环境的适应是肿瘤发生发展的必然因素,且HIF-1α介导的低氧信号转导通路的激活在这个过程中扮演了重要角色[12,13]。HIF-1α在肺癌的发生发展中起重要作用,参与肿瘤生长、肿瘤血管生成及淋巴结转移,其在非小细胞肺癌细胞系中高表达可以导致参与肿瘤血管生成的VEGF及其他参与侵袭转移相关因子表达上调[14],与预后差、侵袭性强相关[15,16]。既往研究用缺氧处理了小鼠Lewis肺癌细胞系,发现缺氧后的细胞系对于拓朴替康的药物敏感性明显增加,在这个过程中还伴随HIF-1α上调和VEGF的下调,缺氧微环境可以增强拓朴替康对于HIF-1的抑制[17]。我们研究发现在肺癌细胞学实验中95D细胞缺氧后HIF-1α表达上调,但VEGF和MMP-2表达下调,这可能是缺氧后早期细胞学表现,并推测在缺氧后早期细胞的VEGF和MMP-2表达下调与其适应缺氧相关,后期缺氧微环境能生存下来的细胞可能存在VEGF和MMP-2表达上调。我们还认为肿瘤实质不同部位的细胞因其位于不同的微环境,具有不同的生物学行为,推测位于肿瘤实质中心且与微血管距离较远的肿瘤细胞较肿瘤表面细胞的生存和转移能力弱,是否这两部分细胞还有不同的分子分型及对放化疗不同反应还值得进一步研究,这对于未来的个体化治疗非常有用,目前尚缺乏针对肿瘤缺氧有意义的治疗方法。
肿瘤缺氧信号通路是一个受多因素调控的复杂网络,肿瘤细胞在这个过程中变得生存更为艰难,但是否存在着生存下来的肿瘤细胞对缺氧微环境的更适应或对于放化疗更为耐受,这都是我们未来的研究方向。
[1]Bandara V,Michael MZ,Gleadle JM.Hypoxia represses micro RNA biogenesis proteins in breast cancer cells[J].BMC Cancer,2014,14:533.
[2]Leong HS,Chambers AF.Hypoxia promotes tumor cell motility via RhoA and ROCK1 signaling pathways[J].Proc Natl Acad Sci USA,2014,111(3):887-888.
[3]He X,Chien J,Shridhar V.Assessment of resistance to anoikis in ovarian cancer[J].Methods Mol Biol,2013,1049:347-354.
[4]Paoli P,Giannoni E,Chiarugi P.Anoikis molecular pathways and its role in cancer progression[J].Biochem Biophys Acta,2013,1833(12):3481-3498.
[5]Park SH,Riley P 4th,Frisch SM.Regulation of anoikis by deleted in breast cancer-1(DBC1)through NF-κB[J].Apoptosis,2013,18(8):949-962.
[6]Chen L,Liu H,Liu J,et al.Klotho endows hepatoma cells with resistance to anoikis via VEGFR2/PAK1 activation in hepatocellular carcinoma[J].PLoS One,2013,8(3):e58413.
[7]Frisch SM,Schaller M,Cieply B.Mechanisms that link the oncogenic epithelial-mesenchymal transition to suppression of anoikis[J].J Cell Sci,2013,126(Pt 1):21-29.
[8]Chunhacha P,Sriuranpong V,Chanvorachote P.Epithelial-mesenchymal transition mediates anoikis resistance and enhances invasion in pleural effusion-derived human lung cancer cells[J].Oncol Lett,2013,5(3):1043-1047.
[9]Jenning S,Pham T,Ireland SK,et al.Bit1 in anoikis resistance and tumor metastasis[J].Cancer Lett,2013,333(2):147-151.
[10]Zhang Q,Bai X,Chen W,et al.Wnt/β-catenin signaling enhances hypoxia-induced epithelial-mesenchymal transition in hepatocellular carcinoma via crosstalk with hif-1α signaling[J].Carcinogenesis,2013,34(5):962-973.
[11]Lund EL,Hansen LT,Kristjansen PE.Augmenting tumor sensitivity to topotecan by transient hypoxia[J].Cancer Chemother Pharmacol,2005,56(5):473-480.
[12]Semenza GL.HIF-1:mediator of physiological and pathophysiological responses to hypoxia[J].J Appl Physiol(1985),2010,88(4):1474-1480.
[13]Zhu S,Zhou Y,Wang L,et al.Transcriptional upregulation of MT2-MMP in response to hypoxia is promoted by HIF-1α in cancer cells[J].Mol Carcinog,2011,50(10):770-780.
[14]Lin HH,Tsai CW,Chou FP,et al.Andrographolide down-regulates hypoxia-inducible factor-1α in human non-small cell lung cancer A549 cells[J].Toxicol Appl Pharmacol,2011,250(3):336.
[15]Kuo WH,Shih CM,Lin CW,et al.Association of hypoxia inducible factor-1α polymorphisms with susceptibility to non-small-cell lung cancer[J].Transl Res,2012,159(1):42.
[16]Zuo S,Ji Y,Wang J,et al.Expression and clinical implication of HIF-1alpha and VEGF-C in non-small cell lung cancer[J].J Huazhong Univ Sci Technolog Med Sci,2008,28(6):674.
[17]Lund EL,Hansen LT,Kristjansen PE.Augmenting tumor sensitivity to topotecan by transient hypoxia[J].Cancer Chemother Pharmacol,2005,56(5):473-480.
(编辑武玉欣)
The Effect of Hypoxia on Anoikisin High-metastatic Human Lung Cancer Cell Line 95D
WANGYan,CHENXin,GAOXu-ling
(Department of Oncology,The Fourth Hospital of Shenyang,Shenyang 110031,China)
Objective To investigate the effect of hypoxia micro-environment on anoikis in human high-metastatic cell line 95D of giant cell carcinoma of lung.MethodsSuspension technology was used to culture 95D to establish the model of anoikis-resistant 95D cells.Hypoxic culture was conducted in the experimental group,and regular culture was conducted in the control group.The effect of hypoxia on proliferation of anoikis-resistant 95D was investigated by MTT and the apoptosis in the two groups were detected by flow cytometer.The invasive ability of the cells was assessed by Transwelltest.The effectofhypoxia on the expression of HIF-1α,VEGF and MMP-2 in anoikis-resistant95Dwas detected by Western blot.ResultsThe growth rate of the anoikis-resistant 95D cells treated with hypoxia was 52.9%,and the apoptosis rate of these cells was higher than that in the non-hypoxic group(40.4%vs 21.7%,P<0.05).The treatment of hypoxia down-regulated the invasive ability,the number of migration cells under hypoxia was higher than that in the control group,with statistical significance(40.1±6.7 vs 12.5±7.9,P<0.05).The up-regulation of HIF-1α,the down-regulation of VEGF and MMP-2 were observed in the group of hypoxia.ConclusionDuring anoikis of human high-metastatic lung cancer cell line 95D,hypoxia inhibited the survival ability and the metastasis ability of anoikis-resistant cells,which,however,might be the early manifestation of hypoxia.
lung cancer;95D;hypoxia;anoikis
R734.2
A
0258-4646(2015)05-0456-05
王艳(1977-),女,副主任医师,硕士. E-mail:451324498@qq.com
2014-09-26
网络出版时间:
