人卵巢组织慢速程序化冷冻保存方案的初步探讨
2015-01-02
(沈阳市妇婴医院生殖中心,沈阳 110014)
人卵巢组织慢速程序化冷冻保存方案的初步探讨
刘丽英,曲文玉,蒋丽,张晓丽,刘晓莉
(沈阳市妇婴医院生殖中心,沈阳 110014)
目的系统比较不同冷冻保护剂在不同浓度时对卵巢组织慢速程序化冷冻效果的影响。方法卵巢组织来源于15例卵巢良性肿瘤手术的患者。分别采用丙二醇(PROH)、乙二醇(EG)、二甲基亚砜(DMSO)作为冷冻保护剂,在每种冷冻保护剂1.5 mol/L或2.0 mol/L浓度下进行慢速程序化冷冻。每例患者平行进行上述6种冷冻程序,光镜及电镜下分析卵泡的形态正常率,结果与该患者的新鲜对照组织比较。结果各组中不同发育阶段的卵泡分布无统计学差异(P>0.05)。光镜观察显示,1.5 mol/L EG组及2.0 mol/L EG组的冷冻效果最好,与新鲜对照组织相比卵泡形态正常率无统计学差异(P>0.05);1.5 mol/L PROH组、2.0 mol/L PROH组、1.5 mol/L DMSO组及2.0 mol/L DMSO组与新鲜对照组织相比,卵泡形态正常率的差异有统计学意义(P<0.05)。电镜观察显示,经程序化冷冻后,卵母细胞质量下降,但由于数据少未进行统计分析;与新鲜对照组织相比,6个冷冻组颗粒细胞的活力均明显降低(P<0.01)。形态正常的颗粒细胞数量在2.0 mol/L PROH组及1.5 mol/L EG组中稍高,但6个冷冻组间两两比较,差异无统计学意义(P>0.05)。结论慢速程序化冷冻采用1.5 mol/L EG作为冷冻保护剂,能较好的保存卵泡中的卵母细胞及颗粒细胞,是一种较好的冷冻卵巢组织的方案。
冷冻保存;人卵巢组织;超微结构;慢速程序化冷冻
早在200多年前人类就希望冷冻保存卵巢组织,但是直到上世纪卵巢组织冷冻技术才得以快速发展。1996年Hovatta和Newton等[1,2]相继开展了人卵巢组织冷冻保存的研究,此后人卵巢组织冷冻技术引起广大学者的关注,并逐渐成为全世界研究的热点。2004年Donnez等[3]报道了世界首例将人卵巢组织冷冻保存并自体移植成功获得妊娠的病例,这更增加了人们对这项技术的信心。
影响卵巢组织冷冻复苏效果的因素较多,其中冷冻保护剂种类及浓度的选择是优化冷冻程序的关键。冷冻保护剂浓度过高会对组织和细胞产生毒性作用,浓度过低则不能使组织和细胞充分脱水,在冷冻过程中易产生冷冻损伤,形成细胞内冰晶。本研究的目的是对影响卵巢冷冻复苏效果的冷冻保护剂的种类及浓度进行对照研究,以找到一种成功率高、重复性好、结果稳定可靠的卵巢组织冷冻复苏方法,为将来的临床推广应用提供良好的基础。
1 材料与方法
1.1 一般资料
卵巢组织来源于沈阳市妇婴医院妇科2010年6月至2013年2月因卵巢良性肿瘤行腹腔镜或手术切除的患者,收集正常卵巢组织共15例,患者年龄为29~38岁,平均(31.2±1.5)岁,且近半年无服用激素药物史,具有内分泌功能,至少术前3个月未进行过放疗和/或化疗。本研究经沈阳市妇婴医院医学伦理委员会批准,患者签署知情同意书。
1.2 组织的制备
将术中取出的卵巢组织置于装有预冷卵泡冲洗液(瑞典Vitrolife公司)的无菌试管内,置于冰上,20 min内送入实验室。PBS反复冲洗卵巢组织3次,用刀片切除髓质部分,仅保留卵巢皮质,切割成1 mm×5 mm×5 mm大小的组织块,整个切割过程15 min内完成。随机选取2小块置于固定液中固定保存,作为光镜及透射电镜检查的新鲜对照组。采用的冷冻剂分别为丙二醇(propanediol,PROH)、乙二醇(ethanediol,EG)、二甲基亚砜(dimethysulphoxide,DMSO)。其余组织根据冷冻保护剂种类(PROH、EG、DMSO)及浓度(1.5和2.0 mol/L)的不同分为6组:1.5 mol/L PROH组、2.0 mol/L PROH组、1.5 mol/L EG组、2.0 mol/L EG组、1.5 mol/L DMSO组、2.0 mol/L DMSO组。从每位患者获得的卵巢皮质片均同时进行6种冷冻程序,储存于相同的液氮容器中,解冻后分析同步进行。
1.3 卵巢组织的冷冻与解冻
简言之,卵巢组织装入含6 mL卵巢冷冻液(含10%胎牛血清、1.5 mol/L或2.0 mol/L的PROH或EG或DMSO、0.1 mol/L蔗糖的PBS)的15 mL试管中,4℃摇床平衡30 min,装入1.8 mL的细胞冻存管,置于Planner程序降温仪中。-9~-2℃,2℃/min,-40~-9℃,0.3℃/min,-140~-40℃,-10℃/min,-9℃植冰,冷冻曲线保存于计算机中,冻存管转移至液氮保存。
解冻:37℃水浴,直至冻存管中的冰晶全部溶解,卵巢皮质片依次经过解冻液1、2、3各10 min,室温轻轻震荡,去除冷冻保护剂。冷冻保护剂PROH或EG的解冻方法:1液含0.75 mol/L PROH或EG,0.25 mol/L蔗糖,2液含0.25 mol/L蔗糖,3液为PBS;冷冻保护剂DMSO的解冻方法:1液含0.75 mol/L蔗糖,2液含0.25 mol/L蔗糖,3液为PBS。
1.4 组织学鉴定
1.4.1 光镜分析冷冻复苏卵泡的组织学结构:所有新鲜和冷冻复苏的卵巢组织在4%多聚甲醛固定24 h后经常规脱水、二甲苯透明、系列乙醇逐级脱水和石腊包埋后进行连续切片,切片厚5 μm。常规苏木精-伊红(hematoxylin-eosin,HE)染色,树胶封片。为避免卵泡的重复计数,每10张连续片计数1次。每张标本在光学显微镜下计数卵泡的数量,按照Gougeon等[4,5]的标准观察卵泡形态。正常卵泡:卵泡及卵母细胞形态规则,胞质均匀,核无固缩,颗粒细胞致密而紧凑,基膜完整。异常卵泡:卵泡及卵母细胞结构不完整,卵母细胞核固缩,颗粒细胞层模糊或变性。原始卵泡、初级卵泡及次级卵泡的数量在每组中分别评价。
1.4.2 透射电镜观察冷冻复苏卵泡的超微结构:解冻后的卵巢皮质片置于2.5%的戊二醛中固定,包埋修块后切片,甲苯胺蓝染色,光镜下定位组织学形态正常的卵泡,钻石刀超薄切片后经醋酸铀及硝酸铅双重染色,透射电镜观察卵泡超微结构。按照Keros等[6,7]的标准进行评价。
1.5 统计学分析
采用SPSS 13.0软件进行统计学分析,采用χ2检验比较新鲜组织和冷冻复苏组织中卵泡分布和形态正常比例,P<0.05为差异有统计学意义。
2 结果
2.1 光镜分析结果
7个组共观察了498个窦前卵泡,其中原始卵泡287个(57.7%),初级卵泡183个(36.7%),次级卵泡28个(5.6%),在各组中原始卵泡、初级卵泡、次级卵泡的分布无统计学差异(P>0.05)。冷冻前后人卵泡形态正常率的比较见表1。冷冻复苏组织的人卵泡形态正常率低于新鲜组织。1.5 mol/L EG组及2.0 mol/L EG组的冷冻效果最好,与新鲜组织相比,卵泡形态正常率的差异无统计学意义(P>0.05);1.5 mol/L PROH组、2.0 mol/L PROH组、1.5 mol/LDMSO组及2.0 mol/L DMSO组与新鲜组织相比,卵 泡形态正常率的差异有统计学意义(P<0.05)。

表1 冷冻前后人卵泡形态正常率的比较Tab.1 Comparison between the rate of morphologically normal follicles before and after freezing
2.2 透射电镜分析结果
对81个卵泡进行超微结构的分析,其中包括73个卵子(15个新鲜对照,58个进行慢速程序化冷冻),对797个颗粒细胞进行评价。其中8个卵泡经切割后未见卵子存在,因此仅分析其颗粒细胞。
新鲜及各冷冻组中均可见超微结构正常的原始卵泡、初级卵泡。卵母细胞居中、圆形,核膜(Nm)及核仁(Nc)清晰完整,卵母细胞膜完整、胞质均质、线粒体(M)膜、内质网膜完整、基膜(Bm)完整。但在慢速程序冷冻标本中可见部分卵子的胞核及胞质出现模糊,内质网结构不能清晰辨认,线粒体肿胀,基质暗淡,胞质内空泡(v)形成增加,胞质内出现无细胞器区(*)等(图1)。实验结果表明:经过冷冻后,卵母细胞的质量下降,但由于观察的数据较少,未进行统计学分析(表2)。
保存完好的颗粒细胞包含完整的核及核仁,均质的染色质,胞质内含有丰富的线粒体和内质网,相邻颗粒细胞间缝隙连接清晰可见。大量的小泡、线粒体成份及嵴的丢失,相邻颗粒细胞之间及颗粒细胞与卵母细胞之间分布的上述结构改变均表明颗粒细胞受损(图1)。研究表明:与新鲜组织相间比,经过程序化冷冻后,颗粒细胞的活力明显降低(P<0.01)。形态正常的颗粒细胞数量在2.0 mol/L PROH组及1.5 mol/L EG组中稍高,但6个冷冻组两两比较,差异无统计学意义(P>0.05)。见表2。

图1 透射电镜下卵泡组织形态学分析 ×30 000Fig.1 Transmission electron microscopic images of non-frozen and frozen human follicles×30 000
3 讨论
卵巢组织冷冻作为保存女性生育力的方法之一,尤其适用于因疾病必须切除卵巢或必须行放疗或化疗可能损伤卵巢功能的年轻女性患者。研究证实,患恶性肿瘤的年轻女性患者接受放疗或化疗后将有1/3不孕。因此,卵巢组织冷冻为育龄期妇女在恶性肿瘤治疗后重建正常生育及内分泌功能并提高生活质量,提供了切实有效的方法。
卵巢组织冷冻保存的原理是利用组织内细胞的降温、脱水形成非损伤性结冰,在超低温条件下,其内部分子运动速度减慢甚至停止,各种细胞代谢降低而处于休眠状态,达到储存的目的。但是,由于卵巢组织中含有数量、大小、水含量和渗透性各不相同的多种细胞,同时存在血管系统,更接近于器官冷冻。冷冻卵巢组织比冷冻胚胎或卵母细胞更加复杂。2004年Donnez等[3]为一位25岁的Hodgkin淋巴瘤患者进行了卵巢组织的冷冻,复苏后进行原位移植,11个月后患者成功妊娠并分娩。2005年Meirow、2007年Demeestere、2008年Anderson等[8~10]均报道通过卵巢冷冻获得妊娠及分娩。尽管程序化冷冻目前已经取得了很好的效果,但全球范围内分娩的活婴也不过十几例。冷冻程序的优化仍是广大研究者需要解决的难题。
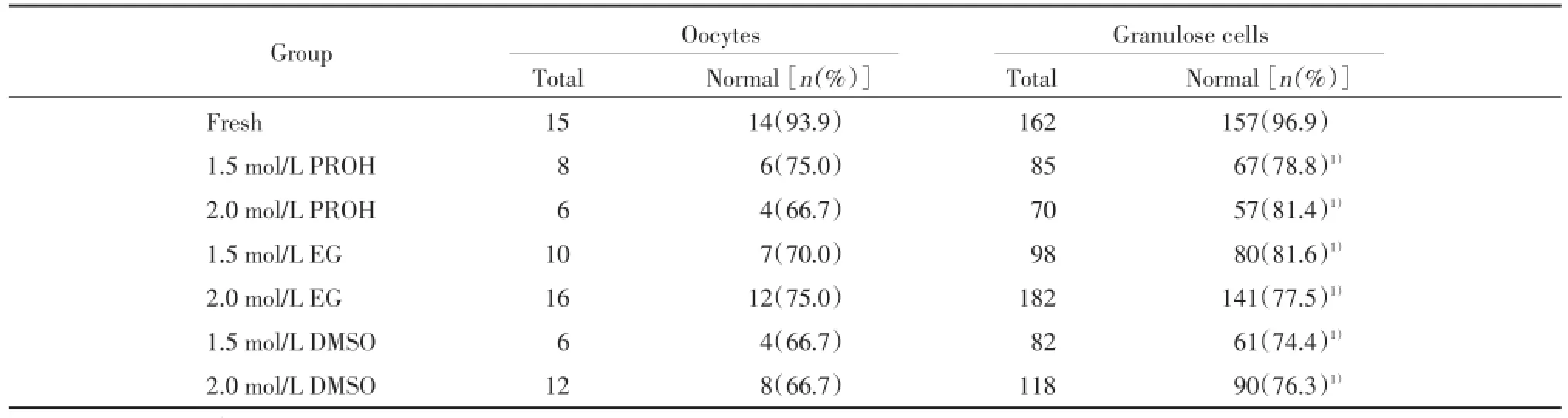
表2 超微结构评估新鲜及冷冻卵巢组织对卵子、颗粒细胞的影响Tab.2 Ultrastructure evaluation results of normal oocytes,granulose cells in fresh and frozen ovarian tissues
影响卵巢冷冻效果的因素较多,其中冷冻保护剂的类型、浓度、与卵巢组织接触的时间、作用时的温度等都会影响卵巢组织的冷冻效果。目前常用的渗透性冷冻保护剂包括PROH、EG、DMSO和甘油,非渗透性保护剂包括蔗糖等。其中EG是被普遍使用并被广泛接受的冷冻保护剂,因为它表现出低毒性,并且能很快的渗透进细胞内。DMSO是最适合组织冷冻的冷冻保护剂,它分子量较小,渗透力强,但细胞毒性大。有研究表明,高浓度的冷冻保护剂可能会加重卵巢组织冷冻损伤,引起更多的卵泡闭锁[11]。
本研究首次系统的比较了PROH、EG、DMSO作为冷冻保护剂,在不同的浓度(1.5和2.0 mol/L)时慢速程序化冷冻人卵巢组织的效果。冷冻复苏组织的完整性主要依赖于实验中新鲜对照组织的情况。由于不同患者之间卵泡的分布及密度差异很大,为了排除这种差异,我们利用同一患者获得的组织平行进行上述实验,这就将患者差异引起的数据偏差最小化。本研究获得的组织原始卵泡占57.7%,初级卵泡占36.7%,较文献报道的原始卵泡比例稍低,可能是由于随着年龄的增加,原始卵泡比例降低,生长期卵泡比例增加所致[12]。本研究结果显示,在冷冻保护剂平衡时间(4℃)和降温程序不变的前提下,仅改变冷冻保护剂的类型及浓度,光学显微镜下观察冷冻前后的卵泡形态学变化发现:1.5 mol/L EG组及2.0 mol/L EG组卵泡形态正常率低于新鲜对照组织,但差异无统计学意义(P>0.05)。而1.5 mol/L PROH组、2.0 mol/L PROH组、1.5 mol/L DMSO组、2.0 mol/L DMSO组与新鲜对照组织相比,卵泡形态正常率的差异均有统计学意义(P<0.05)。尽管2.0 mol/L EG组的卵泡形态正常率较1.5 mol/L EG组稍高,但由于冷冻保护剂浓度增高的同时也增加了其毒性,因此在卵泡形态正常率相近的情况下,浓度低的冷冻保护剂更有优势。
透射电镜观察发现冷冻组部分卵泡超微结构有一定的改变,主要表现为一些卵子的核膜结构不容易分辨,胞核及胞质出现模糊,内质网结构不能清晰辨认,线粒体肿胀,膜扩张,基质暗淡,胞质内空泡形成增加等。个别卵母细胞及颗粒细胞胞质中存在无细胞器区和空泡增多。有研究表明这些改变更容易发生在初级卵泡,这可能与初级卵泡代谢较原始卵泡旺盛,更容易发生冷冻损伤或组织离体后短时的缺血缺氧等有关[13]。本研究结果提示,经过冷冻后,卵母细胞的质量下降,但由于观察的数据较少,未进行统计学分析。与新鲜组织相比,经冷冻后颗粒细胞的活力明显降低(P<0.01)。卵母细胞和颗粒细胞之间存在着相互交流和相互作用。卵母细胞诱导颗粒细胞的增殖和分化,颗粒细胞则对卵母细胞起支持和营养作用。颗粒细胞活性的降低无疑会影响整个卵泡的发育,但由于每个卵泡周围会有十几个颗粒细胞,因此单个卵泡少量颗粒细胞的冷冻损伤并不会影响卵泡的正常发育,研究[14]证实了这一点。形态正常的颗粒细胞数量在2.0 mol/L PROH组及1.5 mol/L EG组中稍高,但各冷冻组间两两比较,形态正常颗粒细胞数量的差异无统计学意义。
本研究通过对3种不同的冷冻保护剂及不同的浓度进行研究发现:慢速程序化冷冻采用1.5 mol/L EG做为冷冻保护剂能较好的保存卵泡中的卵母细胞及颗粒细胞,是一种较好的冷冻卵巢组织的方案。
[1]Hovatta O,Silye R,Krausz T,et al.Cryopreservation of human ovarian tissue using dimethylsulphoxide and propanediol-sucrose as cryoprotectants[J].Hum Reprod,1996,11(6):1268-1272.
[2]Newton H,Aubard Y,Rutherford A,et al.Low temperature storage and grafting of human ovarian tissue[J].Hum Reprod,1996,11(7):1487-1491.
[3]Donnez J,Dolmans MM,Demylle D,et al.Live birth after orthotopic transplantation of cryopreserved ovarian tissue[J].Lancet,2004,364(9443):1405-1410.
[4]Gougeon A.Dynamics of follicular growth in the human:a model from preliminary results[J].Hum Reprod,1986,1(2):81-87.
[5]Hovatta O,Silye R,Abir R,et al.Extracellular matrix improves survival of both stored and fresh human primordial and primary ovarian follicles in long-term culture[J].Hum Reprod,1997,12(5):1032-1036.
[6]Sheikhi M,Hultenby K,Niklasson B,et al.Clinical grade vitrification of human ovarian tissue:an ultrastructural analysis of follicles and stroma in vitrified tissue[J].Hum Reprod,2011,26(3):549-603.
[7]Keros V,Xella S,Hultenby K,et al.Vitrification versus controlledrate freezing in cryopreservation of human ovarian tissue[J].Hum Reprod,2009,24(7):1670-1683.
[8]Meirow D,Levron J,Eldar-Geva T,et al.Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy[J].N Engl J Med,2005,353(3):318-321.
[9]Demeestere I,Simon P,Buxant F,et a1.Ovarian function and spontaneous pregnancy after combined heterotopic and orthotopic cryopreserved ovarian tissue transplantation in a patient previously treated with bone marrow transplantation:case report[J].Hum Reprod,2006,21(8):2010-2014.
[10]Andersen CY,Rosendahl M,Byskov AG,et a1.Two successful pregnancies following auto trans plantation of frozen/thawed ovarian tissue[J].Hum Reprod,2008,23(10):2266-2272.
[11]Huang L,Mo Y,Wang W,et a1.Cryopreservation of human ovarian tissue by solid-surface vitrification[J].Eur J Obstet Gynecol Reprod Biol,2008,139(2):193-198.
[12]Lass A,Silye R,Abrams DC,et al.Follicular density in ovarian biopsy of infertile women:a novel method to assess ovarian reserve[J].Hum Reprod,1997,12(5):1028-1031.
[13]Isachenko V,Lapidus I,Isachenko E,et al.Human ovarian tissue vitrification versus conventional freezing:morphological,endocrinological,and molecular biological evaluation[J].Reproduction,2009,138(2):319-327.
[14]Nottola SA,Camboni A,Van Langendonckt A,et a1.Cryopreservation and xenotransplantation of human ovarian tissue:an ultrastructural study[J].Fertil Steril,2008,90(1):23-32.
(编辑陈姜)
Preliminary Study of Human Ovarian Tissue Cryopreservation by Controlled-rate Freezing
LIU Li-ying,QUWen-yu,JIANGLi,ZHANGXiao-li,LIUXiao-li
(Department of Reproductive Central,Women’sand Children’s Hospital of Shenyang,Shenyang 110014,China)
ObjectiveTo compare the effect of different cryoprotectants and different concentrations on controlled-rate freezing of human ovarian tissues.MethodsOvarian tissues were sampled from 15 patients undergoing benign ovarian tumorsurgery.Corticalslices were frozen by controlledrate freezing using three cryoprotectants,propanediol,ethanediol,and dimethylsulphoxide,and the concentration of each cryoprotectant was 1.5 mol/Lor2.0 mol/L.Corticalslices obtained from each patient were processed with each cryopreservation procedure simultaneously.Morphology of follicles was studied by light and electron microscopy and the normal rate was compared with that of the fresh tissues from the patient.ResultsThere were no significant differences in distribution of follicles of different developmental stages between each group(P<0.05).Light microscopy showed 1.5 mol/L EG and 2.0 mol/L EG groups had the best freezing effect,and the difference in the morphologically normal rate of follicles was not statistically significant compared to fresh controls(P>0.05).However,the difference was statistically significant for 1.5 mol/L PROH,2.0 mol/L PROH,1.5 mol/L DMSO and 2.0 mol/LDMSO groups(P<0.05).Electron microscopy showed the oocyte quality declined after cont rolled-rate freezing procedure.However,the statistical analysis was not conducted due to little data.The viability of granulosa cells was significantly declined after all the freezing procedures compared to thatof the fresh controltissues(P<0.01).The number of morphologically normalgranulosa cells was slightly higher in the tissues which had been cryopreserved with 2.0 mol/L PROH and 1.5 mol/L EG,but no significant differences were found between any of two frozen groups(P>0.05).ConclusionControlled-rate freezing using 1.5 mol/L EG as the cryoprotectant can better save oocytes and granulosa cells.It is a preferable freezing procedure forovarian tissues.
cryopreservation;human ovarian tissues;ultrastructure;controlled-rate freezing
R71
A
0258-4646(2015)05-0425-05
沈阳市科委项目(F14-158-9-13)
刘丽英(1976-),女,副主任医师,博士. E-mail:llying007@sohu.com
2014-12-23
网络出版时间:
