抗骨桥蛋白抗体对胶原诱导大鼠类风湿关节炎作用的研究
2015-01-02宋颖高薇2刘义
宋颖,高薇2,刘义
(辽宁医学院1.药理学教研室;2.附属第一医院风湿免疫科,辽宁 锦州 121001)
抗骨桥蛋白抗体对胶原诱导大鼠类风湿关节炎作用的研究
宋颖1,高薇2,刘义1
(辽宁医学院1.药理学教研室;2.附属第一医院风湿免疫科,辽宁 锦州 121001)
目的研究抗骨桥蛋白抗体对类风湿关节炎大鼠滑膜组织的保护作用及机制。方法40只SD大鼠,随机抽取6只为正常对照组,34只建立胶原诱导的类风湿关节炎模型;选取24只关节炎指数>2的大鼠(其余10只剔除),随机分为模型组、抗骨桥蛋白抗体低、中和高剂量治疗组。记录大鼠体质量、关节炎指数和左后足足趾容积。第35天处死大鼠,取其关节进行HE染色,观察关节病理学改变;Western blot检测滑膜组织内骨桥蛋白(OPN)和肿瘤坏死因子α(TNF-α)蛋白表达情况;ELISA检测大鼠血液内OPN和TNF-α含量的变化。结果治疗组大鼠体质量第16天平稳上升,给药后关节肿胀逐步缓解。与正常组比较,模型组体质量、足趾容积和关节炎指数差异有统计学意义(P<0.05)。与模型组比较,治疗组体质量、足趾容积和关节炎指数差异有统计学意义(P<0.05)。治疗组可见滑膜细胞增生明显减轻,少量炎性细胞浸润,关节软骨表面光滑,未见破坏。与正常组比较,模型组OPN蛋白表达明显升高,差异有统计学意义(P<0.05);与模型组比较,治疗组OPN蛋白表达明显降低,差异有统计学意义(P<0.05);与正常组比较,模型组TNF-α表达明显升高,差异有统计学意义(P<0.05)。结论抗骨桥蛋白抗体可明显减轻CIA模型大鼠的关节症状,抑制滑膜细胞增生,减轻炎性反应。抗骨桥蛋白抗体保护CIA模型大鼠关节过程中,抑制大鼠滑膜组织及血清中OPN的表达,不影响TNF-α的表达。
抗骨桥蛋白抗体;类风湿关节炎;骨桥蛋白;肿瘤坏死因子α
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,以关节滑膜炎症为主要病理表现[1]。RA的主要危害在于其致残性,不完全统计未接受早期合理规范化治疗的RA患者,70%患者于3年之内出现不同程度的关节破坏以及关节畸形[2],是目前造成人类残疾的主要疾病之一,严重影响患者的生活质量[3,4]。
现阶段对RA的治疗主要采用的有传统治疗和生物制剂治疗两种方案,但均存在不足之处[5,6]。骨桥蛋白(osteopontin,OPN),被称为早期T淋巴细胞激活因子1,是一个潜在的与炎性反应相关的促炎性因子[7]。它是一种具有促进巨噬细胞分泌干扰素γ(interferon-γ,IFN-γ)和白介素12(nterleukin-12,IL-12)的作用的细胞外基质蛋白,属于Th1细胞因子家族的一员。在滑膜细胞表面存在众多OPN的受体,主要包括整合素αvβ3、α4β1、αvβ1和CD44等。OPN可以与这些细胞表面受体结合,从而诱导信号转导,影响滑膜细胞的黏附和增殖[8]。目前研究显示OPN在免疫系统中具有重要作用,其促进树突状细胞及巨噬细胞向炎症部位聚集[9]。应用OPN基因缺陷小鼠制备胶原诱导型关节炎(collagen induced arthritis,CIA)模型的成模率较正常小鼠显著降低。同时提示RA患者滑膜组织内OPN的mRNA及其蛋白的表达异常增加,其主要表达部位为异常生长的的血管翳上,可促进软骨内血管翳及滑膜组织的增生[10],以上均说明OPN可能在RA的疾病进展中起到重要作用。
在RA疾病活动中,可以见到类肿瘤样生长的滑膜细胞及成纤维细胞,其中大量的金属蛋白酶,对抗原起到呈递功能,可以分泌出不同类型的细胞因子,如粒细胞、巨噬-细胞刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)、白介素1(nterleukin-1,IL-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素8(nterleukin-8,IL-8)等,这些细胞因子均可参与巨噬细胞和软骨细胞的相互作用。研究表明,这些因子的异常表达最终导致RA后期软骨的破坏[11~13]。因此,在RA疾病活动中,滑膜及血液内TNF-α及OPN含量的变化可以反映疾病的进展及活动情况。
本实验拟通过观察不同效价抗骨桥蛋白抗体对CIA模型大鼠的治疗作用,观察不同效价的抗骨桥蛋白抗体对大鼠体内OPN和TNF-α表达的影响,为抗骨桥蛋白抗体在RA领域的应用提供实验基础。
1 材料与方法
1.1 实验动物
清洁级SD大鼠40只,体质量为(200±20)g,雄性,由辽宁医学院实验动物中心提供,动物许可证号:SCXK(辽)2003-0007,实验动物操作过程遵循实验动物福利要求并获辽宁医学院实验动物伦理委员会批准。
1.2 试剂
抗骨桥蛋白抗体、ELISA试剂盒购自大连宝生物公司;鸡Ⅱ型胶原(CCⅡ)、不完全弗氏佐剂购自Sigma公司;OPN单克隆抗体、抗TNF-α抗体、碱性磷酶标记的羊抗兔抗体、内参照等购自Santa Cruz公司;其他常规试剂由辽宁医学院附属第一医院中心实验室提供。
1.3 实验分组
40只SD大鼠适应性饲养1周,随机选取6只,作为正常组,其余34只均建立CIA模型。于实验第9天,选取关节炎指数>2的大鼠24只,随机分为模型组,低、中和高剂量治疗组。
1.4 CIA模型建立
大鼠用10%水合氯醛(0.3 mL/100 g)麻醉,除正常组外,其余大鼠均于鼠爪及背部多点皮下注射配置好的Ⅱ型胶原蛋白溶剂,每只总量为0.8 mL,7 d后上述方法再次免疫。正常组大鼠在相同部位注射等剂量生理盐水。第15天,正常组及模型组大鼠鼠尾静脉隔日注射0.15 mL生理盐水,共7次;低、中和高剂量治疗组大鼠鼠尾静脉隔日注射抗骨桥蛋白抗体溶液0.15 mL,效价分别为1∶64,1∶32,1∶16,共7次。35 d后处死大鼠,取左后足(包括踝关节),10%甲醛固定24 h,脱钙液脱钙2周,纵向刨开关节,常规脱水,包埋,切片;分离双侧膝关节滑膜组织,-80℃冰箱冻存备用;抽取静脉血5 mL,离心抽取上层血清,-20℃冰箱冻存备用。
1.5 一般情况观察
每日观察大鼠体毛色泽、摄食和活动状况,每7 d测定大鼠体质量1次,每7 d使用自制鼠爪容积测量器,测量大鼠左后足踝关节以下鼠爪容积。鼠爪容积测定方法采用排水法测定足部容积:在大鼠左后足部踝骨关节突出部位画一条线作为标记,用一特制量筒,灌满水后,将大鼠足部插入,使水面与踝骨标记处处于同一界面,另用一个烧杯接住从侧口排除的水,测量水的体积,即为所测大鼠足部的体积,每只足重复测量5次。
1.6 关节炎指数(arthritis index,AI)评价
根据大鼠关节肿胀、颜色及关节活动情况评价并记录大鼠全身关节病变程度,自实验第1天起,每7 d评定1次。评定方法如下:大鼠肢体病变程度累积积分为AI,最高分为16分,最低分为0分。0分:无红肿;1分:小趾关节轻微肿胀;2分:趾关节及足趾关节肿胀;3分:踝关节以下的足趾关节肿胀;4分:包括踝关节在内的全足肿胀。
1.7 HE染色观察关节滑膜组织及病理学变化
大鼠左后足经脱钙后,行常规石蜡包埋,切片染色后制成HE染色图片,置于显微镜下观察踝及跖趾关节滑膜增生、炎性细胞浸润以及软骨及骨组织破坏等病理学变化。
1.8 Western blot测定滑膜组织中OPN和TNF-α的表达
将冻存的滑膜组织置于蛋白裂解液中裂解提取总蛋白,利用BCA试剂盒检测各组蛋白浓度;配制5%浓缩胶与8%分离胶,60 V×30 min,150 V×1 h进行聚丙烯酰胺凝胶电泳,电泳结束后取下分离胶洗涤3次放入转膜仪,以100 mA×30 min进行转膜,转膜后孵育一抗(1∶1 500),4℃摇摆过夜,洗膜后继续孵育二抗(1∶1 000)及显影液,室温避光孵育30 min,洗脱液洗涤3次终止显色反应,凝胶成像系统分析膜上目的条带与内参照OD值。重复实验3次,计算相对OD值。
1.9 ELISA法检测大鼠血清内OPN和TNF-α含量
设空白孔,依照次序对应加入标准品50 μL于空白微孔中(空白孔视为0号标准品);在标准品孔和样品孔中加入50 μL的生物素标记的抗体,震荡混匀,37℃恒温箱孵育45 min;甩去孔内液体,每孔中加满应用洗涤液,震荡30 s,用吸水纸排干,重复4次;在标准品孔和样品孔中加入100 μL的亲和链霉素-HRP,震荡摇匀;37℃恒温箱孵育30 min;甩去孔内液体,每孔中加满应用洗涤液,震荡30 s,用吸水纸排干,重复4次;每孔中加入底物A 50 μL后立刻加入底物B 50 μL,震荡混匀,37℃恒温箱避光孵育5 min;每孔中加入50 μL的终止液;490 nm(OPN)、450 nm(TNF-α)处读取OD值。
1.10 统计学处理
采用SPSS 18.0 for Windows软件包对所得结果进行统计学分析。计量资料用x±s表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 抗骨桥蛋白抗体对CIA模型大鼠一般情况的影响
以实验第9天关节炎指数>2为造模成功标准,成功复制模型27只,其中未发病2只,死亡5只。以初次免疫为实验第1天,实验期间正常组大鼠一般状况良好,体质量持续上升,毛发光泽,喜动,摄食正常;模型组和治疗组大鼠于实验第3天开始出现鼠爪红肿现象,至第15天关节肿胀最为严重,以双侧后踝关节肿胀最为明显,足爪皮肤充血,皮温增高,足垫增厚,少数大鼠尾部出现红斑或破溃,第16 d起肿胀缓解,继而出现关节不能负重,并陆续出现关节强直,活动及摄食减少,体质量下降,暴躁易怒;与模型组比较,治疗组经治疗后,关节肿胀、皮肤充血等情况均较轻,毛发光泽正常,体质量上升(P<0.05),未出现关节强直(图1)。
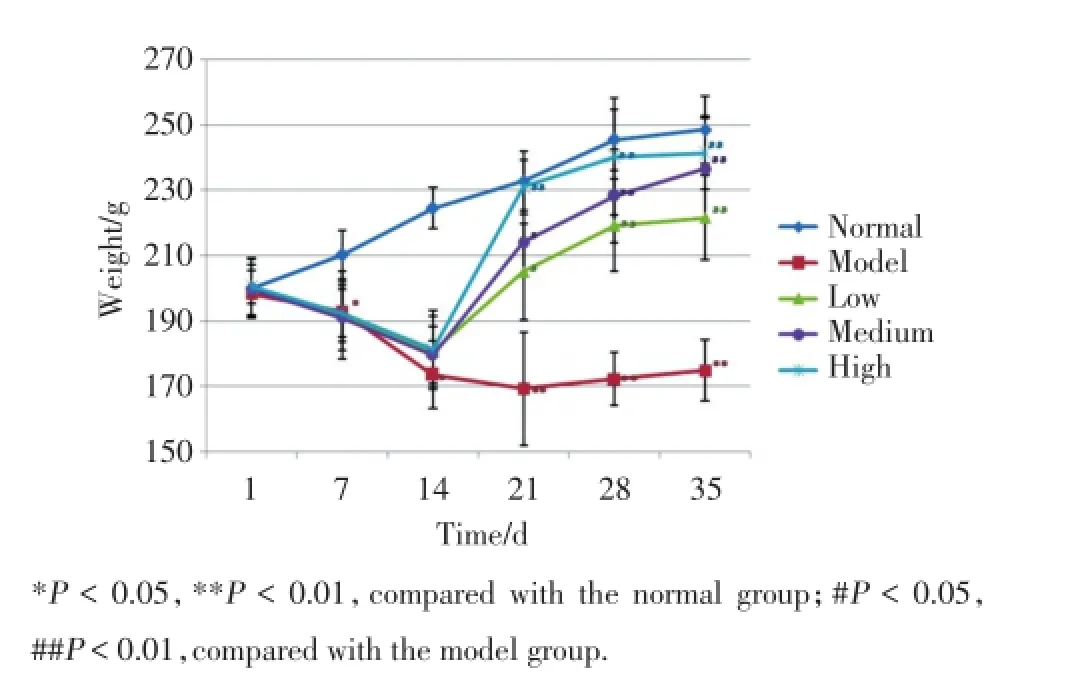
图1 抗骨桥蛋白抗体对CIA模型大鼠体重的影响Fig.1 Effect of anti-OPN on the weight of CIA rats
2.2 抗骨桥蛋白抗体对CIA模型大鼠鼠爪肿胀程度的影响
模型组于初次免疫后,出现鼠爪肿胀,肿胀程度随时间推移逐步加重,以双侧后足及踝关节最为明显,关节局部皮肤出血,皮温升高,足垫增厚,少数出现红斑及溃疡;治疗各组大鼠在药物干预前,鼠爪变化同模型组,出现鼠爪红肿,活动减少,易怒等表现,经抗骨桥蛋白抗体治疗后可见鼠爪肿胀程度减轻。与正常组比较,模型组足趾容积和关节炎指数明显升高,差异具有统计学意义(P<0.01)。与模型组比较,低和中剂量治疗组足趾容积和关节炎指数降低,差异有统计学意义(P<0.05),高剂量治疗组足趾容积和关节炎指数明显降低,差异有统计学意义(P<0.01),见图2、3。
2.3 抗骨桥蛋白抗体对CIA模型大鼠滑膜组织显微结构的影响
HE染色可见正常组关节滑膜衬里层约1~2层,部分不可见,滑膜内未见炎性细胞浸润,未发现血管增生,关节软骨表面光滑,未见破坏或断裂;在模型组中可见关节滑膜衬里层增厚,约为20~30层不等,细胞排列稀疏,滑膜内可见大量炎性细胞浸润,局部可见典型血管翳形成,可见少数血管翳从软骨表面生长,侵入软骨,造成软骨及骨组织破坏,少数镜下可见骨性融合;治疗各组与正常组相比呈病理性改变,但与模型组相比,衬里层滑膜层增生较少,滑膜内少量或未见炎性细胞浸润,少量可见血管翳形成,未侵入软骨表面,关节软骨表面较光滑,无明显骨质破坏(图4)。
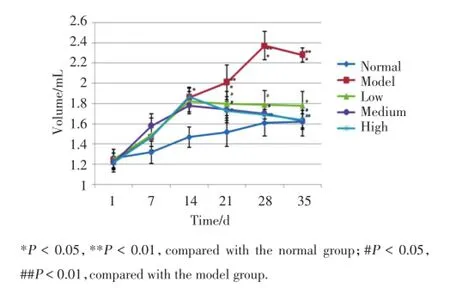
图2 抗骨桥蛋白抗体对CIA模型大鼠鼠爪足趾容积的影响Fig.2 Effect of anti-OPN on the volume of CIA rats
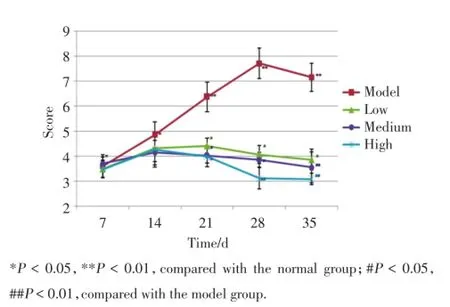
图3 抗骨桥蛋白抗体对CIA模型大鼠关节炎分数的影响Fig.3 Effect of anti-OPN on the scroes of CIA rats
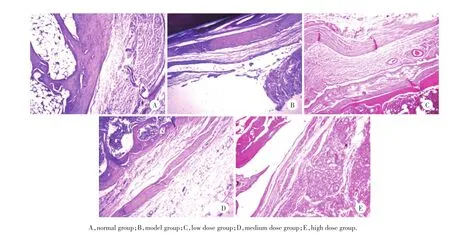
图4 抗骨桥蛋白抗体对CIA模型大鼠滑膜组织显微结构的影响 HE×200Fig.4 Effect of anti-OPN on microstructure of the synovial tissue of CIA rats HE×200
2.4 抗骨桥蛋白抗体对滑膜组织OPN和TNF-α蛋白表达的影响
与正常组比较,模型组大鼠滑膜组织内OPN蛋白表达明显升高,差异具有显著统计学意义(P<0.01)。与模型组比较,低和中剂量治疗组OPN蛋白表达降低,差异有统计学意义(P<0.05),高剂量治疗组OPN蛋白表达显著降低,差异具有统计学意义(P<0.01);与正常组比较,模型组TNF-α表达明显升高,组间差异有统计学意义(P<0.01);与模型组比较,低、中和高剂量治疗组TNF-α表达,组间差异均无统计学意义(P>0.05,图5)。

图5 抗骨桥蛋白抗体对滑膜组织OPN和TNF-α蛋白表达的影响Fig.5 Effect of anti-OPN on the expression of OPN and TNF-α in synovial tissue
2.5 抗骨桥蛋白抗体对CIA模型大鼠血清OPN和TNF-α表达水平的影响
结果显示:与正常组比较,模型组大鼠血清内OPN水平表达明显升高,差异具有统计学意义(P<0.01)。与模型组比较,低和中剂量治疗组OPN水平表达降低,差异有统计学意义(P<0.05),高剂量治疗组OPN水平表达显著降低,差异具有统计学意义(P<0.01);与正常组比较,模型组TNF-α表达明显升高,组间差异有统计学意义(P<0.01);与模型组比较,低、中和高剂量治疗组TNF-α表达,组间差异均无统计学意义(P>0.05,图6)。
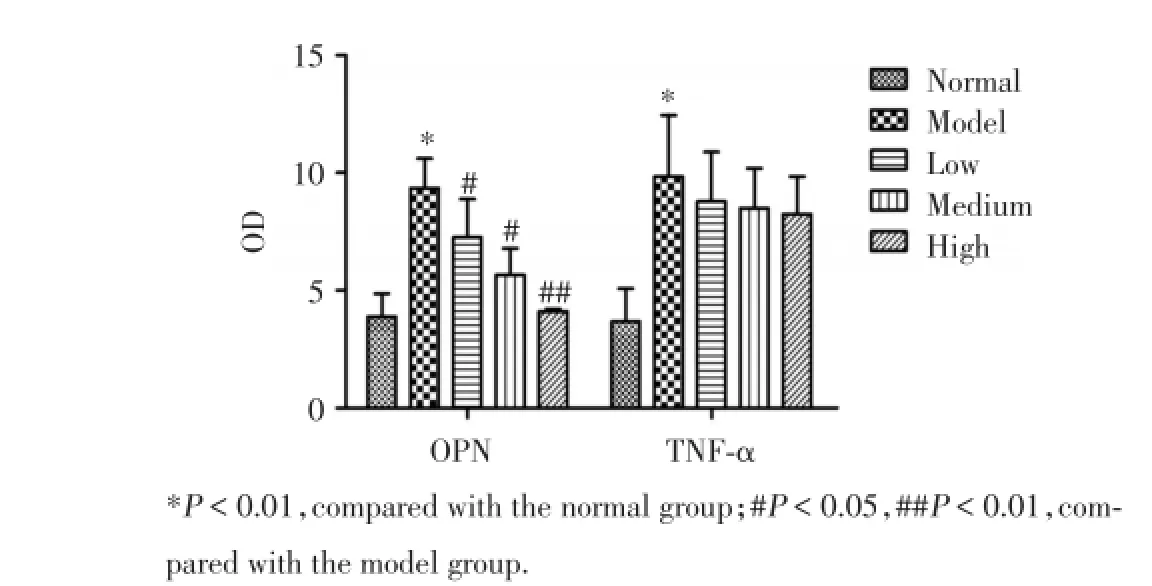
图6 抗骨桥蛋白抗体对CIA模型大鼠血清OPN和TNF-α表达水平的影响Fig.6 Effect of anti-OPN on the expression of OPN and TNF-α in serum
3 讨论
实验研究表明,CIA模型大鼠被认为是RA的良好模型,在发病机制、免疫、遗传特征等方面具有高度的特异性,通过胶原诱导制备的RA大鼠最接近于人类RA的发病过程[14]。在本实验造模中,可见成模大鼠关节骨质破坏、部分强直融合、畸形,HE染色可见关节表面血管翳形成、滑膜增厚,这些均与文献报道一致,提示模型制作成功。
通过一般观察发现,通过抗骨桥蛋白抗体治疗后,治疗组大鼠的一般状态(体质量、毛发色泽、毛发密度、关节活动度)均优于模型组大鼠,大鼠关节未见强直及活动受限,说明抗骨桥蛋白抗体对大鼠CIA模型有良好的治疗作用及关节保护作用。通过对滑膜组织及血清检查提示抗骨桥蛋白抗体治疗后可显著减少CIA大鼠滑膜及血清内OPN的表达,但未能显著改变TNF-α的表达。目前在RA的治疗中,处于主导地位的是应用TNF-α抑制剂,减少RA患者体内TNF-α的表达,但这不可避免的要引起感染加重、结核复发甚至诱发肿瘤等诸多问题,这些不良反应主要是因为TNF-α本身在机体内具有较强的抗炎作用。本实验探索OPN作为RA治疗的新靶点的可行性及安全性,在实验中给药组大鼠无死亡,无精神萎靡,毛发光滑,摄食正常,说明抗骨桥蛋白抗体在应用上具有较高的安全性。
OPN是促进关节炎进展的重要因子,OPN可以加重炎性反应,并促进软骨的破坏[15]。在自身免疫性疾病中,都可以查到患者体内OPN的水平显著高于正常人。我们的实验显示,OPN在RA患者血清中的浓度较正常对照组明显升高,与既往实验结果一致[16]。进一步分析发现活动组OPN水平较非活动组显著升高,提示OPN浓度高低和RA疾病活动性有关,提示OPN可能是评价疾病活动性和严重程度的一个独立的实验室指标。有报道OPN-/-小鼠关节软骨破坏程度明显轻于OPN+/+小鼠。在骨组织中,OPN可促进破骨细胞粘附到骨基质从而促进骨的吸收。OPN可通过激活MMPs和NF-κB活性促进破骨细胞的形成,这些均能加速关节软骨的破坏[17]。上述均说明通过降低OPN水平能够达到对RA的治疗效果。
在本实验中,抗骨桥蛋白抗体对CIA模型大鼠的治疗效果明显,抗骨桥蛋白抗体保护CIA模型大鼠关节过程中,可以抑制大鼠滑膜组织及血清中OPN的表达,同时并不影响TNF-α的表达。与模型组比较,治疗组大鼠体质量、关节炎指数、鼠爪肿胀程度和滑膜组织病理学改变均优于模型组;而在滑膜组织及血清检测中可见,治疗组大鼠血清内OPN含量显著减少,说明经静脉给药后,抗骨桥蛋白抗体可抑制大鼠体内OPN的表达,从而达到对RA的治疗作用。高剂量治疗组上述指标与模型组比较,均具有显著统计学意义,考虑抗骨桥蛋白抗体治疗RA呈浓度依赖性。
[1]Al-Ghamdi AL,Attar SM.Extra-articular manifestations of rheumatoid arthritis:a hospital-based study[J].Ann Saudi Med,2009,29(3):189-193.
[2]严雅,管剑龙,何东仪.类风湿关节炎患者院内感染影响因子调查分析[J].上海预防医学杂志,2011,23(10):503-506.
[3]Pugner KM,Scott DI,Holmes JW,et al.The costs of rheumatoid arthritis:an international long-term view[J].Semin Arthritis Rheum,2000,29(5):305-320.
[4]陈育尧,佟丽,吴启富,等.寒湿痹片对类风湿关节炎大鼠踝关节组织病理改变的影响[J].浙江中西医结合杂志,2010,20(1):12-14.
[5]何晓瑾,夏卫军,金实.痛痹方对佐剂性关节炎大鼠踝关节组织病理改变的影响[J].中国中医药信息杂志,2007,14(4):44-46.
[6]Kerr,Amsden BG,Waldman SD.Chondrocyte repopulation of the zone of death induced by osteochondral harvest[J].Osteoarthritis Cartilage,1972,19(2):242-248.
[7]徐素粉,赵福涛,赵浩,等.FasL基因关节腔内转染对佐剂性关节炎大鼠滑膜细胞凋亡的影响[J].医学综述,2012,18(3):443-445.
[8]袁易,王旭慧.消瘤1号通过影响bax和bcl-2的表达诱导人乳腺癌细胞MCF-7凋亡[J].药学服务与研究,2010,10(4):267-270.
[9]Niture SK,Jaiswal AK.Nrf2-induced antiapoptotic Bcl-xL protein enhances cell survival and drug resistance[J].Free Radic Biol Med,2013,57:119-131.
[10]Peng CY,Hu L,Wu ZJ,et al.Study on the effect of moxibustion in treating rhreumatoid arthritis rats and its mechanism[J].J Acupunct Tuina Sci,2012,10(6):336-341.
[11]刘元刚,刘树滔,饶平凡.类风湿性关节炎啮齿动物模型的研究进展[J].中国实验动物学报,2007,15(6):470-473.
[12]Goronzy JJ,Weyand CM.Developments in the scientific understanding of rheumatoid arthritis[J].Arthritis Res Ther,2009,11(5):249-255.
[13]Stump KL,Lu LD,Dobrzanski P,et al.A highly selective,orally active inhibitor of Janus kinase 2,CEP-33779,ablates disease in two mouse models of rheumatoid arthritis[J].Arthritis Res Ther,2011,13(2):R68.
[14]Sun T,Lin X,Wei Y,et al.Evaluating bistability of Bax activation switch[J].FEBS Lett,2010,584(5):954-960.
[15]Dorai H,Ellis D,Keung YS,et al.Combining high-throughput screening of caspase activity with antiapoptosis genes for development of robust CHO production cell lines[J].Biotechnol Prog,2010,26(5):1367-1381.
[16]Kirkland RA,Saavedra GM,Cummings BS,et al.Bax regulates production of superoxide in both apoptotic and nonapoptotic neurons:role of caspases[J].J Neurosci,2010,30(8):16114-16127.
[17]Audo R,Combe B,Coulet B,et al.The pleiotropic effect of TRAIL on tumor-like synovial fibroblasts from rheumatoid arthritis patients is mediated by caspases[J].Cell Death Differ,2009,16(9):1227-1237.
(编辑裘孝琦)
Study on the Effect of Anti Osteopontin Antibody in Treating Rats’Collagen Induced Rheumatoid Arthritis
SONG Ying1,GAOWei2,LIUYi1
(1.Department of Pharmacology,Liaoning Medical University,Jinzhou 121001,China;2.Department of Rheumatology and Immunology,The First Affiliated Hospital of Liaoning Medical University,Jinzhou 121001,China)
Objective To investigate the anti-OPN antibody′s protective effect towards the synovial membrane of rats with rheumatoid arthritis,including the mechanism of such protective action.MethodsFrom a total of 40 SD rats,6 were randomly selected as the normal control group while the remaining 34 were used to establish the collagen induced arthritis model.A total of24 rats with arthritis index higher than 2 were chosen(excluding the rest 10 rats),and randomly divided into model group and groups being treated with low,medium and high dose of anti-OPN anti-body,respectively.Weight,arthritis index and the volume of the left hind leg toe of the rats were recorded.Then on day 35,the rats were killed and their joints were taken out to make HE colored sections for observation of the pathological changes.The synovial membrane of each rat was taken out and WB method was used to test the protein expression of OPN and TNF-α in such membrane.ELISA method was used to test the change of the content ofOPN and TNF-αin each rat′s blood.ResultsThe rats in treatment group gained weight steadily from day 16 and their swollen joints were gradually relieved upon medication.Comparing with the control group,the differences in weight,toe volume and arthritis index of the rats in model group were statistically significant(P<0.05).Comparing with the model group,the differences in weight,toe volume and arthritis index of the rats in the treatment groups were also statistically significant(P<0.05).Pathologic change of synovial membrane:for rats in treatment groups,synovial cell hyperplasia was visibly reduced with a little inflammatory cell infiltration and smooth articular cartilage surfaces with no visible damage.Expression of OPN and TNF-α in synovial membrane and blood serum of rats:Judging from the OPN measured in synovial membrane and blood serum,we could see that the expression of OPN in rats of the model group increased obviously if compared with the control group.Comparing with the model group,the expression of OPN in the treatment groups was reduced(P<0.05).Judging from the TNF-α measured in synovial membrane and blood serum,we could see that the expression ofTNF-αin rats of the model group increased obviously if compared with the control group,thus such difference was statistically significant between different groups(P<0.05).ConclusionThe anti-OPN anti-body could significantly reduce the articular symp-toms of the ratswith collagen induced arthritis,restrain the synovial cell hyperplasia and alleviate the inflammatory reaction.In the process of protecting the joints of the rats with collagen induced arthritis,anti-OPN anti-body restrained only the expression of OPN in the synovial membrane and blood serum,leaving the expression of TNF-αunaffected.
anti-osteapontin antibody;rheumatoid arthritis;osteapontin;TNF-α
R593.2
A
0258-4646(2015)05-0405-06
辽宁省自然科学基金(2014022017)
宋颖(1982-),女,硕士研究生.
刘义,E-mail:liuyi2014lnjz@163.com
2014-10-24
网络出版时间:
