miR-206/miR-1对乳腺癌干细胞增殖的影响及作用机制
2015-01-02
(中国医科大学附属第一医院肿瘤研究所二室,沈阳 110001)
miR-206/miR-1对乳腺癌干细胞增殖的影响及作用机制
孟琳,王天一,李晓曦,马萍
(中国医科大学附属第一医院肿瘤研究所二室,沈阳 110001)
目的探讨上调microRNA-206(miR-206)和microRNA-1(miR-1)表达对乳腺癌干细胞增殖的影响以及其作用机制。方法采用流式细胞分选技术从乳腺癌细胞株MCF-7中分离出乳腺癌干细胞。实验分为空白对照组、阴性对照组、miR-206转染组、miR-1转染组。除空白对照组外,其他各组分别转染阴性对照mimic、hsa-miR-206mimic、hsa-miR-1 mimic。应用实时定量PCR检测miR-206、miR-1以及转录因子EVI-1基因的表达水平;Western blot法检测EVI-1蛋白的表达;应用MTT法检测miR-206、miR-1对乳腺癌干细胞增殖能力的影响。结果从MCF-7细胞系中分选出CD44+/CD24-/low乳腺癌干细胞,经无血清培养后可以成功传代,用于后续试验;转染hsa-miR-206 mimic、hsa-miR-1 mimic 48 h后miR-206、miR-1相对表达水平提高,EVI-1 mRNA表达水平明显下降;Western blot、MTT结果显示,上调miR-206和miR-1表达水平后显著降低EVI-1蛋白的表达,抑制了乳腺癌干细胞增殖能力。乳腺癌干细胞中miR-206、miR-1表达水平以及EVI-1蛋白表达水平的差异有统计学意义(P<0.05)。结论上调miR-206和miR-1表达能够抑制乳腺癌干细胞增殖能力,其机制可能与下调EVI-1的表达有关。
microRNA;乳腺癌;肿瘤干细胞;miR-206;miR-1
乳腺癌是女性最常见恶性肿瘤之一。目前乳腺癌治疗常用的手术、放疗、化疗、内分泌治疗等手段已经取得巨大进步,使患者获得较高生存率。然而,乳腺癌的远处转移、术后复发等问题仍未解决。近年来肿瘤干细胞理论的蓬勃发展,为肿瘤产生、进展和复发提供了新的理论基础。肿瘤干细胞是一群具有自我更新、多向分化和恶性增殖潜能的干细胞性肿瘤细胞。乳腺癌干细胞以CD44+/CD24-/low为标志[1],已经得到普遍公认[2~5]。其不仅具有较高的致瘤性[6],而且乳腺癌干细胞在癌细胞中所占比例直接关系到患者预后和复发[7],提示乳腺癌干细胞可能是放化疗失败、肿瘤复发和转移的基础。
微小RNA(microRNA,miRNA)是一类长度为20~24个核苷酸的非编码小RNA分子,主要通过与靶基因mRNA 3′非翻译区的完全或不完全互补配对,降解靶基因的mRNA或抑制其翻译,参与调控细胞发育、增殖、分化、凋亡等过程[8]。成熟的miR-206和miR-1只相差4个核苷酸,两者靶基因互补配对区域高度相似。miR-206和miR-1作为抑癌miRNA在乳腺癌、肝癌、肺癌等肿瘤组织中表达下调,主要发挥抑制肿瘤生长、迁移和侵袭等作用。
亲病毒整合位点1蛋白(ecotropic virus integration-1,EVI-1)又称MDS1和EVI-1复合体蛋白,属于锌指转录因子。研究发现EVI-1可能通过促进乳腺癌细胞生长、侵袭和上皮间质转化等相关基因的表达,发挥致癌作用。通过TargetScan和miRanda等生物信息学软件对转录因子EVI-1基因的靶向miRNA进行了分析,预测在EVI-1 mRNA 3′非翻译区存在miR-206和miR-1的结合位点,推测EVI-1可能是miR-206、miR-1下游的靶基因之一。本研究旨在探讨miR-206、miR-1对乳腺癌干细胞增殖能力以及对EVI-1表达的影响,以期寻找到miRNA调节乳腺癌干细胞生物学功能的分子机制,为乳腺癌的治疗提供新靶点。
1 材料与方法
1.1 材料
人乳腺癌细胞株MCF-7由本实验室保存;DMEM培养基和DMEM/F12培养基(美国Corning公司);鼠抗人CD44-PE单克隆抗体、鼠抗人CD24-FICT单克隆抗体、兔抗人EVI-1单克隆抗体(英国Abcam公司);B27、表皮生长因子、碱性成纤维细胞生长因子(美国Peprotech公司);胰岛素(美国SIGMA公司),microRNA mimic(中国上海吉玛公司);Lipofectamine 2000(美国Invitrogen公司);RT-PCR相关试剂盒(日本Takara公司);MTT试剂盒(中国凯基生物)。
1.2 方法
1.2.1 乳腺癌干细胞分选及培养:收集处在生长对数期的MCF-7细胞,经胰酶消化后反复吹打制成单细胞悬液,收集在50 mL离心管中,经1 000 r/min离心5 min后,弃上清重悬,行细胞计数,当细胞计数达到1×107/mL时,分别装入4个流式管中,每个流式管300 μL细胞悬液,设4管细胞,分别为空白细胞、CD44-PE单克隆抗体单标、CD24-FITC单克隆抗体单标以及CD44-PE单克隆抗体、CD24-FITC单克隆抗体双标。避光4℃孵育40 min,后用流式细胞仪检测CD44+/CD24-/low乳腺干细胞所占比例。
将CD44-PE单克隆抗体、CD24-FITC单克隆抗体加入到装有MCF-7细胞的50 mL离心管中,避光4℃孵育40 min后进行细胞分选,分选得到的CD44+/CD24-/low乳腺干细胞在含B27(2%)、表皮生长因子(20 ng/mL)、碱性成纤维细胞生长因子(20 ng/mL)、胰岛素(5 mg/mL)、双抗(100 IU/mL)的DMEM/F12培养基中,在37℃、5%CO2的培养箱中进行培养,每2~3 d更换培养液1次。
1.2.2 miRNA mimic转染乳腺癌干细胞:实验分为4组:空白对照组、阴性对照组(转染阴性对照mimic)、miR-206转染组(转染hsa-miR-206mimic)、miR-1转染组(转染hsa-miR-1 mimic)。阴性对照mimic序列:正义链5′-UUCUUCGAACGUGUCACGUTT-3′;反义链5′-ACGUGACACGUUCGGAGAATT-3′;hsa-miR-206mimic序列:正义链5′-UGGAAUGUAA GGAAGUGUGUGG-3′;反义链5′-ACACACUUCCUU ACAUUCCAUU-3′;hsa-miR-1 mimic序列:正义链5′-UGGAAUGUAAAGAAGUAUGUAU-3′;反义链5′-ACAUACUUCUUUACAUUCCAUU-3′。培养的乳腺癌干细胞在指对数生长期时铺于6孔板中,1 d后进行转染。每孔取37℃预热无血清DMEM/F12培养基稀释mimic后加Lipofectamine 2000转染试剂。将培养板置于37℃的CO2培养箱中培养48 h后用于进一步实验。
1.2.3 实时定量PCR检测:以MCF-7乳腺癌细胞为对照,使用Trizol法提取上述空白对照组、阴性对照组和转染组乳腺癌干细胞总RNA,用紫外分光光度计测量RNA的纯度和浓度。选用OD260/0D280比值为1.8~2.2的RNA进行逆转录,其余存于-80℃冰箱备用。
制备逆转录混合反应液,加入总RNA和所有试剂后在PCR扩增仪中进行逆转录反应,反应条件为Poly(A)加尾和反转录反应:37℃60 min;85℃5 s。以其产物cDNA为模板,每组样本设3个复孔,以U6为内参,分别用miR-206、miR-1的引物(表1)进行实时PCR反应。反应条件:95℃10 s;95℃5 s,60℃20 s,共40个循环。扩增转录因子EVI-1 mRNA,反应条件:37℃15 min;85℃5 s。后进行实时PCR反应,以GAPDH为内参,反应条件:95℃30 s;95℃5 s,60℃30 s,共40个循环。
1.2.4 Western blot法检测乳腺癌干细胞中EVI-1蛋白的表达:收集各转染组72 h后生长状态良好的乳腺癌干细胞,用PBS洗2次后加入细胞裂解液,作用30 min后4℃12 000 r/m离心20 min,收集上清并测定蛋白含量。取适量总蛋白电泳后转膜,封闭2 h,然后分别与GAPDH抗体(内参)、兔抗人EVI-1蛋白抗体(1∶1 000)4℃孵育过夜。PBST洗膜3次后接着加入二抗羊抗兔IgG(1∶1 500)室温孵育2 h,PBST洗膜3次。最后化学发光底物显应,凝胶成像。
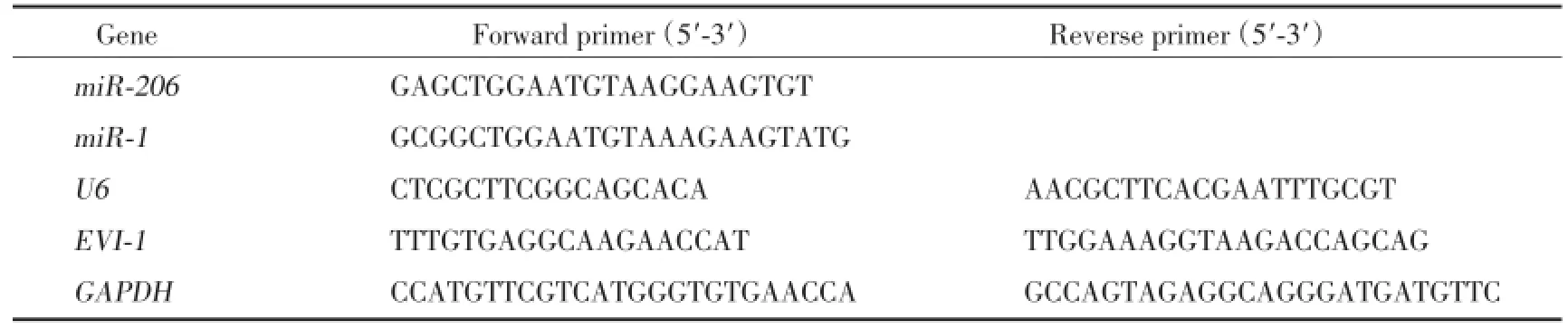
表1 实时定量PCR引物序列Tab.1 RT-PCR primer sequences
1.2.5 MTT法检测miR-206、miR-1对乳腺癌干细胞增殖能力的影响:收集未经转染的乳腺癌干细胞,调整细胞浓度为1×105/mL。实验分为4组,每组有3个复孔。分别向6块96孔板中每孔加入100 μL细胞悬液,37℃、5%CO2培养过夜24 h后,除空白对照组外其余各组分别加入阴性对照mimic、hsa-miR-206mimic、hsa-miR-1mimic,同时留有1组不加细胞只加培养基作为校正。分别于6、12、24、48、72、96 h取出1块孔板,向每孔加入50 μL MTT溶液,再孵育4 h后小心吸去上清,向每孔加入150 μL二甲基亚砜,置于摇床上低速振荡10 min。用酶联免疫检测仪在490 nm波长处测量各孔的吸光值,以空白培养基调零,取各组平行孔平均OD值,绘制各组细胞的生长曲线。
2 结果
2.1 通过流式细胞技术成功分选乳腺癌干细胞
用流式细胞仪分选公认的CD44+/CD24-/low乳腺干细胞,PE标记CD44,FITC标记CD24,先经前向角散射光强度分析和荧光脉冲宽度分析(图1A),去除左下角死亡细胞和细胞碎片,选取中间状态良好的细胞作为目标细胞。通过空白对照和阳性对照确定各种荧光的分界线。如图1B所示,MCF-7细胞CD44+/CD24-/low细胞亚群大多处在左上象限Q1,比例为(38.7±3.6)%,符合分选条件,分选出的干细胞数量适于培养传代,为后续试验做准备。
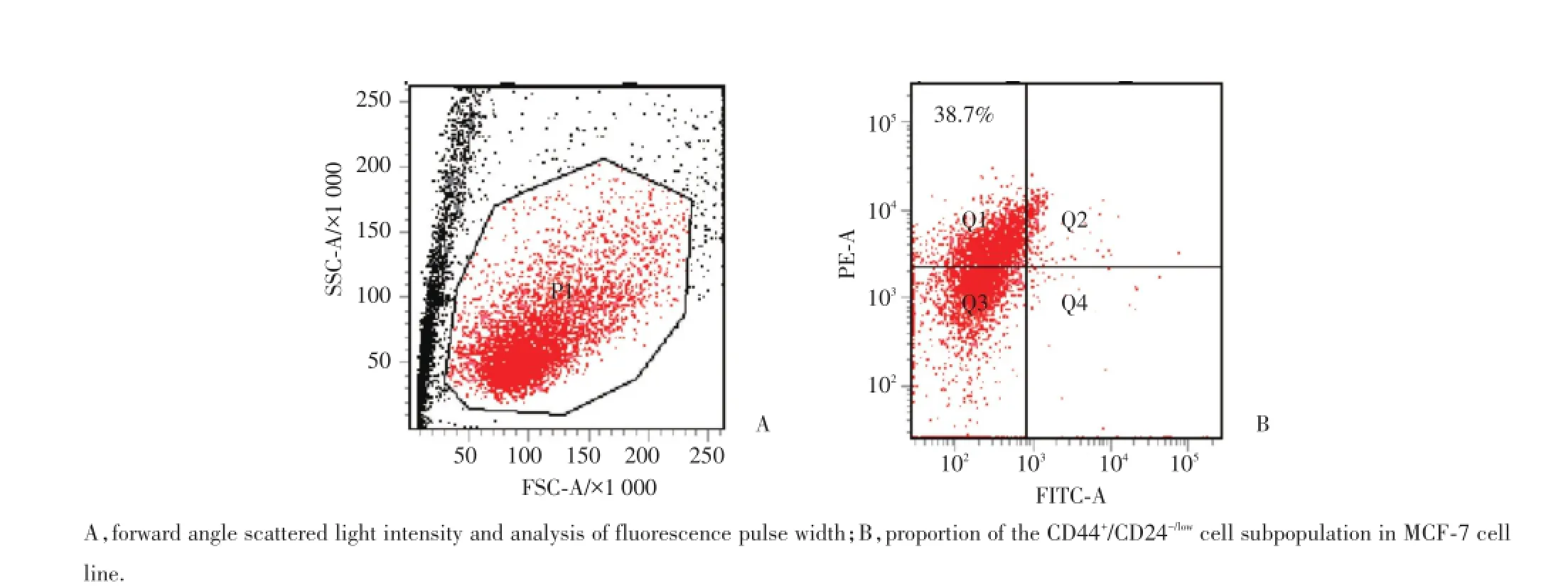
图1 流式分选技术从MCF-7细胞系中分选CD44+/CD24-/low细胞为乳腺癌干细胞Fig.1 Sorting of the CD44+/CD24-/lowcell subpopulation from MCF-7 cell line by FACS
2.2 miRNA mimic成功转染乳腺癌干细胞
先前实验阶段已经确定miRNA mimic最佳用量6孔板为5 μL(20 μmol/L),分别于24、48和72 h观察转染效率,发现24 h转染率较低,48 h转染效率最高,72 h时可能由于荧光部分发生淬灭,转染效率比48 h略有下降。48 h时阴性对照组、miR-206转染组、miR-1转染组细胞转染效率为(50.56±5.17)%、(54.18±4.21)%、(55.64±4.26)%。见图2。

图2 48 h时荧光显微镜下观察miRNA mimic转染乳腺癌干细胞 ×100Fig.2 BCSCs under fluorescent microscope transfected by negative control mimic,hsa-miR-206 mimic and hsa-miR-1 mimic after 48 hours×100
2.3 miRNA mimic成功转染48 h后miR-206、miR-1以及EVI-1基因表达情况
结果显示,miR-206转染组、miR-1转染组分别较空白对照组、阴性对照组的miRNA表达量上升,差异有统计学意义(P<0.05),而空白对照组和阴性对照组之间差异无统计学意义(P>0.05);miR-206转染组和miR-1转染组的EVI-1基因相对表达量分别较空白对照组、阴性对照组下降(P<0.05);而空白对照组和阴性对照组差异无统计学意义(P>0.05),见表2。

表2 miRNA mimic成功转染分选得到的乳腺癌干细胞48 h后miR-206、miR-1以及EVI-1基因表达情况Tab.2 The results of miR-206,miR-1 relative expression levels and EVI-1mRNA expression levels aftertransfection for 48 hours
2.4 上调miR-206和miR-1的表达可以抑制转录因子EVI-1蛋白的表达
结果显示,miR-206转染组、miR-1转染组EVI-1蛋白表达显著下降,miR-206转染组、miR-1转染组与阴性对照组和空白对照组有显著差异。见图3。
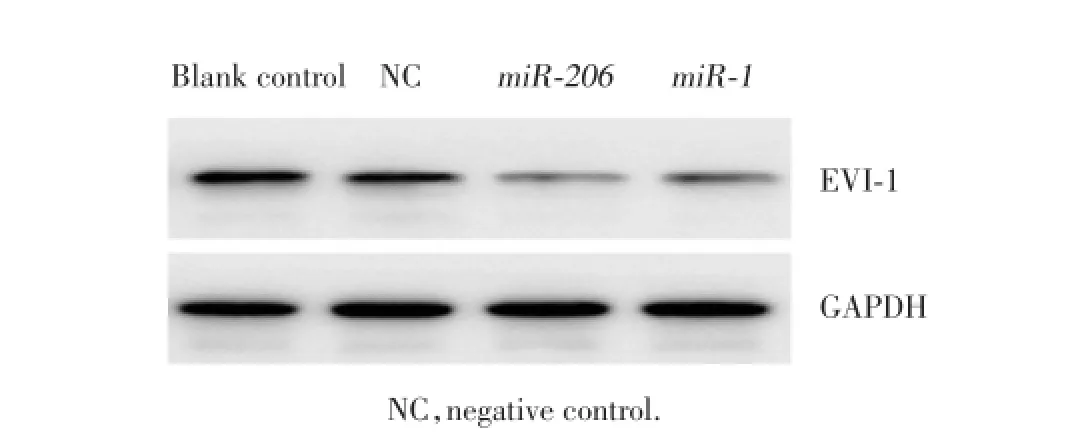
图3 Western blot检测转染后乳腺癌干细胞EVI-1蛋白的表达Fig.3 The expression of EVI-1 in breast cancer stem cells transfected with miR-206and miR-1mimics
2.5 上调miR-206和miR-1的表达抑制细胞增殖能力
MTT实验显示:转染miR-206 mimic和miR-1 mimic 48 h后,细胞增殖开始受到明显抑制(P<0.05),而空白对照组与阴性对照组细胞增殖能力无明显变化(P>0.05)。转染miR-206mimic 48 h、72 h、96 h增殖抑制率分别为(24.36±1.64)%、(23.35± 3.22)%、(30.20±1.74)%;转染miR-1mimic 48 h、72 h、96 h增殖抑制率分别为(23.78±1.66)%、(21.12± 3.36)%、(27.96±1.8)%。见图4。
3 讨论
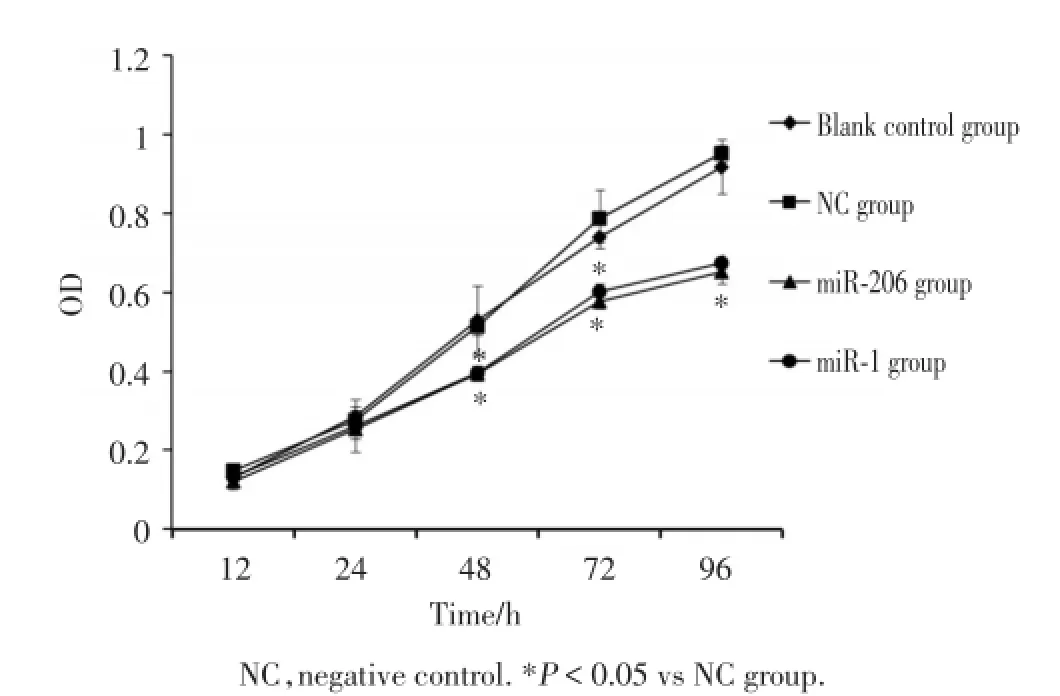
图4 转染mi R-206mimic和mi R-1mimic后乳腺癌干细胞增殖能力Fig.4 The proliferation of breast cancer stem cells transfected with miR-206and miR-1mimics
miRNA虽然不编码蛋白质,却可以通过与目标mRNA完全互补或不完全互补结合,直接降解目标mRNA,或抑制其翻译,调控肿瘤细胞发生、迁移等相关基因的表达,参与肿瘤生长、转移、诱导血管形成等过程[9]。一个miRNA可以同时参与多个基因表达转录的调控,几个不同miRNA也可以共同调控某一个基因;一个miRNA作用可以是多个目标基因作用的总和,这样能更加有效地放大目标基因的作用。
乳腺癌干细胞是乳腺肿瘤抵抗放化疗等传统治疗方式的原因之一,提示乳腺癌干细胞可能是治疗失败、肿瘤复发和转移的基础。由于miRNA在肿瘤发生中的重要作用,越来越多的研究开始把它与乳腺癌干细胞联系起来。Shimono等[10]的研究表明miR-200家族在CD44+/CD24-/Lin-原代乳腺癌干细胞中表达减低,经体外培养乳腺癌细胞并上调miR-200c的表达后可以降低乳腺癌干细胞的比例;miR-200c还可以强烈抑制体内正常乳腺干细胞形成乳腺导管以及乳腺癌干细胞成瘤的能力[11]。miR-30e在乳腺癌细胞株SK-BR3和乳腺干细胞中表达下降[12],上调miR-30e的表达可以抑制乳腺癌球囊的形成以及肿瘤的发生发展。因此,研究乳腺癌干细胞与miRNA相关作用不仅可以探讨miRNA参与乳腺癌干细胞恶性增殖、远处转移等过程的分子机制,而且也为miRNA作为乳腺癌早期诊断、复发转移检测以及生物治疗靶点的探索奠定了基础。本实验成功从乳腺癌细胞MCF-7中分选出CD44+/ CD24-/low细胞亚群,经无血清培养后可以成功传代,运用于后续试验。
miR-206基因位于人染色体6p12.2,在肺癌、乳腺癌、子宫内膜癌等肿瘤中表达下调,抑制癌细胞增殖和侵袭,诱导细胞凋亡,起到抑制肿瘤生长的作用。与ERα-乳腺癌细胞相比,miR-206表达水平在ERα+乳腺癌细胞中显著下降,而将miR-206转染雌激素依赖性MCF-7乳腺癌细胞株后,细胞增殖和迁移率下降。Adams等[13]分析ERα受体mRNA的3′非翻译区,发现有2个miR-206结合位点。并证实miR-206能与这些位点结合,导致ERα受体下调。miR-1基因定位于人染色体20q13.33和18q11.2,在乳腺癌、舌癌、食管癌、肺癌等肿瘤中表达下降。miR-206和miR-1只相差4个核苷酸,且两者靶基因互补配对区域高度相似,共同对一定数量的靶基因发挥调节作用[14]。
为了明确miR-206和miR-1的靶基因,本课题组前期通过TargetScan和miRanda等生物信息学软件发现在锌指转录因子EVI-1mRNA 3′非翻译区存在miR-1和miR-206的结合位点,EVI-1可能是miR-206和miR-1共同的靶基因之一。EVI-1在急性髓细胞样白血病、室管膜瘤、卵巢癌等肿瘤中表达上调;下调其表达能抑制肿瘤细胞生长[15,16]。EVI-1还参与了乳腺癌细胞迁移、侵袭和上皮间质转化等过程,发挥促进肿瘤发生、发展和转移的作用[17]。本实验利用miRNA mimic转染乳腺癌干细胞,上调miR-206和miR-1表达水平后发现,同时影响了EVI-1的mRNA和蛋白表达水平。可以推断miR-206和miR-1能够负性调控转录因子EVI-1的表达。
本实验进一步研究过表达miR-206和miR-1后乳腺癌干细胞在增殖方面的变化。结果发现,miR-206和miR-1表达水平增高,EVI-1表达水平降低后,细胞增殖能力明显下降。miR-206和miR-1基因可能通过负向调控EVI-1调节了乳腺癌干细胞的增殖。表明其在乳腺癌的发生、癌细胞的增殖方面可能发生调控作用,其调控机制尚不完全清楚。
综上,miR-206和miR-1可能通过负性调节EVI-1的表达,参与调控乳腺癌干细胞的增殖过程。但是,miR-206和miR-1对EVI-1的具体调控机制和结合位点等仍有待进一步的研究和探讨。
[1]AL-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[2]Knoop AS,Kudsen H,Balslev E,et al. Retrospetive analysis oftopoisomerase Ⅱa amplifications and deletions as predictive markersin primary breast cancer patients randomly assigned to cyclophosphamide,methotrexate,and fluorouracil or cyclophosphamide,epirubicin,and fluorouracil:Danish Breast Cancer CooperativeGroup[J]. J Clin Oneol,2005,23(30):7483-7490.
[3]Tanner M,Isola J,Wiklund T,et al.TopoisomeraseⅡalpha gene amplification predicts favorable treatment response to tailored and dose-esealated anthracycline-based adjuvant chemotherapy in HER-2/neu-amplified breast cancer:Seandinavian Breast Group Trial 9401[J].J Clin Oncol,2006,24(16):2428-2436.
[4]Harrison H,Farnie G,Howell SJ,et al.Regulation of breast cancer stem cell activity by signaling through the Notch4 receptor[J].Cancer Res,2010,70(2):709-718.
[5]Guo J,Zhou J,Ying X,et al.Effects of stealth liposomal daunorubicin plus tamoxifen on the breast cancer and stem cells[J].J Pharm Sci,2010,13(2):136-151.
[6]Sheridan C,Kishimoto H,Fuchs RK,et al.CD44+/CD24-breast cancer cells exhibit enhanced invasive properties:an early step necessary for metastasis[J].Breast Cancer Res,2006,8(5):R59.
[7]龚继芳,袁艳华,宋国红,等.CD44+/CD24-/low/ABCG2-乳腺癌干细胞比例增高与临床治疗相关的探索性研究[J].北京大学学报(医学版),2008,40(5):465-470.
[8]Sayed D,Abdellatif M.MicroRNAs in development and disease[J]. Physiol Rev,2011,91(3):827-887.
[9]Carthew RW,Sontheimer EJ.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642-655.
[10]Shimono Y,Zabala M,Cho RW,et al.Downregulation of miRNA-200c links breast cancer stem cells with normal stem cells[J]. Cell,2009,138(3):592-603.
[11]Iliopoulos D,Lindahl-Allen M,Polytarchou C,et al.Loss of miR-200 inhibition of Suz12 leads to polycomb-mediated repression required for the formation and maintenance of cancer stem cells[J]. Mol Cell,2010,39(5):761-772.
[12]Yu F,Deng H,Yao H,et al.Mir-30 reduction maintains self-renewal and inhibits apoptosis in breast tumor-initiating cells[J].Oncogene,2010,29(29):4194-4204.
[13]Adams BD,Cowee DM,White BA.The role of miR-206 in the epidermal growth factor(EGF)induced repression of estrogen receptor-alpha(ERalpha)signaling and a luminal phenotype in MCF-7 breast cancer cells[J].Mol Endocrinol,2009,23(8):1215-1230.
[14]Nohata N,Hanazawa T,Enokida H,et al.microRNA-1/133a and microRNA-206/133b clusters:dysregulation and functional roles in human cancers[J].Oncotarget,2012,3(1):9-21.
[15]Patel JB,Appaiah HN,Burnett RM,et al.Control of EVI-1 oncogene expression in metastatic breast cancer cells through micro RNA miR-22[J].Oncogene,2011,30(11):1290-1301.
[16]Koos B,Bender S,Witt H,et al.The transcription factor evi-1 is overexpressed,promotes proliferation,and is prognostically unfavorable in infratentorial ependymomas[J].Clin Cancer Res,2011,17(11):3631-3637.
[17]Brooks DJ,Woodward S,Thompson FH,et al.Expression of the zinc finger gene EVI-1 in ovarian and other cancers[J].Br J Cancer,1996,74(10):1518-1525.
(编辑陈姜)
Effects of miR-206/miR-1on Breast Cancer Stem Cell Proliferation and the Mechanism
MENGLin,WANGTian-yi,LIXiao-xi,MAPing
(The Second Laboratory,Institute of Cancer Research,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effects of up-regulated miR-206/miR-1on the proliferation of breast cancerstem cellsand the effect mechanism.MethodsBreast cancer stem cells(BCSCs)were isolated from breast cancer cell line MCF-7 by fluorescence-activated cell sorting.Cells in the experiment were divided into the blank control group,the negative control group,the miR-206 group and the miR-1 group.The BCSCs were transfected by negative control mimic,hsa-miR-206mimic and hsa-miR-1mimic in all groups except the blank control group.MiR-206and miR-1 expression levels as well as the transcription factor EVI-1gene were detected by real time PCR.The expression levels of the transcription factor EVI-1 protein were detected by Western blot.MTT method was used to detect the effects of miR-206and miR-1on the proliferation of BCSCs.ResultsThe BCSCs(CD44+/CD24-/lowcells)isolated from MCF-7 cell lines were successfully cultured in serum-free medium for subsequent studies.After transfection of hsa-miR-206mimic and hsa-miR-1mimic for 48 hours,miR-206and miR-1relative expression levels increased.EVI-1mRNA expression levels significantly decreased.The results of Western blot and MTT showed that up-regulated expression levels of miR-206and miR-1could significantly reduce the expression of EVI-1 protein and inhibited the proliferation of BCSCs.The differences in levels of miR-206,miR-1and EVI-1 protein were statistically significant(P<0.05).ConclusionUp-regulated miR-206and miR-1expression can inhibit the proliferation ability of BCSCs,which may be related to the down-regulation ofEVI-1.
microRNA;breast cancer;tumor stem cell;miR-206;miR-1
R737.9
A
0258-4646(2015)05-0394-06
国家自然科学基金(81372812)
孟琳(1988-),女,硕士研究生.
马萍,E-mail:pingm12@hotmail.com
2014-11-11
网络出版时间:
