小脑-下丘脑通路在卒中后抑郁发病机制中的作用
2015-01-02康笑隋汝波2张磊2马贺骥
康笑,隋汝波2,张磊2,马贺骥
(辽宁医学院1.附属第一医院神经内科;2.护理学院教研室,辽宁 锦州 121000)
小脑-下丘脑通路在卒中后抑郁发病机制中的作用
康笑1,隋汝波2,张磊2,马贺骥1
(辽宁医学院1.附属第一医院神经内科;2.护理学院教研室,辽宁 锦州 121000)
目的初步证实小脑-下丘脑通路调控炎性因子参与卒中后抑郁(PSD)的发生。方法将160只雄性(SD)大鼠随机分为假手术组、卒中组、PSD组、海人酸(KA)损毁小脑顶核组、电损毁小脑上脚交叉(xSCP)组。进行行为学观察和测试,并取海马组织采用免疫组化方法分析其IL-1β和TNF-α的表达。结果与假手术组及卒中组相比,PSD组TNF-α、IL-1β含量明显增加;而KA组与xSCP组的大鼠炎性因子表达与PSD组变化一致,3组之间无统计学差异。结论小脑顶核可能通过小脑-下丘脑通路调控炎性因子进而参与卒中后抑郁的发生。
卒中后抑郁;发病机制;小脑顶核;细胞因子;下丘脑
卒中后抑郁(post-stroke depression,PSD)是卒中最常见的并发症[1],发病率高达20%~79%。卒中后抑郁严重地影响了患者的生活质量,然而目前PSD的发病机制仍不明确。近年研究[2]提出的炎性细胞因子学说证实卒中患者外周免疫器官产生炎性细胞因子,并通过破坏的血脑屏障进入中枢,炎性细胞因子学说很好地解释了PSD的发生,得到了公认。近年来,人们对下丘脑核团在免疫调控中的作用也有了新的认识。我们的前期研究还发现电刺激小脑顶核后,可能通过谷氨酸的兴奋作用调节下丘脑放电活动[3]。基于上述文献及研究,我们发现了有趣的现象,小脑顶核可能通过小脑-下丘脑通路调控炎症进而参与PSD的发生。
1 材料与方法
1.1 材料和试剂
一抗IL-1β,TNF-α(北京博奥森生物技术有限公司);生物素标记的羊抗鼠免疫球蛋白IgG及SP试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司);脑立体定位仪(VDT-1)(西北光学仪器厂);LEICA-RM2235石蜡切片机、LEICA-HI1220摊片烤片机(上海徕卡仪器有限公司);BH显微镜(日本奥林帕斯)。
1.2 模型的建立
选用健康成年雄性SD(Sprague-Dawley,SD)大鼠160只,体质量250~300 g,由辽宁医学院实验动物中心提供。许可证号:SCXK(辽)。实验动物级别:均为普通级。随机分为5组,每组32只。
1.2.1 大脑局灶性脑缺血模型的建立:术前大鼠12 h禁食不禁水。4%水合氯醛经腹腔麻醉,固定于手术台上,颈部正中逐层切开,暴露左侧颈总动脉(CCA),插入备好的鱼线,当到达指定长度(18 mm左右),鱼线将阻断进入大脑中动脉的血流,引起局灶性脑缺血改变。以庆大霉素局部消毒后缝合皮肤。术后使环境温度维持在25~30℃。模型成功的标志是大鼠迅速出现右侧Horner征。
1.2.2 大鼠PSD模型的建立:CUMS:按照Willner和Katz方法:(1)持续光照17 h;(2)倾斜鼠笼(45°)17 h;(3)禁水17 h;(4)禁食禁水20 h;(5)湿笼(100 g锯末+200 mL水)21 h;(6)行为限制2 h;(7)水平摇晃5 min;(8)4℃游泳5 min;(9)夹尾1 min;9种刺激每天随机采取一种,共18 d;孤养:将PSD组动物单笼饲养。
1.2.3 海人酸(kainic acid,KA)损毁小脑顶核组模型的建立:大鼠经4%水合氯醛腹腔注射麻醉后,固定在脑立体定位仪上,剃除头部被毛,于颅顶正中纵向切开充分暴露前囟和后囟。参考《Paxinos& Watson大鼠脑立体定位图谱》确定小脑顶核坐标即:A/P:前囟后11.4~11.8 mm,L/R:中线旁开0.4~0.8 mm,H:前囟下5.5~6.2 mm,用颅骨钻打孔。用已注入KA的微量进样器缓缓插入双侧顶核预定部位,以0.1 μL/min的速度注入0.4 μL,留针10 min。术后消毒缝合,再肌注青霉素钠预防感染。手术过程中,室温维持25℃左右。手术后常规饲养8 d。
1.2.4 电毁损小脑上脚交叉(superior cerebella peolumcle,xSCP)组模型的建立:大鼠经水合氯醛麻醉后,固定在脑立体定位仪上,剃除头部被毛,于颅顶正中纵向切开,剥除骨膜,充分暴露前囟和后囟。参考《Paxinos&Watson大鼠脑立体定位图谱》确定xSCP的坐标:前囟后8.0 mm,中线旁开0 mm,H:前囟下7.8~8.0 mm,用颅骨钻打孔。电极固定于立体定位仪上,连接A320R隔离刺激器(美国WPI公司),插入到小脑上脚交叉部位,通直流电,强度0.5 mA,持续10 s,留针10 min,术后消毒缝合皮肤,肌注青霉素钠预防感染。手术过程中,室温维持在25℃左右。手术后常规饲养8 d。
1.3 行为学观察和测试
CUMS开始第1、8、15、22、29天,行旷野试验测试,每周行蔗糖水试验并测量大鼠的体质量,应激结束后进行强迫游泳试验。(1)旷野试验:周围环境安静,测定5 min内运动得分及在中央格停留的时间、修饰次数和粪便颗粒数;(2)蔗糖水试验:禁食禁水20 h以后,测定1 h内的糖水饮用比例(糖水消耗/总液体消耗×100%)。
1.4 免疫组化法检测海马组织IL-1β和TNF-α的表达
动物完成观察后,用4%多聚甲醛灌流固定后取海马区包埋,标本4 μm连续切片,贴附于已做好防脱的载玻片上,将载玻片在60℃烤60 min以使切片紧密黏附,切片常规脱蜡至水。3%H2O2中浸泡10 min,蒸馏水冲洗3次。加入0.01 mol/L枸橼酸盐缓冲液(pH 6.0),微波炉中蒸煮3 min(中火),冷却后PBS洗涤5 min。滴加封闭液,室温20 min。滴加IL-1β和TNF-α的单克隆抗体,正常组加PBS作为空白对照,4℃过夜,PBS洗2 min×3次。滴加二抗,37℃30 min。滴加SP液,37℃30 min。二氨基联苯胺(DAB)显色10~20 min,苏木精复染,乙醇脱水,二甲苯透明,中性树胶封片,显微镜观察染色颗粒。
细胞因子的表达:TNF-α阳性表现为胞膜及浆膜染成浅黄色,棕黄色或棕褐色。IL-1β阳性表现为胞浆及胞核染成浅黄色,棕黄色或棕褐色。按染色强度(无色、淡黄色、深黄色、棕褐色)和阳性细胞所占的百分比(阳性细胞<1%、1%~10%、11%~50%、>50%)分别记0、1、2、3分,两者之和为最后得分,<3分记为(-),≥3分记为(+)。以0.01 mol/L PBS替代-抗作为阴性对照,以试剂盒内阳性切片作为阳性对照。
1.5 统计学分析
所有数据均以x±s表示(先正态性检验),以SPSS 17.0统计软件包进行统计分析,组间差异比较采用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学的观察和测试
与假手术组相比,所有大鼠以及其他组术后体质量不同程度下降。与此同时,在PSD组、xSCP组、KA组大鼠体质量减少是一致的(图1)。与假手术组相比,其他组不同程度的拒绝饮用蔗糖水,PSD组、xSCP组、KA组显著下降(图2)。开放试验,与假手术组相比,PSD组、xSCP组、KA组运动的成绩显著降低(图3)。PSD组、xSCP组、KA组与假手术组相比,差异具有统计学意义(P<0.05,P<0.01)。
2.2 免疫组化法检测海马组织IL-1β和TNF-α的表达
与假手术组相比,PSD组、xSCP组、KA组IL-1β含量明显增加,差异具有统计学意义(P<0.01),见图4,表1。与假手术组相比,PSD组、xSCP组、KA组TNF-α含量明显增加,差异具有统计学意义(P<0.01),见图5,表2。
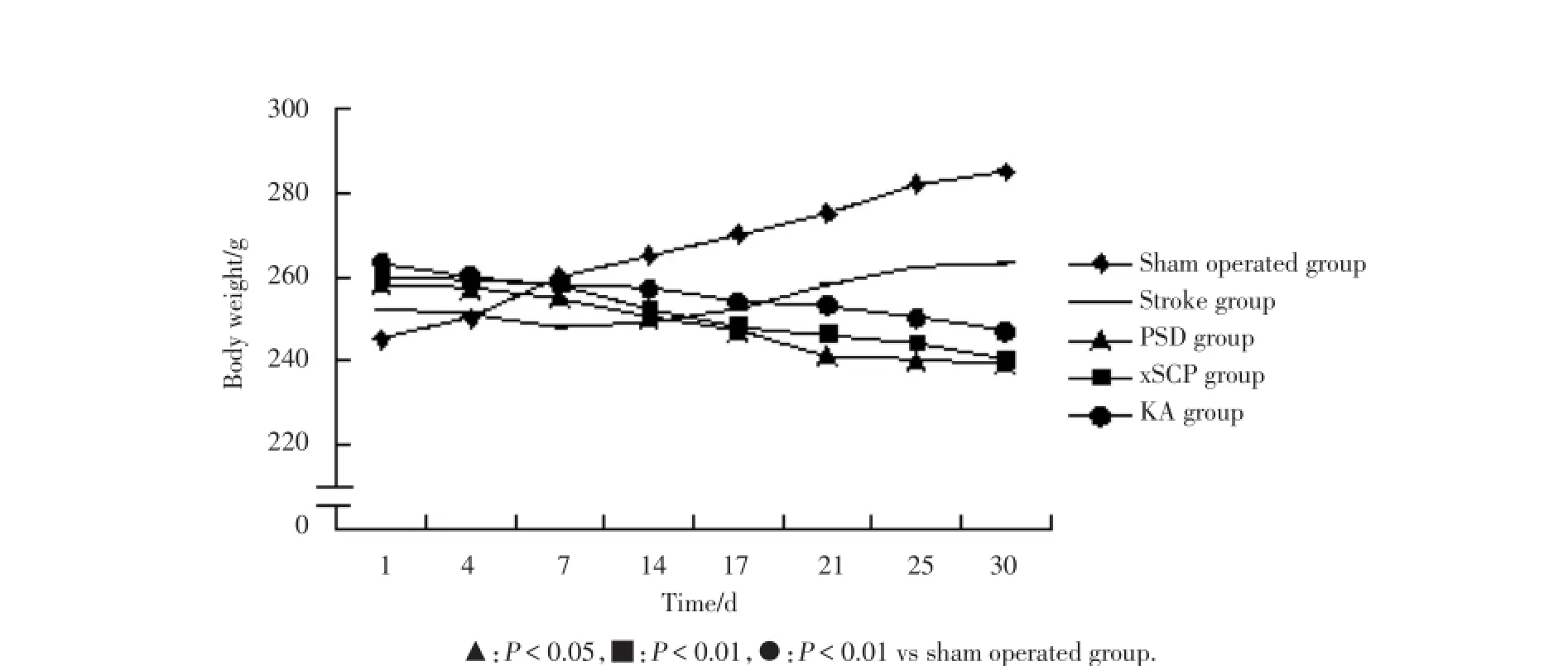
图1 各组大鼠的体质量变化Fig.1 Weight of rats in each group rats

图2 各组大鼠的糖水消耗Fig.2 Sugar consumption of in each group rats
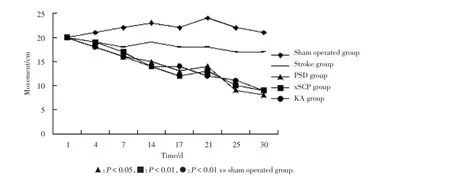
图3 各组大鼠的运动水平Fig.3 Score of movement in each group rats
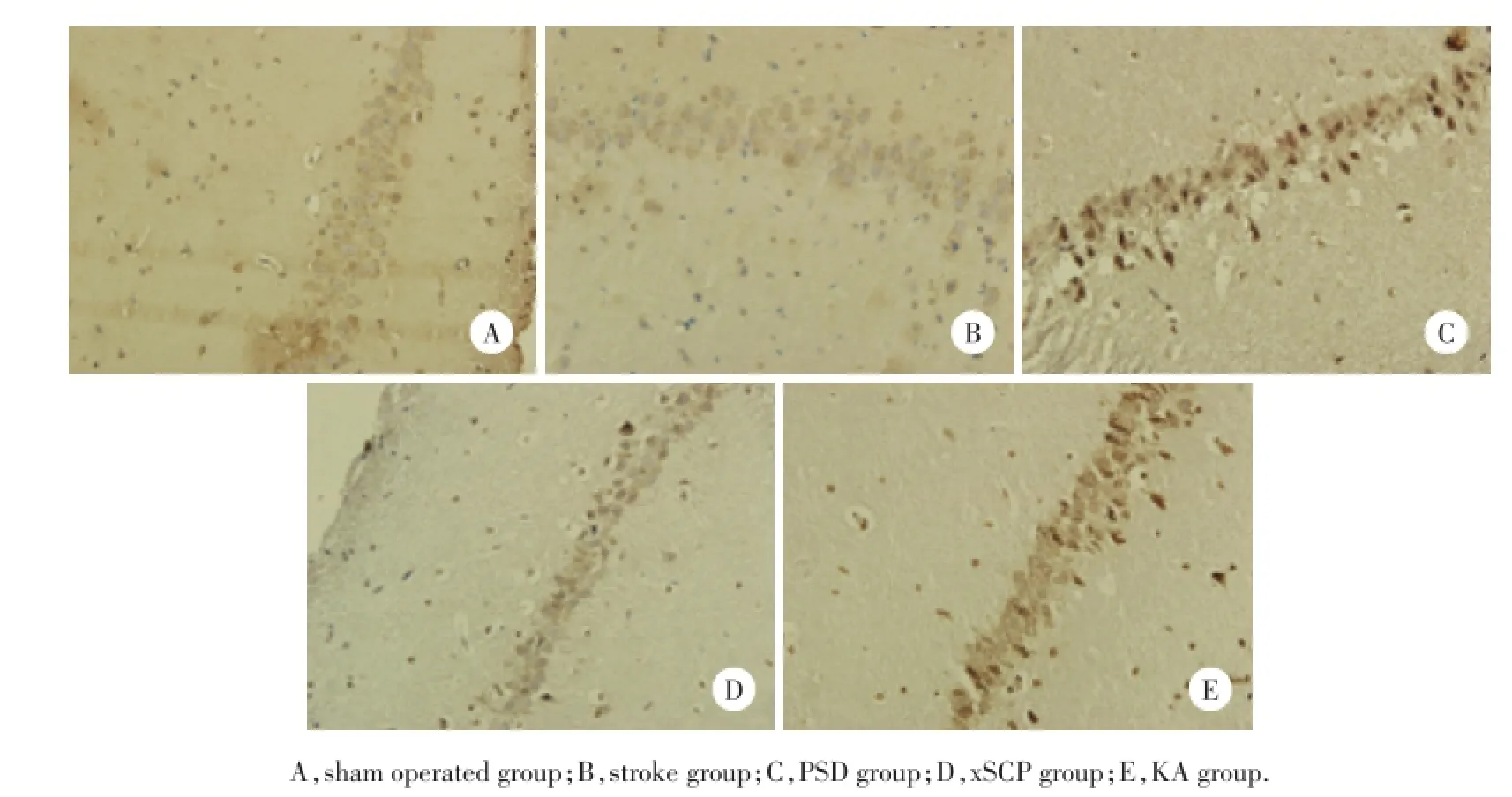
图4 大鼠海马组织IL-1β表达 ×100Fig.4 IL-1βexpression in rat Hippocampus area×100
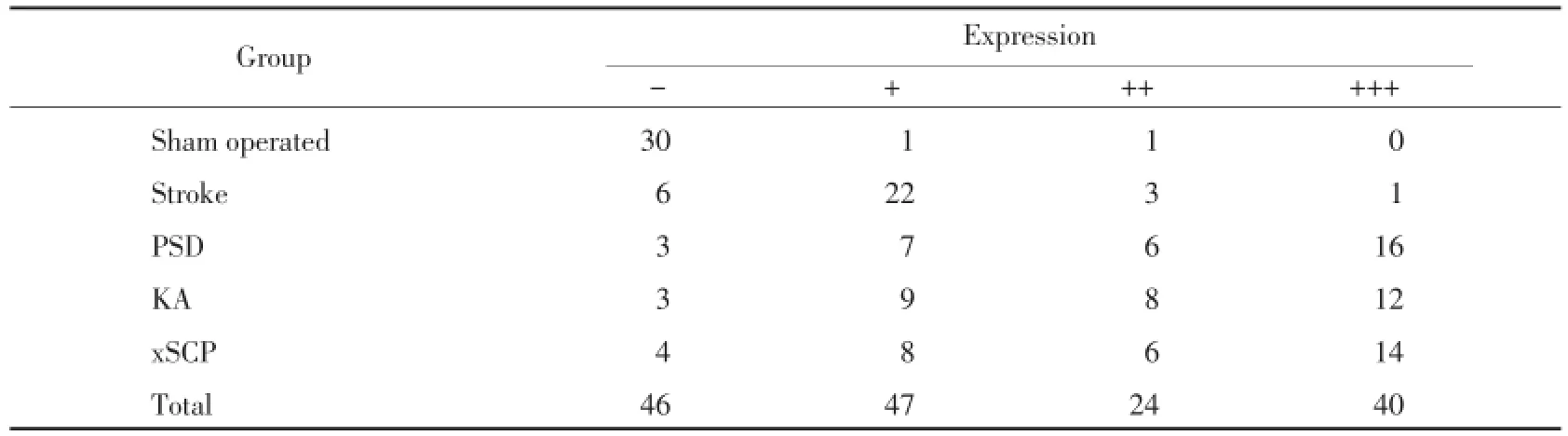
表1 IL-1β在假手术组、卒中组、PSD组、xSCP组及KA组海马组织中的表达Tab.1 IL-1β expression in sham operated group,stroke group,PSD group,xSCP group and KA group
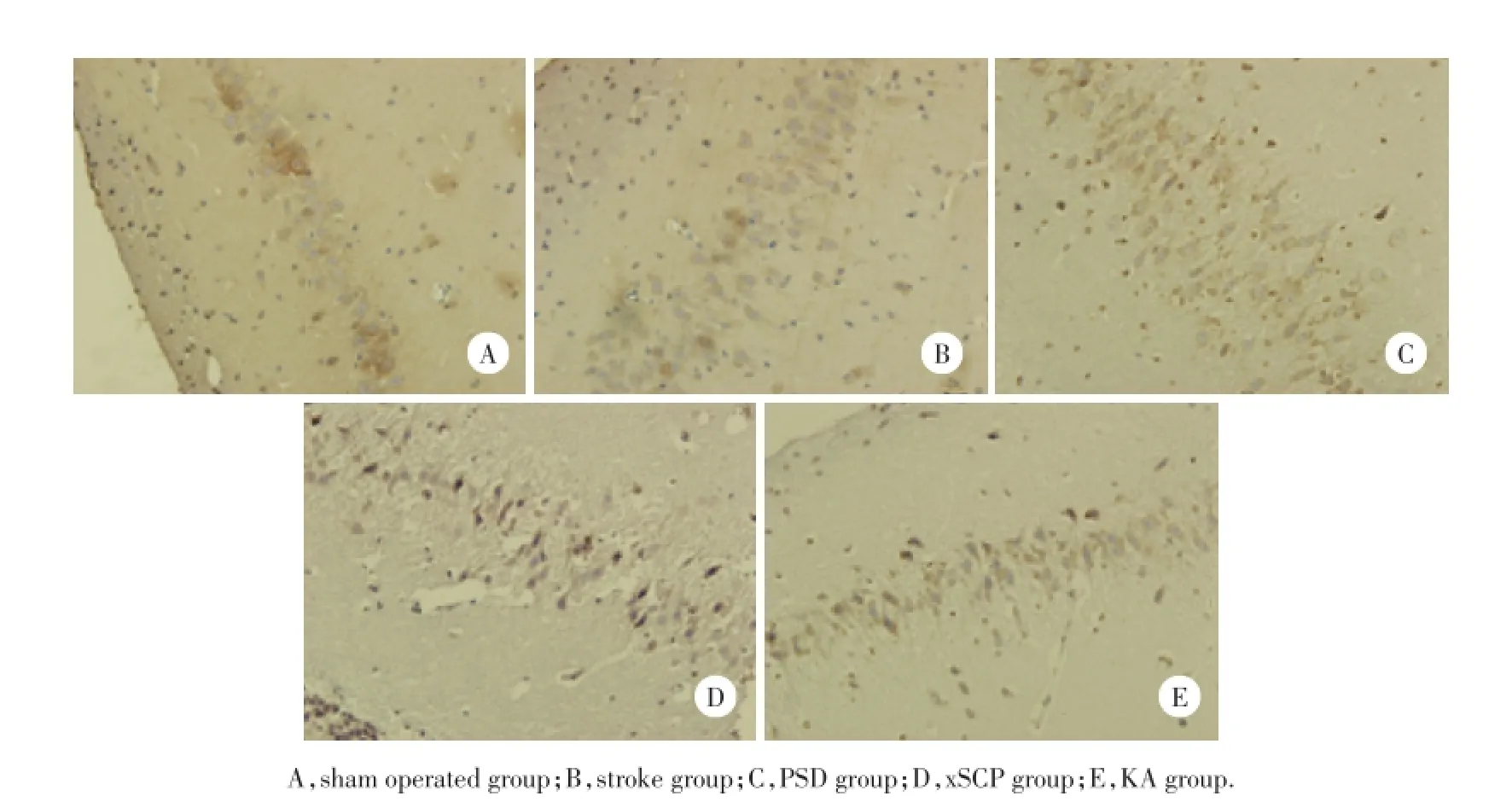
图5 大鼠海马组织TNF-α表达 ×100Fig.5 TNF-α expression in rat Hippocampus area×100
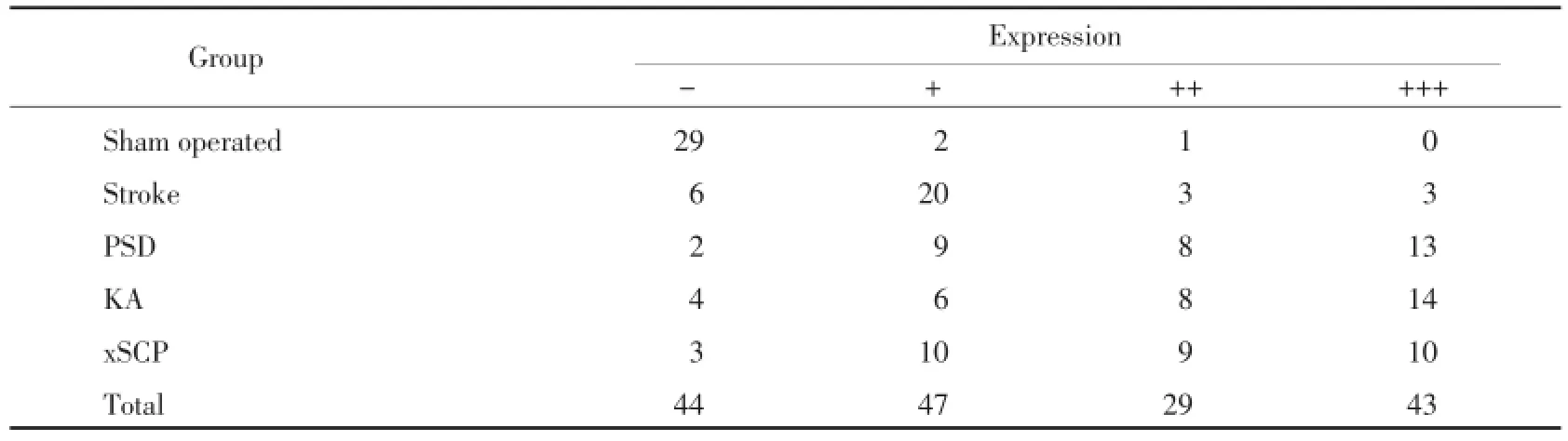
表2 TNF-α在假手术组、卒中组、PSD组、xSCP组及KA组海马组织中的表达Tab.2 TNF-α expression in Sham operated group,Stroke group,PSD group,xSCP group and KA group
3 讨论
目前有关PSD的发病机制学说众多,可能涉及神经解剖、神经递质、神经内分泌、炎性反应、社会心理等方面。但是炎性因子学说不能解释其他学说,应用抗炎药物并未使PSD患者的症状得到很好的改善。大量研究发现抑郁、精神分裂症等精神紊乱均与小脑病变密切相关[4],刘竞丽等[5]应用电刺激小脑顶核治疗PSD患者,结果显著改善了患者的抑郁症状。我们的前期研究发现电刺激大鼠小脑顶核后改善了抑郁量表评分,大鼠海马组织中炎性因子水平下降[6]。上述研究提示小脑顶核可能参与了PSD的发病。众所周知,下丘脑是神经内分泌的调节中枢,临床患抑郁症和焦虑症时,下丘脑通过整体的下丘脑-垂体-肾上腺皮质轴调节炎性细胞因子,包括IL-1β、IL-6和TNF-α,提示下丘脑参与炎性反应[7]。同时研究表明下丘脑核团是重要的免疫调节区域,不仅通过神经体液途径,其更可能通过神经环路直接与淋巴结联系从而调控外周的免疫功能[8]。另一方面,近年的研究发现,小脑顶核的纤维可直接投射到下丘脑,构成小脑顶核-下丘脑投射[9]。
本实验通过CUMS法制备脑卒中后抑郁大鼠。脑卒中后抑郁大鼠出现显著的神经功能缺陷、体质量减轻、自发活动和探究性活动减少、糖水消耗量降低、海马组织TNF-α、IL-1β含量增高。提示脑卒中后抑郁大鼠模拟出了卒中后抑郁患者的体质量下降、兴趣感减退、活动减少和脑内炎性细胞因子降低等表现。说明本实验复合制备的脑卒中后抑郁大鼠模型思路是可行的,造模是成功的。
参考《Paxinos&Watson大鼠脑立体定位图谱》确定小脑顶核坐标,用颅骨钻孔。模型成功后用生理盐水和含4%多聚甲醛的0.1 mol/L磷酸缓冲液各50 mL经颈动脉灌流固定15~20 min,迅速取出完整的脑组织,放入同样的固定液中进行后固定至少4 h,再将脑组织移入30%的蔗糖磷酸缓冲液(pH=7.4)中过夜,沉底后即可行冰冻切片,片厚30 μm,焦油紫染色,光镜下观察进行组织学鉴定。反复验证以确定损毁的正确部位。
炎性细胞因子学说证实卒中患者外周炎性细胞因子升高导致了PSD的发生,可能通过损伤海马、额叶等。而下丘脑是炎症中枢,下丘脑通过兴奋交感神经影响淋巴细胞变化,进而调节白细胞介素、肿瘤坏死因子、干扰素等炎性细胞因子水平[10]。抑郁障碍的患者下丘脑-垂体-肾上腺轴紊乱引起机体慢性炎症[11]。本研究结果中,PSD组TNF-α、IL-1 β含量明显增加,损毁小脑顶核组及损毁小脑上脚交叉通路组与PSD组的炎性因子表达一致,证实炎性因子变化是由小脑顶核-下丘脑通路调节的。
小脑损伤致抑郁的机制是什么?有研究提示PSD时大鼠小脑组织浦肯野纤维细胞数减少,小脑功能改变可能通过浦肯野纤维引起PSD的发病。小脑顶核氨基丁酸能、谷氨酸能神经元通过下丘脑外侧区调节免疫系统。本研究从宏观方面,发现小脑顶核通过小脑-下丘脑通路调控炎性因子参与卒中后抑郁的发生。但微观发现小脑顶核损伤致PSD的机制目前仍不明确,我们推测可能与小脑-下丘脑通路调节有关。
[1]Noonan K,Crewther SG,Carey LM,et al.Sustained inflammation 1.5 years post-stroke is not associated with depression in elderlystroke survivors[J].Clin Interv Aging,2013,8:69-74.
[2]Spalletta G,Bossu P,Ciaramella A,et al.The etiology of poststroke depression:a review of the literature and a new hypothesis involving inflammatory cytokines[J].Mol Psychiatry,2006,11(11):984-991.
[3]Sui RB,Li XD,Jia YY.Effect of stimulation of fastigial nucleus on the firing activities of the hypothalamus neurons in rats[J].Chi J Neuroana,2010,6:599-603.
[4]Schmahmann JD,Weilburg JB,Sherman JC.The neuropsychiatry of the cerebellum-insights from the clinic[J].Cerebellum,2007,6(3):254-267.
[5]刘竞丽,李劲频,董为伟.电刺激小脑治疗脑卒中后抑郁的临床探讨[J].中国临床康复,2003,7(13):1926-1927.
[6]李宝强,隋汝波,张磊,等.小脑顶核电刺激干预在卒中后抑郁大鼠细胞因子发病机制中的作用[J].解放军医学院学报,2013,169(5):502-505.
[7]Gadek-Michalska A,Tadeusz J,Rachwalska P,et al.Cytokines,prostaglandins and nitric oxide in the regulation of stress-response systems[J].Pharmacol Rep,2013,65(6):1655-1662.
[8]王蕾,欧可群,陈文玉,等.大鼠下丘脑室旁核对淋巴结免疫功能的神经调控[J].免疫学杂志,2004,20(3):184-187.
[9]Li B,Guo CL,Tang J,et al.Cerebellar fastigial nuclear inputs and peripheral feeding signals converge on neurons in the dorsomedial hypothalamic nucleus[J].Neurosignals,2009,17(2):132-143.
[10]Bθhmer E,Kristiansen IS,Caro JJ,et al.Health and cost sonsequences of early versus late invasive strategy after thrombolysis for acute myocardial infarction[J].Eur J Cardiovasc Prev Rehabil,2011,18(5):717-720.
[11]陈怡丽,姜傥,陈培松,等.抑郁障碍患者下丘脑-垂体-肾上腺轴调节异常对辅助性T细胞17分化发育的影响[J].中国神经精神疾病杂志,2011,37(3):146-149.
(编辑裘孝琦)
Study of the Cerebellar Hypothalamic Pathwaysin the Pathogenesis of Post-stroke Depression
KANGXiao1,SUIRu-bo2,ZHANGLei2,MAHe-ji1
(1.Department of Neurology,The First Affiliated Hospital,Liaoning Medical College,Jinzhou 121000,China;2.Department of Nursing,Liaoning Medical College,Jinzhou 121000,China)
Objective To preliminarily proved that the cerebellar hypothalamic pathways regulate inflammatory cytokines involved in post-stroke depression(post-stroke depression,PSD).Methods160 male(Sprague-Dawley,SD)rats were randomly divided into sham operation group,thestroke group,PSD group,kainic acid(kainic acid,KA)damage of cerebellar fastigial nucleus group,electrical damaged decussation of superior cerebellarpeduncle(superior cerebellar peduncle,xSCP)group. The behavioral observation were observed and expression of IL-1β and TNF-α in hippocampus by immunohistochemistry.ResultsCompared with the sham operation group and stroke group,PSDgroup,TNF-α,IL-1βcontentsignificantly increased;and the factor of rats with KA group and xSCP group expression consistent with PSD group,there was no significant difference among the three groups.ConclusionThe cerebellar fastigial nuclearmay through the cerebellar hypothalamic pathways regulate inflammatory cytokines and participate in poststroke depression.
post-stroke depression;pathogenesi;fastigial nucleus;inflammatory cytokines;hypothalamus
R743.3
A
0258-4646(2015)05-0389-06
国家自然科学基金专项基金(81241050);辽宁省自然科学 基金(2013022018);辽 宁 医 学 院 青 年 基金(Y2012Z014);辽宁省科学技术计划项目(2012225019)
康笑(1988-),女,医师,硕士研究生.
隋汝波,E-mail:suirubo521@aliyun.com
2014-11-25
网络出版时间:
