姜黄素抑制Wnt 信号通路对人胰腺癌细胞增殖凋亡的影响
2014-12-30李立方苏银玲任学群
李立方,苏银玲,任学群
(河南大学 淮河医院,河南 开封 475004)
胰腺癌是较常见的消化系统恶性肿瘤,该疾病的早期诊断十分困难,多数新发病例已存在周围器官侵犯和/或远处转移,手术切除率不到30%,5年生存率低于5%[1].胰腺癌的发病率仍呈逐年上升趋势,2009年美国在因肿瘤致死疾患中居第4位[2].姜黄素是从姜科植物姜黄的地下根茎中提取的一种多酚类色素,是一类具有多种生物学效应的天然活性物质,其药理作用广泛,能够抗炎、抗氧化、抗诱变、降血脂及抗动脉粥样硬化.近年来,国内外学者发现姜黄素能够同时参与多重抗肿瘤生长增殖的途径,影响肿瘤发生发展的多个环节与步骤,具有直接和间接的抗肿瘤作用[3-6].本研究以不同浓度姜黄素作用于人胰腺癌细胞SW1990,观察其对SW1990 细胞生长、增殖、凋亡及对Wnt 信号传导通路中核心蛋白β-catenin 水平和下游相关靶基因c-myc、VEGF、cyclinD1 表达的影响.
1 材料与方法
1.1 材料
人胰腺癌SW1990 细胞株(中国科学院上海生物研究所细胞库),姜黄素纯度>98%(国家标准物质网-北京世纪奥科生物技术有限公司),用二甲基亚砜(DMSO)培养基稀释成5mmol/L,等量分装,-20℃保存.MTT 试剂盒购自Sigma 公司,Annexin V-FITC 凋亡检测试剂盒由贝博试剂提供.RPMI1640 培养基,胎牛血清为Biowest 产品.β-catenin 抗体为Cell-Based Cell signaling technology 公司产品.PCR 相关试剂由天根生化科技(北京)有限公司提供.酶标仪(F200)为瑞士Tecan 公司产品,流式细胞仪(Accuri C6)为 美国BD 公司产品,凝胶成像系统及PCR 仪购自美国Bio-rad 公司,WB 等相关设备购自上海天能科技有限公司.
1.2 方法
1.2.1 细胞培养
SW1990 细胞培养于含100 mL/L 胎牛血清的RPMI1640 培养基,在37 ℃、CO2浓度为50 mL/L 的 二氧化碳培养箱中培养,每48 h 换液传代1 次.
1.2.2 四甲基偶氮唑蓝(MTT)比色试验
设对照组和加用姜黄素组(20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L 姜黄素),取对数生长期细胞,常规胰酶消化后用含100 mL/L 胎牛血清RPMI1640 培养液制成单细胞悬液,接种于96 孔培养板,每孔100 μL(含约5×103个细胞),待细胞贴壁后去培养液并加药,同时取等量的DMSO 作为对照组,每组设6 个复孔,另设6 个调零孔(不加细胞,只加100 μL 培养液),继续培养48 h.弃上清,每孔加入含MTT 10 μL 的培养液100 uL,4 h 后终止培养,弃上清液,每孔加入150 μL 的DMSO,置水平摇床上震荡10 min,以凋零空调零,在酶标仪(Tecan F200)上测492 nm 波长的吸光度(OD)值,计算各组药物浓度的抑制率及半抑制浓度(IC50),试验重复3 次并取平均值.
1.2.3 流式细胞仪检测姜黄素诱导SW1990 细胞凋亡
取对数生长期细胞,常规胰酶消化后用含100 mL/L 胎牛血清的RPMI1640 培养液制成单细胞悬液,计数后种于六孔板中,每孔约含2* 105个细胞,待细胞贴壁后去培养液并加药,分别加入2 mL 含有0、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L 姜黄素的培养液,培养48 h 后,用不含EDTA 的胰酶消化离心收集细胞,用冷的PBS 洗涤细胞两次.然后用400 μL 1X Annexin V 结合液悬浮细胞,在细胞悬液中加入5 μL Annexin V-FITC 染色液,轻轻混匀后避光孵育15 min,后加入10 μL PI 染色液避光孵育5 min,在1 h 内用流式细胞仪(Accuri C6)检测.
1.2.4 免疫印迹法(Western blot)检测核心蛋白β-catenin 的表达
取对数生长期的人胰腺癌细胞SW1990,以5×105个/mL 的密度接种于培养瓶中培养.分别以加入0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L 姜黄素的培养液,培养48 h 后按胞浆蛋白提取试剂盒说明方法裂解细胞膜,收集胞浆蛋白.然后各组取等质量胞浆蛋白上样,采用5%的浓缩胶,8%分离胶进行SDS-PAGE 电泳,转膜,洗膜5 次,每次3 min,加入封闭液并封闭1 h.加入新鲜配制的1∶1000 稀释兔抗β-catenin 及β-actin 单克隆抗体,4 ℃孵育过夜.洗涤液洗膜3 min×3 次,加入相应二抗1∶1500 稀释(辣根过氧化物酶标记马抗兔IgG 抗体),37 ℃平缓摇动1 h.用ECL 化学发光试剂盒中的A、B 液等量混匀洒在膜上,放入X 光片盒中进暗室曝光.用Image J 图像分析软件进行分析.
1.2.5 半定量RT-PCR 检测不同浓度姜黄素对胰腺癌SW1990 细胞中c-myc、VEGF、cyclinD1 mRNA 的影响
提取总RNA,并合成cDNA 第一条链,总反应体系25 μL.各条引物序列如下c-myc:5'-CCAGGACTGTATGTGGAGCG-3',5'-CCTGAGGACCAGTGGGCTGT-3';VEGF:5'-GCAGAATCATCACGAAGTGGT-3',5'-CATTTGTTGTGCTGTAGGAAGC-3;cyclinD1:5'-ATCTACACCGACAACTCCATCC-3',5'-GCATTTTGGAGAGGAAGTGTTC-3';β-actin:5'-AGAGCTACGAGCTGCCTGCTG-3',5'-AGTACTTGCGCTCAGGAGGA-3'.
上述引物均由上海生工生物工程技术有限公司合成.将PCR 产物用2%浓度的琼脂糖进行凝胶电泳,在凝胶成像系统上观察电泳带及其位置,摄影,Image J 软件将图像转换成灰度值.对各条带灰度值与β-actin 条带灰度值的比值进行分析.
1.3 统计学处理
采用SPSS13.0 软件进行统计学处理,所有计量资料均用均数±标准差(珋±s)表示,组间比较采用单因素方差分析(One-way ANOVA),相关性检验采用Pearson 相关分析,P≤0.05 差异有统计学意义.
2 结果
2.1 MTT 法检测姜黄素对SW1990 细胞增殖的影响
按下列公式计算生长抑制率:生长抑制率(IR%)=(1-加药组平均A 值/对照组A 值)×100%,经不同浓度的姜黄素处理48 h 后,SW1990 细胞生长受到不同程度的抑制,随药物浓度的增大,抑制率逐渐增高,呈现剂量依赖性关系(r=0.96,P<0.05).各浓度组细胞增殖抑制率与空白对照组比较差异有统计学意义(P<0.05),各浓度组间比较亦有统计学意义(P<0.05,图1).经计算得出IC50=56.74 μmol/L.
2.2 流式细胞仪测姜黄素对SW1990 细胞凋亡的影响
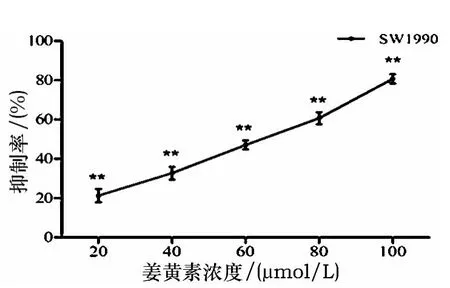
图1 不同浓度姜黄素作用于胰腺癌细胞SW1990 48h 后的生长抑制率曲线
SW1990 细胞在培养瓶中贴壁生长,呈多角形,在姜黄素作用下,它们生长速度减慢,形态发生改变,部分细胞变圆,脱壁.用0、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L 姜黄素 处理作用48 h 后,其凋亡率分别为8.1%、11.7%、16.3%、28.1%、37.5%、56.8%,呈现浓度依赖性(r=0.96,P<0.05).各浓度组细胞凋亡率与空白对照组比较差异有统计学意义(P<0.05),各浓度组间比较亦有统计学意义(P<0.05,图2).

图2 不同浓度姜黄素对胰腺癌SW1990 细胞凋亡率的影响
2.3 免疫印迹法(Western blot)检测姜黄素对SW1990 细胞核心蛋白β-catenin 的表达水平的影响
经0、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L 姜黄素作用48 h 后的实验组细胞,胞浆β-catenin 蛋白含量低于空白对照组(见图3).在SW1990 细胞中,除20 μmol/L 浓度组外,其他浓度组与空白对照组比较均有统计学意义(P<0.05).药物浓度越大,胞浆β-catenin 蛋白含量越少,呈剂量依赖性(r=-0.96,P<0.05).

图3 姜黄素对SW1990 细胞内β-catenin 蛋白表达水平的影响.(con 为对照组)
2.4 半定量RT-PCR 检测姜黄素对Wnt/β-catenin 信号通路下游靶基因mRNA 表达水平的影响
经0、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L 姜黄素作用后的SW1990 细胞,c-myc、VEGF、cyclinD1 mRNA 表达量较空白对照组均减少,且呈剂量依赖性(r=-0.99,-0.92,-0.93,P<0.05).在SW1990 细胞中,c-myc mRNA 的表达在浓度为20 μmol/L 时与空白对照组比较无统计学意义(P>0.05),其余浓度组与空白对照组比较、其余浓度组之间比较均有统计学意义(P<0.05);VEGF mRNA 的表达,20 μmol/L 组与空白对照组、40 μmol/L 组进行比较无统计学意义(P>0.05),其余浓度组与空白对照组、其余浓度组之间比较均有统计学意义(P<0.05).cyclinD1 mRNA 的表达,各浓度组与空白对照组、其余浓度组之间比较均有统计学意义(P<0.05,图4).
3 讨论
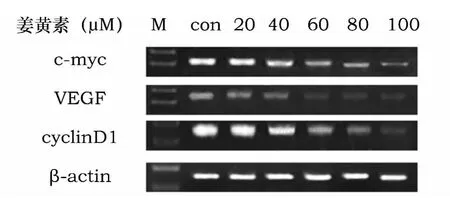
图4 姜黄素对Wnt 靶基因mRNA 表达水平的影响.(M 为DNA Marker,con 为对照组)
Wnt/β-catenin 信号通路是常见且研究得较为透彻的Wnt 通路,又称为经典通路[7].正常情况下当该信号通路未被激活时,胞质的β-catenin 与APC、轴蛋白(axin)、GSK-3β 结合经酪蛋白激酶(CK)1α 和GSK-3β 磷酸化,并经泛素化降解,以维持胞质低水平的游离β-catenin.Wnt 信号通路异常激活时,Wnt 与细胞膜受体卷曲蛋白(Fz)、低密度脂蛋白受体相关蛋白(LRP)5/6 结合形成受体复合体,通过Fz 将信号转导至胞质散乱蛋白(Dsh),后者通过抑制GSK-3β 以阻止β-catenin 的磷酸化降解,致胞质β-catenin 聚集并转运至细胞核,并形成转录活性复合体,启动下游靶基因如原癌基因c-myc、cyclinD1、VEGF 等的转录,致细胞过度增殖,由此参与肿瘤的发生发展[8-10].
姜黄素(curcumin,Cur)来源于食品,具有价廉,毒性低,抗癌谱广、不良反应小等优点,最近被肿瘤学家们认为是一种潜在的第3 代抗癌化疗药物[11,12].姜黄素抗癌作用的机制是多方面的,其中诱导肿瘤细胞凋亡可见于多种肿瘤的研究中,但其诱导机制仍不是很清楚,关于姜黄素对经典Wnt 信号通路活性的调控作用的报道甚少.我们的研究结果说明,姜黄素能有效抑制人胰腺癌细胞株SW1990 的增殖,细胞增殖活力随姜黄素药物浓度增大而不断下降,其抑制作用程度呈剂量依赖性.既往实验发现,姜黄素能够通过激活过氧化物酶增殖体激活受体γ(PPARγ)和增强BTG2 mRNA 的表达而下调CyclinD1(CyclinD1 在多种肿瘤细胞中过量表达,能够介导细胞从G1 期向S 期过渡[13])从而抑制肿瘤细胞生长[14,15].除影响肿瘤细胞周期外,姜黄素还可能通过降低肿瘤细胞的抗凋亡蛋白(如c-myc、bcl-2、bcl-xl 等)水平和提高凋亡蛋白(Fas)水平从而诱导肿瘤细胞凋亡[16,17].除此之外,姜黄素能够抑制肿瘤细胞EGFR 的表达、促进Caspase-3 的活化等抑制肿瘤细胞的存活与生长,诱导其凋亡[18,19].本研究中,PCR 实验结果表明姜黄素可以下调人胰腺癌细胞SW1990 中c-myc、VEGF、cyclinD1 mRNA 的表达.但Wnt 途径肯定不是姜黄素抑制效应的主要或者唯一途径,还需一系列的实验来进一步的研究.
总之,恶性肿瘤是严重危害人类健康的疾病之一,其发生、发展是一个多因素作用、多基因参与和多阶段经历才最终形成的极其复杂的生物学过程,但目前尚无非常理想的抗肿瘤药物.虽然原有药物不断改进发展,新药不断开发问世,但其疗效、安全性等仍未能达到令人满意的效果[20,21].寻找新的抗肿瘤分子靶位、提高肿瘤治疗的临床疗效等方面越来越受到关注,信号通路在肿瘤发生、发展中起着重要作用,故继续进一步探究其各组分及相互作用机制,开发该通路特定靶点有效拮抗剂,无疑将对抗肿瘤药物的发展产生巨大的影响,有望开拓肿瘤治疗的一个新局面.
[1]Jemal A,Siegel R,Ward E,Hao Y,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58:71-96.
[2]Jemal A,Siegel R,Ward E,Hao Y,et al.Cancer statistics[J].CA Cancer J Clin,2009,59:225-249.
[3]Goel A,Aggarwal BB.Curcumin,the golden spice from Indian saffron,is a chemosensitizer and radiosensitizer for tumors and chemoprotector and radioprotector for normal organs[J].Nutr Cancer,2010,62:919-930.
[4]Reuter S,Eifes S,Dicato M,Aggarwal BB,et al.Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells[J].Biochem Pharmacol,2008,76:1340-1351.
[5]Tharak an ST,I namoto T,Sung B,Aggar wal BB,et al.Curcumin potentiates the antitumor effects of gemcitabine in an orthotopic model of human bladder cancer through suppression of proliferative and angiogenic biomarkers[J].Biochem Pharmacol,2010,79:218-228.
[6]Cheng CY,Lin YH,Su CC.Curcumin inhibits the proliferation of human hepatocellular carcinoma J5 cells by inducing endoplasmic reticulum stress and mitochondrial dysfunction[J].Int J Mol Med,2010,26:673-678.
[7]Vincan E.Frizzled/WNTsignalling:the insidious Promoter of tumour growth and Progression[J].Front Biosci,2004,9:1023-1034.
[8]Luo J,Chen J,Deng ZL,et al.Wnt signaling and human diseases:what are the therapeutic implications[J].Lab Invest,2007,87(2):97-103.
[9]Clevers H.Wnt/beta-catenin signaling in development and disease[J].Cell,2006,127(3):469-480.
[10]Klaus A,Birchmeier W.Wnt signalling and its impact on development and cancer[J].Nat Rev Cancer,2008,8(5):387-398.
[11]汪海慧,成扬.姜黄素药理作用研究进展[J].上海中医药大学学报,2007,21(6):73-76.
[12]陈宏,陈宇英,张振书,等.姜黄素抗大肠癌作用研究[J].肿瘤研究与临床,2006,18(1):4-7.
[13]Aoki H,Takada Y,Kondo S,et al.Evidence that curcumin suppresses the growth of malignant gliomas in vitro and in vivo through induction of autophagy:Role of Akt and ERK signaling pathways[J].Mol Pharmacol,2007,72(1):29-39.
[14]Aggarwal BB,Banerjee S,Bharadwaj U,et al.Curcumin induces the degradation of cyclin E expression through ubiquitindependent pathway and up-regulates cyclin-dependent kinase inhibitors p21 and p27 in multiple human tumor cell lines.Biochem pharmacol,2007,73(7):1024-1032.
[15]Kwon YK,Jun JM,Shin SW,et al.Curcumin decreases cell proliferation rates through BTG2-mediated cyclin D1 down-regulation in U937 cells[J].Int J Oncol,2005,26(6):1597-1603.
[16]Anto RJ,Mukhopadhyay A,DenningK,et al.Curcumin(diferuloylmethane)induces apoptosis through activation of caspase-8,BID cleavage and cytochrome c release:its suppression by ectopic expression of bcl-2 and bcl-xl[J].Carcinogenesis,2002,23(1):143-150.
[17]吴勇,陈元仲,许建华,等.姜黄素对人类Burkitt 淋巴瘤抗癌作用的研究[J].中华肿瘤杂志,2002,24(4):348-351.
[18]Lev-Ari S,Starr A,Vexler A,et al.Inhibition of pancreatic and lung adenocarcinoma cell survival by curcumin is associated with increased apoptosis,down-regulation of COX-2 and EGFR and inhibition of Erk1/2 activity[J].Anticancer Res,2006,26(6B):4423-4430.
[19]Su CC,Lin JG,Li TM,et al.Curcumin-induced apoptosis of human colon cancer colo 205 cells through the production of ROS,Ca2+and the activation of caspase-3[J].Anticancer Res,2006,26(6B):4379-4389.
[20]Ghosh JC,Altieri DC.Aetivation of P53-dependent apoptosis by acute ablation of glyeogen synthase kinase-3beta in colorectal cancer cells[J].Clin Cancer Res,2005,11:4580-588.
[21]Bazzi H,Fantauzzo KA,Richardson GD,Jahoda CA,et al.The Wnt inhibitor,DiekkoPf 4,is induced by canonical Wnt signaling during ectodermal appendage morphogenesis[J].Dev Biol,2007,305:498-507.
