缺血性糖尿病溃疡模型探讨*
2014-12-24彭旦明卢仁军赵诗云张瑾楠
彭旦明 卢仁军 赵诗云 张瑾楠
(1江西省中医药研究院 南昌330046;2江西中医药大学2012级硕士研究生 南昌330004)
糖尿病足是指糖尿病患者由于合并神经病变及各种不同程度末梢血管病变而导致下肢感染、溃疡形成或深部组织的破坏[1~2],糖尿病严重的患者可能截肢,给病人带来沉重的生理和心理负担。近年来糖尿病足发病率明显增加,但关于糖尿病足的发病机理仍不清楚,合适的糖尿病足模型的建立显得十分重要。缺血-再灌注损伤是导致糖尿病溃疡发生的重要原因之一[3],链脲佐菌素(STZ)的剂量对动物血糖及维持时间影响重大,可直接影响溃疡的形成与愈合时间。本实验拟通过观察不同剂量STZ对糖尿病足大鼠模型的影响,寻求最佳剂量,建立合适的糖尿病大鼠溃疡模型。现报告如下:
1 实验材料与方法
1.1 实验动物 SD雄性大鼠(购自湖南斯莱克景达动物有限公司,动物许可证号:SCXK[湘]2011-0003)70 只,体重 180~200 g,SPF 级。动物饲料由湖南斯莱克景达动物有限公司生产,许可证号:SCXK(湘)2014-0002。动物饲养环境:室温 20~25℃,湿度40%~70%,单笼喂养,自由摄食、饮水。
1.2 实验试剂和仪器 链脲佐菌素(上海源聚生物科技有限公司);柠檬酸,柠檬酸三钠(国药集团化学试剂有限公司);戊巴比妥钠(西亚试剂有限公司);碘伏消毒液,95%乙醇消毒液(江西草珊瑚消毒用品有限公司)。
1.3 仪器 罗氏ACCU-CHEK ACTIVE血糖仪,血糖测试纸(德国Roche公司产品);超净工作台(苏州冯氏实验动物设备有限公司);Olympus光学显微镜(上海天放实验仪器有限公司);磁通量1 500高斯圆片形磁铁(直径13 mm、厚度2 mm,由深圳明鑫科技有限公司提供,所有磁铁使用前均高压灭菌消毒)。
1.4 糖尿病大鼠溃疡模型制备 将SD雄性大鼠70只随机分为7组,每组10只,空白对照组及6个剂量 STZ 组 , 剂 量分 别为 30、40、45、50、55、60 mg/kg,背部剃毛消毒。以3%戊巴比妥钠按30 mg/kg剂量腹腔注射,麻醉后在大鼠背部脊柱一侧做一深至筋膜的切口,钝性分离,将磁片植入皮下,切口缝合后消毒,手术后的大鼠单笼饲养。4 d后创口完全愈合,第5天禁食12 h,按照上述剂量腹腔注射1%的STZ(STZ使用前用0.1 mol/L、pH=4.5的柠檬酸缓冲液调配),分别在注射STZ前及注射1 d、3 d、7 d、10 d、14 d 测各组动物空腹血糖值、体重、饮水量及进食量。注射STZ第10天(大鼠糖尿病成模),在埋植磁铁处接外源磁片,外接磁铁与体内植入的磁铁相互吸引产生压力,造成局部皮肤缺血,每次磁铁压迫时间为2 h、2 h、1 h,中间将磁铁拿下,让组织血流恢复30 min,如此为一个循环,每天3个循环,连续4 d。观察大鼠溃疡的形成与变化,第15天(压迫结束后)取溃疡周边皮肤组织10%甲醛固定,常规石蜡包埋切片(4 μm),HE 染色,光学显微镜下观察创面组织病理状况。
1.5 统计学分析 用SPSS11.0软件处理数据,结果以均数±标准差(±S)表示,方差齐用t检验,方差不齐用Cochran&Cox近似t检验。P<0.05表示实验结果具有显著性差异,P<0.01表示结果具有极显著性差异。
2 结果
2.1 各组大鼠一般状态观察 磁片植入皮下切口缝合后,约4 d时间动物伤口可完全愈合,对照组及30 mg/kg STZ给药组动物活动、进食量、饮水量及血糖量未见明显异常,而40 mg/kg、45 mg/kg、50 mg/kg、55 mg/kg、60 mg/kg STZ 给药组动物随着剂量的增加,动物活动明显减弱,体形消瘦,毛发干枯、竖立,饮水量及尿量明显增多,STZ剂量为60 mg/kg实验组大鼠体重下降过快,部分动物出现死亡。在埋植磁铁处接外源磁片后,连续4 d每天3个循环压迫,对照组及STZ给药组均形成了溃疡。
2.2 皮肤组织病理学检查 光学显微镜下观察对照组大鼠皮肤切片显示:表皮角质清晰,复层排列存在,毛囊结构正常,真皮胶原丰富,表皮与真皮厚度正常。STZ给药组大鼠表皮真皮组织复层排列消失,组织出血渗血、坏死出现空泡,炎性细胞大量聚集等特征。
2.3 各组大鼠血糖值的变化 结果显示:腹腔注射STZ后,对照组及30 mg/kg STZ给药组动物血糖值在14 d内未见明显变化,各组动物给药1 d(24 h)后与给药前相比也未见明显变化,给药3 d(72 h)后 ,50、55、60 mg/kg 剂 量 组 血 糖 值 大 于 16.7 mmol/L,其余各剂量组动物血糖值均明显增高,但不到16.7 mmol/L。在给药7 d后,除了30 mg/kg组外,其余STZ给药组动物血糖值均大于16.7 mmol/L(血糖仪最大测定值为33.3 mmol/L,超值后按33.3 mmol/L计)。见表1。
表1 实验大鼠血糖值的变化 (±S) mmol/L

表1 实验大鼠血糖值的变化 (±S) mmol/L
注:经 t检验:与空白对照组比较,*P<0.05,**P<0.01;与 40 mg/kg 组比较,#P<0.05,##P<0.01。
组别 n 给药前 1 d 3 d 7 d 10 d 14 d对照组30 mg/kg 40 mg/kg 45 mg/kg 50 mg/kg 55 mg/kg 60 mg/kg 10 10 10 10 10 10 10 4.6±0.5 4.3±0.8 4.9±0.4 4.8±0.7 4.9±0.4 4.5±0.6 4.7±0.3 4.7±0.6 4.9±0.8 5.5±0.7 5.2±0.9 5.3±0.1*5.7±0.4*5.9±0.7*4.4±0.6 5.0±0.9 9.5±1.2*10.7±2.0*18.4±2.4**#19.0±2.2**#21.4±3.2**##4.7±0.6 4.3±0.7 21.6±2.3**21.3±3.2**26.9±2.1**#27.4±3.6**#30.4±1.5**##4.4±0.6 5.1±0.3 29.5±2.4**30.9±1.7**31.2±0.4**30.2±1.5**32.7±0.2**5.4±0.4 5.2±0.8 30.7±1.5**29.5±2.2**31.0±0.9**31.1±0.7*32.8±0.3**
2.4 各组大鼠体重的变化 结果表明:给药前各组大鼠体重无明显差异,P>0.05。给药后除 30 mg/kg STZ给药组外,其余各组大鼠体重明显下降,与正常对照组相比有显著性差异,P<0.05。在自由摄食、进水的状态下,正常对照组大鼠体重随着时间的推移体重不断增加,而同样在自由摄食、进水的状态下,糖尿病足组大鼠随着时间的推移体重逐渐下降,其中60 mg/kg STZ给药组大鼠体重下降幅度过快,当体重下降幅度达到50 g左右时,出现死亡,10只大鼠实验期间死亡5只。见表2。
表2 实验大鼠体重的变化 (±S) g
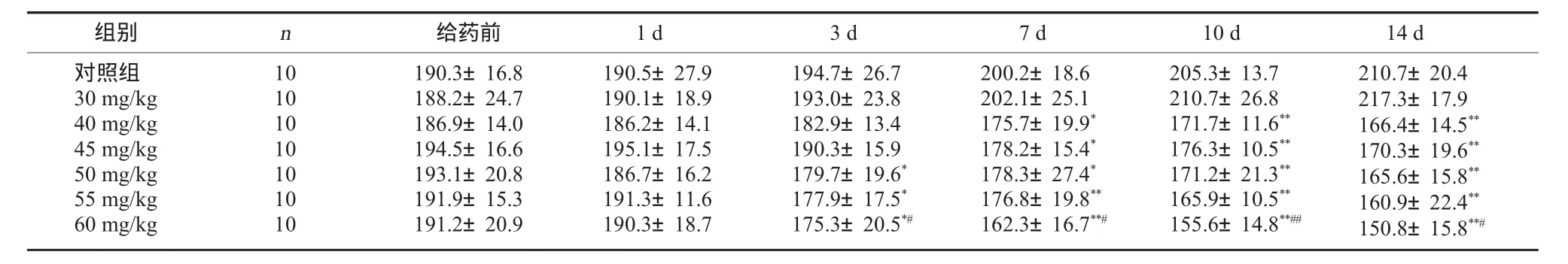
表2 实验大鼠体重的变化 (±S) g
注:经 t检验:与空白对照组比较,*P<0.05,**P<0.01;与 40 mg/kg 组比较,#P<0.05,##P<0.01。
组别 n 给药前 1 d 3 d 7 d 10 d 14 d对照组30 mg/kg 40 mg/kg 45 mg/kg 50 mg/kg 55 mg/kg 60 mg/kg 10 10 10 10 10 10 10 190.3±16.8 188.2±24.7 186.9±14.0 194.5±16.6 193.1±20.8 191.9±15.3 191.2±20.9 190.5±27.9 190.1±18.9 186.2±14.1 195.1±17.5 186.7±16.2 191.3±11.6 190.3±18.7 194.7±26.7 193.0±23.8 182.9±13.4 190.3±15.9 179.7±19.6*177.9±17.5*175.3±20.5*#200.2±18.6 202.1±25.1 175.7±19.9*178.2±15.4*178.3±27.4*176.8±19.8**162.3±16.7**#205.3±13.7 210.7±26.8 171.7±11.6**176.3±10.5**171.2±21.3**165.9±10.5**155.6±14.8**##210.7±20.4 217.3±17.9 166.4±14.5**170.3±19.6**165.6±15.8**160.9±22.4**150.8±15.8**#
2.5 各组大鼠饮水量的变化 结果表明:实验初各组大鼠饮水量并无统计学差异,给药后1 d后,除30 mg/kg给药组大鼠外,其余剂量组大鼠饮水量均明显增多(P<0.05),第3天后大鼠饮水量较正常组增加数倍。见表3。
表3 实验大鼠饮水量的变化 (±S) mL

表3 实验大鼠饮水量的变化 (±S) mL
注:经 t检验:与空白对照组比较,*P<0.05,**P<0.01;与 40 mg/kg 组比较,#P<0.05。
组别 n 给药前 1 d 3 d 7 d 10 d 14 d对照组30 mg/kg 40 mg/kg 45 mg/kg 50 mg/kg 55 mg/kg 60 mg/kg 10 10 10 10 10 10 10 19.3±1.9 20.2±2.6 17.8±2.3 20.2±3.6 21.4±1.8 17.9±2.1 21.7±2.3 19.6±2.5 21.1±2.9 30.6±4.5*33.3±4.4*38.1±5.9*46.1±4.6*#50.4±4.8*#20.4±2.1 20.8±2.6 82.0±7.9**79.6±10.1**107.7±9.4**#112.5±11.4**#120.6±14.4**#20.8±2.8 21.3±3.5 122.6±19.4**127.5±18.1**113.8±15.7**132.7±15.1**140.6±15.1**#18.8±2.2 22.8±3.5 155.4±10.8**158.5±12.8**155.7±14.5**#163.0±13.1**#170.1±16.7**#22.4±3.2 20.4±2.4 160.5±20.2**165.3±21.7**170.5±17.8**#169.8±18.9**#174.1±20.5**#
2.6 各组大鼠进食量的变化 结果表明:各组大鼠均自由进食,给药前各组进食量无明显差异,P>0.05。给药3 d后,50~60 mg/kg给药组大鼠进食量明显增多;第7~14天,给药组大鼠除30 mg/kg外,与对照组比其余剂量组大鼠进食量明显增多,P<0.05。见表4。
表4 实验大鼠进食量的变化 (±S) g

表4 实验大鼠进食量的变化 (±S) g
注:经 t检验:与空白对照组比较,*P<0.05,**P<0.01;与 40 mg/kg 组比较,#P<0.05。
组别 n 给药前 1 d 3 d 7 d 10 d 14 d对照组30 mg/kg 40 mg/kg 45 mg/kg 50 mg/kg 55 mg/kg 60 mg/kg 10 10 10 10 10 10 10 18.3±1.9 19.9±1.3 20.0±2.1 19.6±2.7 19.7±1.6 19.3±2.1 18.4±1.9 19.9±2.6 20.4±2.2 22.1±2.6 20.3±2.6 21.8±1.8 21.3±1.8 20.1±1.7 21.2±2.5 19.9±2.1 23.2±2.5 21.2±2.7 27.8±2.7*#26.2±2.1*#27.4±2.5*#18.2±1.5 21.5±3.6 29.1±4.5*30.7±5.2*35.7±2.7**#35.7±3.6**#40.6±4.5**#20.1±3.7 22.6±1.8 37.5±2.5**35.9±5.4**36.3±3.8**37.9±2.9**39.8±5.4**18.9±2.4 20.7±2.1 40.8±5.3**42.3±4.4**39.1±3.8**40.9±5.7**41.9±4.8**
3 讨论
约15%的糖尿病患者最终都会出现糖尿病足溃疡,糖尿病溃疡难以愈合,且治愈后容易复发,是导致糖尿病患者截肢的主要原因,其致残率很高。普遍认为主要是大、小及微血管病变,周围神经受损及各种损伤所致,血糖升高、组织缺血是造成糖尿病足的重要因素[4]。
合适的糖尿病溃疡动物模型对糖尿病足的研究十分重要。STZ可选择性地作用于胰岛β细胞,通过释放NO和氧自由基,使胰岛β细胞遭到破坏,从而使胰岛素分泌减少。STZ给药剂量对动物整体生命体征、血糖值及维持时间影响重大,可直接影响溃疡形成和变化。然而文献报道STZ给药剂量从25~60 mg/kg 不等[5~6]均可引起糖尿病,我们在前期研究中发现当STZ给药剂量为30 mg/kg时,血糖无明显升高,而达到60 mg/kg时,2周内会出现多数动物死亡,为了建立合适的模型有必要考察STZ的最佳给药剂量。
当前糖尿病足动物模型的制备主要以化学药物诱导为主,配合外部干预。糖尿病足动物模型主要有单纯化学药物造模、化学药物结合温度控制造模或者配合外科手术、化学药物配合磁片循环压迫法四种[7]。其中葛良鹏等[8]采用磁片循环压迫的方法,很好地实现了缺血与复流相交替的过程,可以很好地模拟临床溃疡;且实验动物具有临床糖尿病足患者的发病特点:“多饮、多食、多尿、体重减轻”这“三多一少”的临床症状;诱导出的糖尿病足溃疡模型具有组织坏死、炎性细胞大量聚集等特征,其病理改变与人十分相似,且动物存活率高,是一种较好的糖尿病溃疡模型。
本实验选择的是磁通量为1 500高斯的磁铁,磁通量的选择是根据诱导溃疡的流体静力压计算而得。有研究表明,当外加压力超过局部毛细血管压力12~32 mmHg时,可诱导出溃疡,外加压力为50 mmHg左右时最合适[9]。本实验结果表明,腹腔注射40~60 mg/kg STZ后的大鼠均可造成糖尿病模型,但是40 mg/kg、45 mg/kg在7 d后血糖值才会高于16.7 mmol/L,50~60 mg/kg 在 3 d 后血糖值可高于16.7 mmol/L,但60 mg/kg剂量对大鼠损害过大,易造成大鼠死亡,因此认为造成糖尿病溃疡动物模型STZ的合适剂量为50~55 mg/kg。
[1]杨立芸.糖尿病足发病机制、分级及治疗[J].社区医学杂志,2013,11(15):11-13
[2]肖正华.糖尿病足溃疡发病机制及诊治的临床进展[J].实用医学杂志,2012,28(16):2 661-2 663
[3]Loots MA,Lamme EN,Zeegelaar J,et al.Differences in cellular infiltrate and extracellular matrix of chronic diabetic and venous ulcers versus acute wounds[J].J Invest Dermatol,1998,111(5):850-857
[4]张莹.糖尿病足内皮功能紊乱机制的研究进展[J].检验医学,2013,28(10):948-951
[5]陈群力,杨五彪,马灵筠.实验性糖尿病足大鼠模型的建立[J].河南预防医学杂志,2004,l5(1):1-2
[6]陈群力,马灵筠,杨五彪,等.糖尿病性肢端坏疽大鼠模型的建立及实验研究[J].实用诊断与治疗杂志,2003,17(6):457-459
[7]相胜敏,王健.糖尿病足动物模型及其特点[J].中国中西医结合外科杂志,2007,13(3):306-308
[8]葛良鹏,魏泓.大鼠糖尿病溃疡动物模型的初步研究[J].中国实验动物学报,2005,13(2):88-90
[9]Peirce SM,Skalak TC,Rodeheaver GT.Ischemia-reperfusion injury in chronic pressure ulcer formation:A skin model in the rat[J].Wound Repair Regen,2000,8(1):68-76
