磁性胺肟基功能化CMC 对铀酰离子的吸附行为研究
2014-12-23高阳阳袁亚莉胡建邦马丹丹李玉慧徐文慧
高阳阳,袁亚莉,胡建邦,马丹丹,李玉慧,徐文慧
(南华大学 化学化工学院,湖南 衡阳 421001)
羧甲基纤维素(CMC)是一种纤维素的羧甲基团取代产物,在水中分散效果好,常用来合成吸水剂,可与很多小分子聚合单体发生接枝聚合,形成含有小分子功能基团的复合材料,具有优良离子交换能力;同时其特有的三维结构不但增加了内外表面积,还可使离子保蓄在材料内部,提高了吸附能力[1-3]。
通常的吸附试验在实验室水平都是通过离心分离的方法使固液分离,还不足以看出对于能源和人力的消耗,但是一旦应用到实际生产和工业化当中,巨大的离心设备不但产生非常大的经济损失和能源浪费,还会给整个装置增加许多安全隐患,科学家和工程师们一直都在想如何解决这个问题,磁性纳米粒子的应用使这个问题迎刃而解,并受到广泛的关注[4-6]。添加一个合适的磁场,可以方便而有效地实现磁性复合材料的分离回收。因此许多研究者都尝试将目标材料分子和磁性纳米粒子结合起来,得到性能优异又易于磁场分离的新型磁性功能化材料。
本实验以磁性CMC 为载体,丙烯腈(AN)为聚合物功能单体,过硫酸铵为引发剂,N’N-亚甲基双丙烯酰胺(MBA)为交联剂,合成聚丙烯腈功能化的磁性CMC(PAN/CMC/Fe3O4),再经过胺肟基转化,合成磁性功能化的聚合材料PAO/CMC/Fe3O4,并研究了该材料对铀的吸附性能。对材料的表征手段主要有IR、SEM、TGA 等。
1 实验部分
1.1 试剂与仪器
羧甲基纤维素钠,化学纯;丙烯腈、N’N-亚甲基双丙烯酰胺、丙烯酸、过硫酸铵、硫酸亚铁、氢氧化钠、无水乙醇、浓盐酸均为分析纯。
S-4800 扫描电子显微镜;D/MAX-2200/PC X射线衍射仪;LH-3 振荡样品磁强计;DGG-9030A 鼓风干燥箱;Q50 热重分析仪;2100 紫外可见分光光度计;ZSCL-2 恒温磁力搅拌器。
1.2 PAO/CMC/Fe3O4 的合成
1.2.1 PAN/CMC/Fe3O4的合成 CMC/Fe3O4的合成参照文献[6]做适当改进,CMC 和硫酸亚铁的量加大,将1 g CMC/Fe3O4、0.15 g 过硫酸铵和150 mL去离子水加入到250 mL 的三口烧瓶中,置于75 ℃的恒温磁力搅拌器中搅拌,烧瓶口安装回流冷凝装置,通过通入氮气来驱赶反应体系中的空气,待烧瓶中形成均匀悬浊液,加入5 mL 丙烯腈和浓度为0.01 g/L的MBA 水溶液,75 ℃下继续搅拌6 h。将产物磁性分离,去离子水洗涤,干燥,最后用丙酮在索氏提取器中回流18 h,干燥,待用。
1.2. 2 PAO/CMC/Fe3O4的 合 成 将1 g PAN/CMC/Fe3O4加入到150 mL 的三口烧瓶中,加入1 mol 的盐酸羟胺溶液20 mL 和1 mol/L 的碳酸钠溶液20 mL,通氮气,在70 ℃的恒温磁力搅拌器中搅拌6 h。去离子水洗涤3 次,60 ℃干燥12 h,所得产物即为PAO/CMC/Fe3O4
[7],合成过程见图1。实验证明,经过CMC 包裹之后的Fe3O4在酸性条件下可以长时间稳定存在。

图1 PAO/CMC/Fe3O4合成过程Fig.1 Chemical process for the preparation of the composite PAO/CMC/Fe3O4 particles
1.3 吸附实验
50 mL 的锥形瓶中,加入0.02 g PAO/CMC/Fe3O4,10 mL 0.3 mmol/L 的醋酸铀酰溶液,放在恒温水浴振荡器中振荡反应1 h。用磁铁进行固液分离。取1 mL 上清液,偶氮砷III 为显色剂,采用紫外分光光度法在波长652 nm 测定铀酰溶液中U(VI)的浓度。
2 结果与讨论
2.1 材料表征
2.1.1 红外光谱 PAN/CMC/Fe3O4和PAO/CMC/Fe3O4的红外光谱见图2。
PAN/CMC/Fe3O4中 CN 的特征吸收峰在2 243.21 cm-1,而在PAO/CMC/Fe3O4中,1 639 cm-1处有一个很强的吸收峰,这是胺肟基中的氨基的振动吸收峰;950 cm-1处新的吸收峰是胺肟基中N—O键的振动吸收峰。3 000 ~3 700 cm-1处的吸收峰主要是氢键和胺肟基中O—H 的振动吸收峰。以上结果表明,氰基已经成功的转化成为胺肟基。

图2 PAN/CMC/Fe3O4和PAO/CMC/Fe3O4的红外光谱图Fig.2 Infrared spectra of PAN/CMC/Fe3O4 and PAO/CMC/Fe3O4
2.1.2 扫描电子显微镜(SEM) 图3 是CMC/Fe3O4(a)和PAO/CMC/Fe3O4(b)的扫描电子显微镜图片,其中CMC/Fe3O4放大了3 万倍,PAO/CMC/Fe3O4放大4 000 倍。
由图3a 可知,CMC/Fe3O4为长方体型,长度在5 ~10 μm,经过接枝和胺肟基转化后,PAO/CMC/Fe3O4表面变成片状,面积也相应的变大了。

图3 CMC/Fe3O4和PAO/CMC/Fe3O4扫描电子显微镜Fig.3 SEM micrographs and diameter distribution of CMC/Fe3O4 and PAO/CMC/Fe3O4
2.1.3 热重分析(TGA) 图4 为PAO/CMC/Fe3O4的热重分析图。
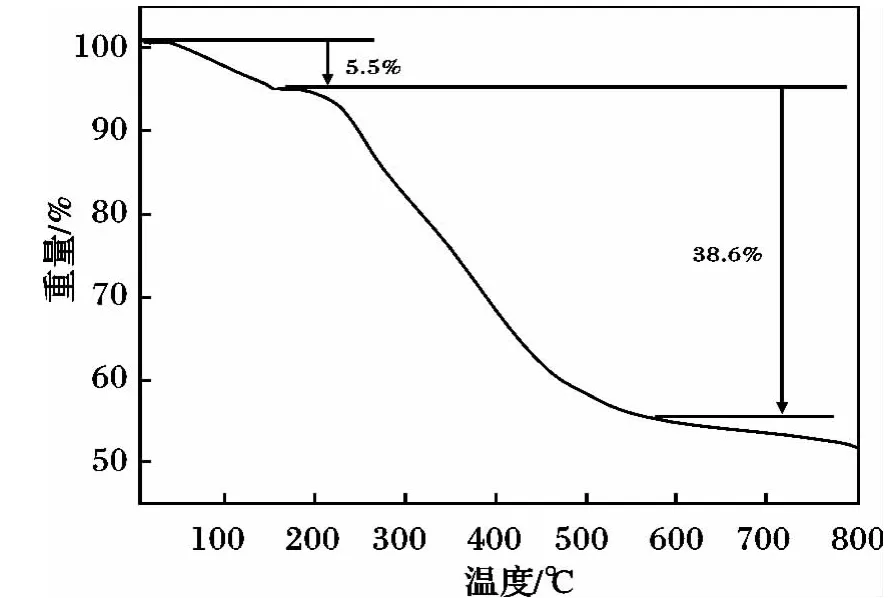
图4 热重分析Fig.4 TGA profile for PAO/CMC/Fe3O4
由图4 可知,150 ℃的重量损失约为5.5%,主要是吸附在固体表面的水;200 ~500 ℃,重量损失最大;当温度达到600 ℃时,重量不再发生变化,此时重量损失为38.6%,表明功能化基团胺肟基的质量占PAO/CMC/Fe3O4总质量的38.6%,功能化效果非常明显。
2.1.4 磁性实验 图5 显示的是产品磁性检验图。
图5a 产品PAO/CMC/Fe3O4均匀分散在水中,形成悬浊液,图5b 将磁铁放在小试管外侧,产品全部吸在磁铁的一侧。因此,该产品完全可以依靠外加磁场来达到固液分离的目的。

图5 磁性实验Fig.5 Images of magnetic separation using PAO/CMC/Fe3O4 loaded with U(VI)
2.2 吸附工艺条件
2.2.1 溶液pH 值对吸附实验的影响 将0.01 g PAO/CMC/Fe3O4分别放入10 mL pH 1 ~8 的铀酰溶液中,初始浓度0.3 mmol/L,吸附时间1 h 的条件下,结果见图6。

图6 pH 值对吸附率的影响Fig.6 Effect of pH on U(VI)sorption by PAO/CMC/Fe3O4
由图6 可知,pH =1 ~5,铀酰离子吸附率快速上升,在pH=5 时达到最大,随后又下降。这是因为在pH <4 时,铀酰离子和PAO/CMC/Fe3O4中的氨基都发生了质子化[8],导致胺肟基对铀酰离子的配位能力下降,进而吸附率降低,随着pH 值的增大,质子化效应减弱,二者间的络合能力提高,在pH=5 时吸附效果最好。当pH >7 时,铀酰离子的组成发生了变化,由 UO22+占主导转变成[UO2(OH)]+,[(UO2)2(OH)2)]2+和[(UO2)3-(OH)5)]+[9],很难被PAO/CMC/Fe3O4发生配位,因此当pH >7 时,PAO/CMC/Fe3O4对铀酰离子的吸附率很低。由此也可以知道,在整个吸附过程中,配位吸附是主要的吸附机理。
2.2.2 吸附剂用量对吸附效果的影响 将不同质量的PAO/CMC/Fe3O4分别与相同的铀酰离子溶液发生吸附反应,结果见图7。

图7 吸附剂用量的影响Fig.7 Effect of adsorbent dose on U(VI)sorption by PAO/CMC/Fe3O4
由图7 可知,随着吸附剂用量的增加,铀酰离子的吸附率逐渐增加,pH 为4.3,温度313.15 K,铀酰溶液初始浓度0.03 mmol/L,时间为60 min 时,此时吸附量为70.75 mg/g,吸附效率为98.7%。
2.2.3 吸附时间对吸附效果的影响 由图8 可知,PAO/CMC/Fe3O4对铀酰离子的吸附在30 min 之内几乎已经达到平衡,30 min 后,吸附率不再随着吸附时间的延长而提高。溶液pH =4.3,温度313 K,因为吸附开始时,活性基团数量多,铀酰离子迅速与活性基团胺肟基发生配位作用,随着吸附的进行,活性胺肟基数量逐渐下降,最终达到吸附平衡。

图8 吸附时间的影响Fig.8 Effect of time on U(VI)sorption by PAO/CMC/Fe3O4
2.3 吸附动力学
吸附数据采用拟一阶动力学模型和拟二阶动力学模型进行分析[10-12],拟合结果见图9 和表1。

表1 动力学模拟结果Table 1 Results of kinetic fitting
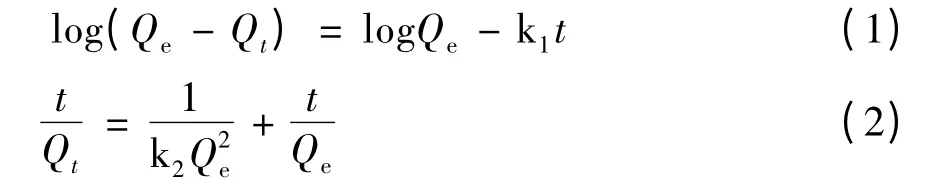
其中,Qe是平衡吸附容量,Qt为t 时的吸附容量,k1为拟一级动力学常数,k2为拟二级动力学常数。拟一级动力学以log(Qe-Qt)为纵坐标,t 为横坐标,从斜率计算出k1,从截距计算出Qe。拟二级动力学以t/Qt为纵坐标,t 为横坐标,从斜率计算出Qe,从截距计算出k2。
由拟合结果可知,PAO/CMC/Fe3O4对铀酰离子的吸附过程更符合拟二级动力学模型,相关性系数R2高达99%以上。说明吸附过程的控制步骤是化学吸附过程。
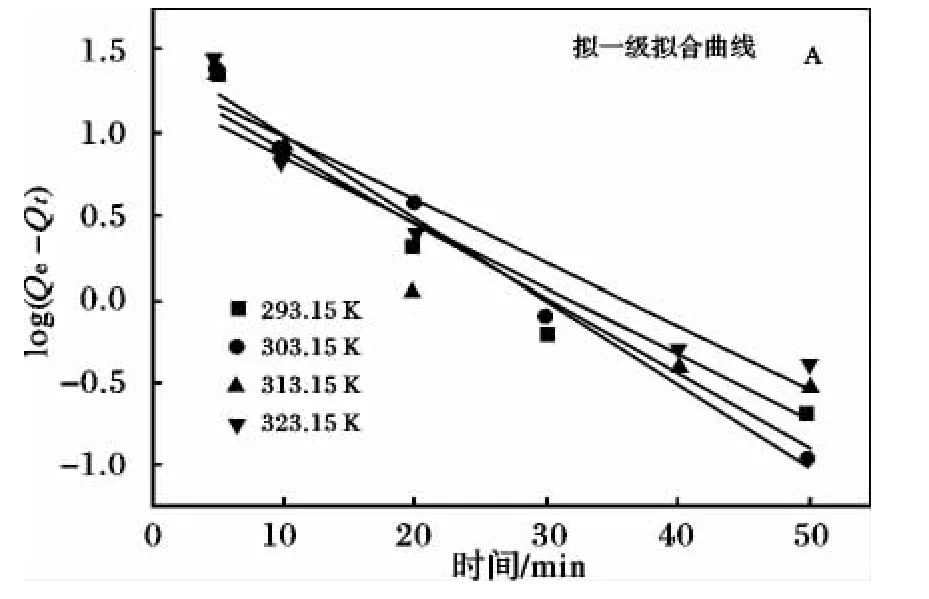

图9 拟一级和拟二级动力学方程拟合曲线Fig.9 Pseudo-first-order and pseudo-second-order fitting curve
2.4 吸附等温线
配制浓度0.1 ~1 mmol/L 的铀酰离子溶液,pH调节到4.3,温度293.15 ~323.15 K,吸附时间为1 h条件下,绘制不同温度下PAO/CMC/Fe3O4对铀酰离子的吸附等温线,结果见图10。
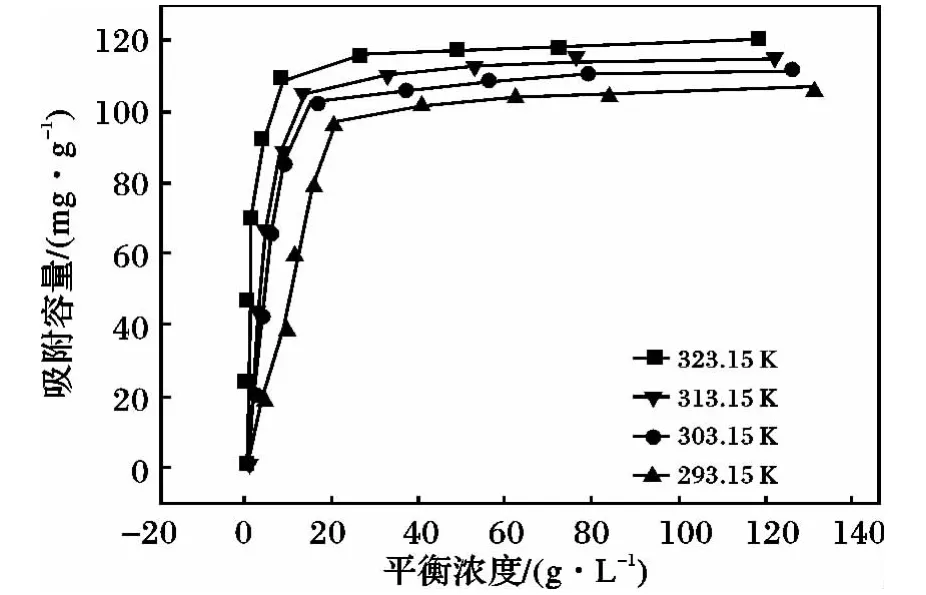
图10 不同温度下的吸附等温线Fig.10 Sorption isotherm for U(VI)on PAO/CMC/Fe3O4 at different temperatures
由图10 可知,最大吸附量119.21 mg/g。将实验数据用Langmuir 等温吸附模型进行模拟[13],结果见表2。

表2 不同温度Langmuir 等温方程参数值Table 2 Values of Langmuir constants at different temperatures
由表2 可知,相关性系数达到0.999,线性较好,理论计算值与实际测量值十分接近,表明PAO/CMC/Fe3O4对铀酰离子的吸附实验符合Langmuir吸附等温线。

其中,Qe是平衡吸附量,Ce是平衡浓度,b 是Langmuir 常数,Qm是饱和吸附量。
3 结论
磁性胺肟基功能化CMC 通过两步法合成,第一步为丙烯腈与CMC/Fe3O4发生接枝聚合反应,第二步是氰基转化为胺肟基,合成的磁性功能化集合材料对铀酰离子具有良好的吸附性能,最大吸附量可达119.21 mg/g,溶液pH 值在4 ~7 之间,吸附效果良好,在pH=5 时吸附效果最好,在吸附剂用量低于1 g/L,吸附容量随着吸附剂用量的增加而增加,当用量达到一定量后不再影响吸附效果,吸附动力学实验表明,PAO/CMC/Fe3O4对铀酰离子的吸附属于一个拟二级动力学吸附过程,而吸附等温方程则说明Langmuir 等温吸附方程能更好的描绘整个吸附过程,理论计算值与实际测定值十分接近,相关性好。
[1] Zhou Shukui,Zeng Guangming,Liu Yingjiu. Study on removal of uranium(VI)from acid leaching uranium-containing wastewater by modified CMC polymer[J]. Applied Mechanics and Materials,2011(100):919-923.
[2] Fang F,Satulovsky J,Szleifer I.Kinetics of proten adsorption and desorption on surfaces with grafted polymers[J].Biophysical Journal,2005(89):1516-1533.
[3] 刘作新,曲威,苗永刚,等. CMC 聚合物对重金属离子的吸附性能[J]. 中国科学院研究生院学报,2009(26):627-632.
[4] Sen T,Seba stianelli A,Bruce I J.Mesoporous silica magnetite nano composite:Fabrication and applications in magnetic bioseparations[J]. J Am Chem Soc,2006(128):7130-7131.
[5] Stphane M,Sbastien V,Fabien G,et al. Magnetic nanoparticle design for medical diagnosis and therapy[J].J Mater Chem,2004(14):2161-2175.
[6] 曹向宇,李垒,陈灏.羧甲基纤维素/Fe3O4复合纳米磁性材料的制备、表征及吸附性能的研究[J]. 化学学报,2010(68):1461-1466.
[7] Simsek S,Ulusoy U. Adsorptive properties of sulfoligninpolyacrylamide graft copolymer for lead and uranium:Effect of hydroxilamine-hydrochloride treatment[J].React Funct Polym,2013(73):73-82.
[8] Koikov L N,Alexeeva N V,Lisitza E A,et al. Oximes amidoximes and hydroxamic acids as nitric oxide donors[J].Mendeleev Commun,1998(8):165-168
[9] Psareva T S,Zakutevrskgy O I,Chubar M I,et al.Uranium sorption on cork biomass[J]. Colloids Surf A:Physiocochem Eng Asp,2005(252):231-236.
[10] Ho Y S,McKay G. The kinetics of sorption of divalent metal ions onto sphagnum moss peat[J]. Water Res,2000(34):735-742.
[11] Yurdakoc M,Scki Y,Yuedakoc S K.Kinetic and thermodynamic studies of boron removal by Siral 5,Siral 40,and Siral 80[J]. J Colloid Interface Sci,2005(286):440-446.
[12] Ho Y S,McKay G.Sorption of dye from aqueous solution by peat[J].Chem Eng J,1998(70):115-124.
[13] Chegrouche S,Mellah A,Telmoune S. Removal of lanthanum from aqueous solutions by natural bentonite[J].Water Res,1997(31):1733-1737.
