一株枯草芽胞杆菌的分离鉴定及其杀虫活性的研究
2014-12-22刘雪梅孙运军丁学知夏立秋
刘 慰,秦 浩,刘 霜,刘雪梅,孙运军,丁学知,夏立秋
(湖南师范大学生命科学学院微生物分子生物学国家重点实验室培育基地,湖南长沙 410081)
枯草芽胞杆菌(Bacillus subtilis)具有典型的芽胞杆菌特征,是一类好氧、内生抗逆孢子的杆状细菌[1],作为一种有益的土壤细菌,对人畜相对安全,发达的分泌系统和抗逆生长的孢子都让其对多种病原菌产生拮抗作用[2].枯草芽胞杆菌抗菌物质的分离纯化及抗菌作用的分子机制、拮抗基因的克隆及其表达调控等研究已经积累了丰富的资料,所筛得的拮抗菌株数量也较多,但是应用到杀虫方面的菌株较少,潜力有待发掘[3].鉴于目前农作物生产中存在的病虫害防治问题,本研究从本地农业生产实际出发,力求获得适合本地区的对鳞翅目害虫具有高效杀虫活性的枯草芽胞杆菌,为开发该菌的生物防治功能和扩大农作物应用范围奠定基础.
本试验首先从土样中筛选的219 株芽胞杆菌中分离出一株枯草芽胞杆菌,在菌落形态特征、生理生化特性鉴定的基础上对其16S rRNA 基因序列进行分析,进一步做了分子生物学鉴定.通过对棉铃虫和甜菜夜蛾进行生测,发现其对棉铃虫有较明显的杀虫效果,并对杀虫活性物质进行了初步分离纯化和测定.
1 材料和方法
1.1 材料
1.1.1 试验样品
1.1.2 菌种 大肠杆菌DH5α(商业化菌株,本室保存)和枯草芽胞杆菌ACCC-10619(中国农业微生物菌种保藏管理中心提供).
1.1.3 培养基 Luria-Bertani(LB)固体培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,明胶20 g,定容至1 L,pH 7.0~7.2.发酵培养基:蛋白胨10 g,葡萄糖3 g,牛肉膏5 g,氯化钠2 g,硫酸锰0.05 g,硫酸镁0.3 g,磷酸氢二钾0.3 g,定容至1 L,调节pH 值为7.3~7.4.
1.1.4 主要酶和试剂 EX Taq DNA 聚合酶,各种限制性内切酶,pMD18-T 载体,购自宝生物工程(大连)有限公司;多功能DNA 纯化回收试剂盒,购自北京百泰克生物技术有限公司.
1.2 方法
1.2.1 菌株的筛选分离和纯化 将经过热处理的土样稀释,制成梯度土壤悬液,对号接种到已标记的LB固体培养基平板上,多次进行划线分离纯化,直至平板上不出现杂菌为止[4-5].
1.2.2 菌株的鉴定
1.2.2.1 细菌菌落形态特征 将LB 固体培养基上纯化的细菌转接到发酵培养基中,30℃,180 r/min,培养24 h,进行革兰氏染色.分别取培养时间段为12、24、36、48、60 h 的菌体用无菌水稀释后,制片在光学显微镜、电镜、激光共聚焦显微镜、扫描电子显微镜下观察菌体形态.
1.2.2.2 菌株生理生化特性鉴定 参照《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》鉴定分离菌株[6].
1.2.2.3 16S rRNA 基因扩增、测序及构建系统发育树
通用引物设计:通过查阅文献资料,设计通用引物(Bf-F,AGAGTTTGATCCTGGCTCAG;Bf-R,ACGGCTACCTTGTTACGACTT),并由上海英骏生物技术有限公司合成.
菌落PCR 模板:取培养时间为24 h 的菌液1mL 至1.5 mL EP 管中,14 000 r/min,离心5 min,无菌水洗后弃上清,重复2 次;加入80 μL 无菌水打匀,煮沸10 min,立即-40 ℃急冻7~8 min;以上重复5 次;融化后,14 000 r/min,离心5 min,取上清做为PCR 模板.
PCR 反应体系与反应条件:反应体系(20 μL),10×EX Tag buffer 2 μL;dNTP mixture(2.5 mmol/L)1.6 μL;Bf-R(10 μmol/L)0.6 μL;Bf-F(10 μmol/L)0.6μL;DNA 2μL;EX Tag 酶0.2 μL;无菌ddH2O 加至20 μL.反应条件:①预变性94 ℃5 min;②变性94 ℃45 s;③退火56.1 ℃45 s;④延伸72 ℃105 s,循环30次;⑤终延伸72 ℃10 min;⑥20 ℃保存.PCR 反应完毕后,取PCR 产物2 μL 进行1%的琼脂糖凝胶电泳检测.
PCR 产物的纯化、连接载体并热转大肠杆菌DH5α 感受态细胞:使用多功能DNA 纯化回收试剂盒对PCR 产物进行纯化后,将其与pMD18-T 载体连接,将连接产物转化进大肠杆菌DH5α 感受态细胞,抽提重组质粒进行双酶切鉴定和PCR 鉴定.
测序及构建系统发育树:将鉴定为阳性克隆的质粒送上海英骏生物技术有限公司测序,获得分离菌株的16S rRNA 基因序列.与美国国家生物技术信息中心(NCBI,http://www.ncbi.nlm.nih.gov)GeneBank 中序列进行同源性比对分析,运用clustalx 和MEGA 软件的Kimura-2-Parameter 模型,采用邻接法(NJ)构建系统发育树.
1.2.3 菌株杀虫活性的测定 棉铃虫生测实验于28 ℃、(70 ±5)%相对湿度的光照培养箱中进行,将不同时段发酵液混合饲料饲喂二龄棉铃幼虫,72 h 后观察并统计每个浓度下的死亡虫数,每种浓度3 个板共72只棉铃虫,独立重复3 次.选用中国农业微生物菌种保藏管理中心提供的一株枯草芽胞杆菌ACCC-10619 作为对照菌,培养至同时间取样.
1.2.4 菌株活性物质的初步纯化分析 取生测实验结果中较为显著的发酵时间段培养液,收集只在该时间段发酵培养液中出现或较高的峰,建立该菌株中未知杀虫活性物质分离可行的HPLC 体系,初步确定杀虫活性物质在该体系HPLC 分离过程中出峰时间.使用的高效液相色谱仪为AKTA punfier 10,色谱柱为Superdex 200,柱手动上样(Inject),上样量为1 mL,流动相为抽滤两次的双蒸水,历时60 min,流速为0.5 mL/min,检测波长为215、254 和280 nm.
从LB 培养基平板上挑取菌落,转接到含有1.4 mL LB 液体培养基的1.5 mL EP 管中,在管盖上用注射器针头扎小孔,30 ℃,1 000 r/min,振荡培养24 h.12 000 r/min,3 min,离心去上清,重复3 次操作.菌体沉淀用50 μL 双蒸水重悬.向重悬菌体中加入等体积的SDS-PAGE Loading Buffer 混匀,沸水浴10 min,12 000 r/min,4 min,离心取上清用于SDS-PAGE 实验.
根据HPLC 收集、并经生测验证的杀虫活性峰进行SDS-PAGE 初步检测,在此基础上进行菌株发酵液上清SDS-PAGE 全蛋白电泳分析,从电泳凝胶上确定相应的活性峰目的蛋白质条带,小心切下经酶解处理后进行质谱(LTQ-MS)分析.
2 结果和分析
2.1 菌株鉴定
2.1.1 形态特征 分离到的菌株呈现短杆状,长约4 μm,宽约0.8~1 μm,革兰氏阳性,菌体可排成长链状,内有椭圆芽孢.菌落边缘不整齐,表面有皱褶、隆起,粗糙不透明,呈污白色或微黄色,见图1.

图1 HX08 菌体细胞和芽孢形态的扫描电子显微镜观察(A:3 000×;B:10 000×)和激光共聚焦显微镜观察(C)Fig.1 The bacteria cell and spore morphology of HX08 by scanning electron microscope(A:3 000×;B:10 000×)and confocal laser scanning microscopy(C)
2.1.2 生理生化特征鉴定 分离菌株的生理生化鉴定结果如表1所示.

表1 HX08 菌株生理生化特征鉴定Tab.1 Physiological and biochemical characteristics of the strain HX08
2.1.3 16S rRNA 序列的PCR 扩增结果及系统发育分析 将发酵菌液进行PCR 扩增后的产物经琼脂糖电泳检测,在1 500 bp 左右检测到较亮条带(图2).将PCR 产物纯化并连接pMD18-T 载体,热激转化至E.coli DH5α 中,挑取7~8 个重组质粒转化E.coli DH5α 的转化子,进行重组质粒PCR 检测(图3),提取PCR 检测为阳性的转化子质粒经BamHⅠ和Hind Ⅲ双酶切得到约1 500 bp 的插入片段和约2 656 bp 的T 载体片段(图4),挑取阳性转化子交上海英骏生物技术有限公司测序,获得新菌株HX08 的16S rRNA 基因序列.

图2 PCR 扩增分离菌株16S rRNA 基因琼脂糖凝胶电泳Fig.2 Agarose electrophoresis of the PCR amplification of 16S rRNA from the strain HX08

图3 连接pMD18-T 重组子琼脂糖凝胶电泳Fig.3 Agarose electrophoresis of PCR amplification from the ecombinant plasmids

图4 重组质粒双酶切鉴定琼脂糖凝胶电泳检测图Fig.4 Agarose electrophoresis of the PCR amplification from the enzyme identification
测序结果显示,扩增出的16S rRNA 长度为1 567 bp,确定该菌株属于枯草芽胞杆菌属,将其命名为HX08,并构建了系统发育树(图5).
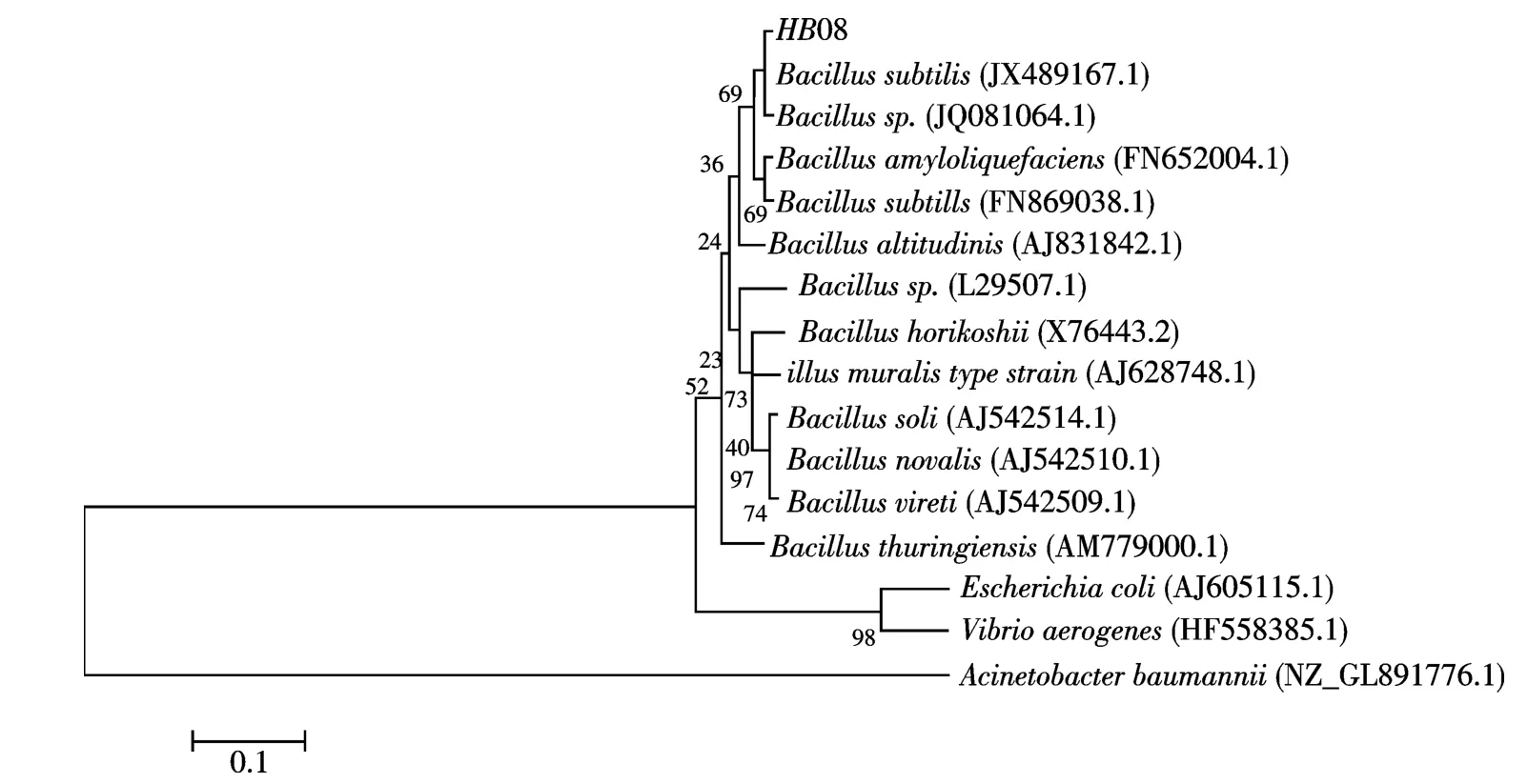
图5 HX08 菌株系统发育树Fig.5 The phylogenetic tree of the strain HX08 based on 16S rRNA gene sequences
2.2 HX08 菌株杀虫活性研究
将HX08 菌株发酵液按照不同体积混合等量的饲料饲喂棉铃虫幼虫.生测结果计数如表2所示.
同时将表2 数据输入SPSS 统计学分析软件中计算其半致死浓度(LC50)和95%置信区间,得到HX08 菌株与对照菌株对棉铃虫幼虫的生物统计学结果(表3).

表2 HX08 和对照菌对棉铃虫幼虫的生物活性测定结果比对Tab.2 Toxicity of B.S.strain against Helicoverpa armigera
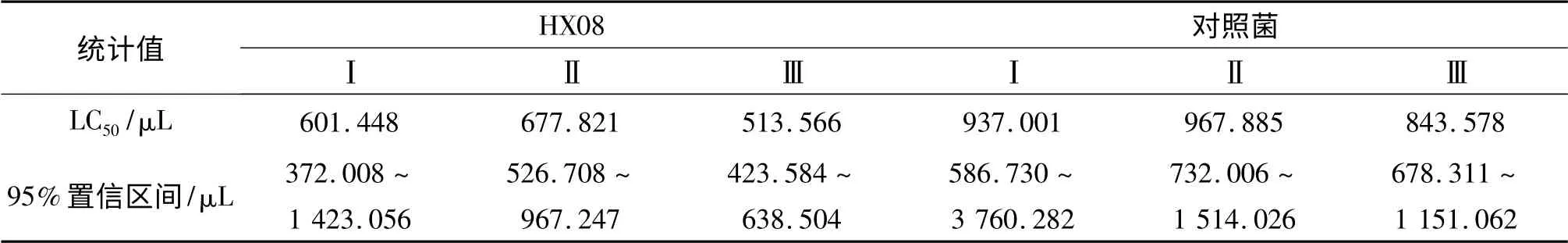
表3 HX08 菌株对棉铃虫幼虫的杀虫效果Tab.3 The insecticidal efficacy of the strain HX08 against Helicoverpa armigera
从表3 可以看到,HX08 菌株的LC50约为597.6 μL,对照菌的LC50约为916 μL.将表3 数据分成两组输入SPSS 软件中,使用软件中的“配对样本t 检验”进行统计学显著性分析,得到分析结果(表4).通过SPSS软件得出实验菌株的SD=597.611 7 ±82.194 67,对照菌株的SD=916.154 7 ±64.722 37.从表4 结果可以看到,两组数据的LC50在95%置信区间内计算的差异显著性值(sig.)为0.000,即P <0.05;且t 值为9.943,即t >2.015,由以上结果可判定两株菌株的LC50具有显著差异,实验菌株的杀虫活性高于对照菌株.
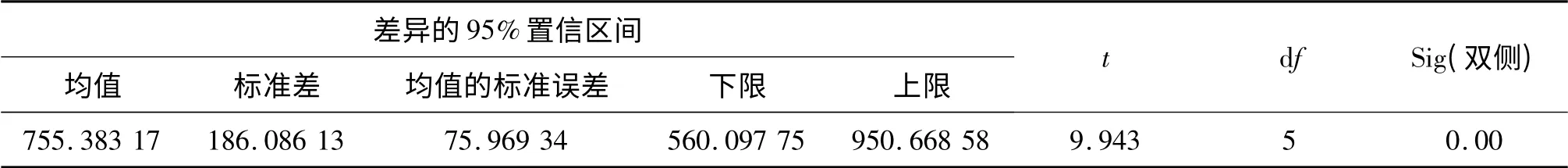
表4 HX08 菌株对棉铃虫幼虫毒力的差异显著性分析Tab.4 The significance level of the strain HX08 against Helicoverpa armigera
2.3 杀虫活性物质的分离与纯化
上述生测实验结果表明HX08 菌株60 h 发酵培养液的杀虫效果较为明显,故拟采用高效液相色谱对60 h 发酵液进行分离纯化.发酵液经HPLC 分离后共获得58 管收集液,收集各峰液体冻干,用于杀虫活性测定,发现31~32 管即2 号峰处活性较高(图6).由此推断,杀虫活性物质出峰的时间大约为收集到第15 mL处的时间,即约31 min 处.
由生测结果看出,新菌株HX08 与中国农业微生物菌种保藏管理中心提供的枯草芽胞杆菌ACCC-10619均有杀虫效果,但是效果差异较为明显.分别对两株菌全蛋白进行SDS-PAGE 检测分析,两株菌的SDSPAGE 全蛋白图谱显示有相似性,但存有一定的差异,分离菌株HX08 在25 000 处有一条较亮条带(图7),同时后续生测实验证明此条带具有杀虫活性.
将目的条带经质谱鉴定发现,该蛋白峰值较好,并出现连续的y、b 离子,用Thermo Proteome Discoerer 软件检索蛋白质数据库进行鉴定,检索得到4 种蛋白,其中排在首位的蛋白代号J7JRS4,质谱检测出的肽段质量与数据库中已知蛋白指纹进行匹配,吻合度达到了46.3%,搜索枯草芽胞杆菌蛋白质分子库确定为草酸脱羧酶(Oxalate decarboxylase),特异性肽段数为7 条,其他在数据库中检索出的蛋白质的得分值和吻合肽段数都远远低于草酸脱羧酶的检索结果(图8).
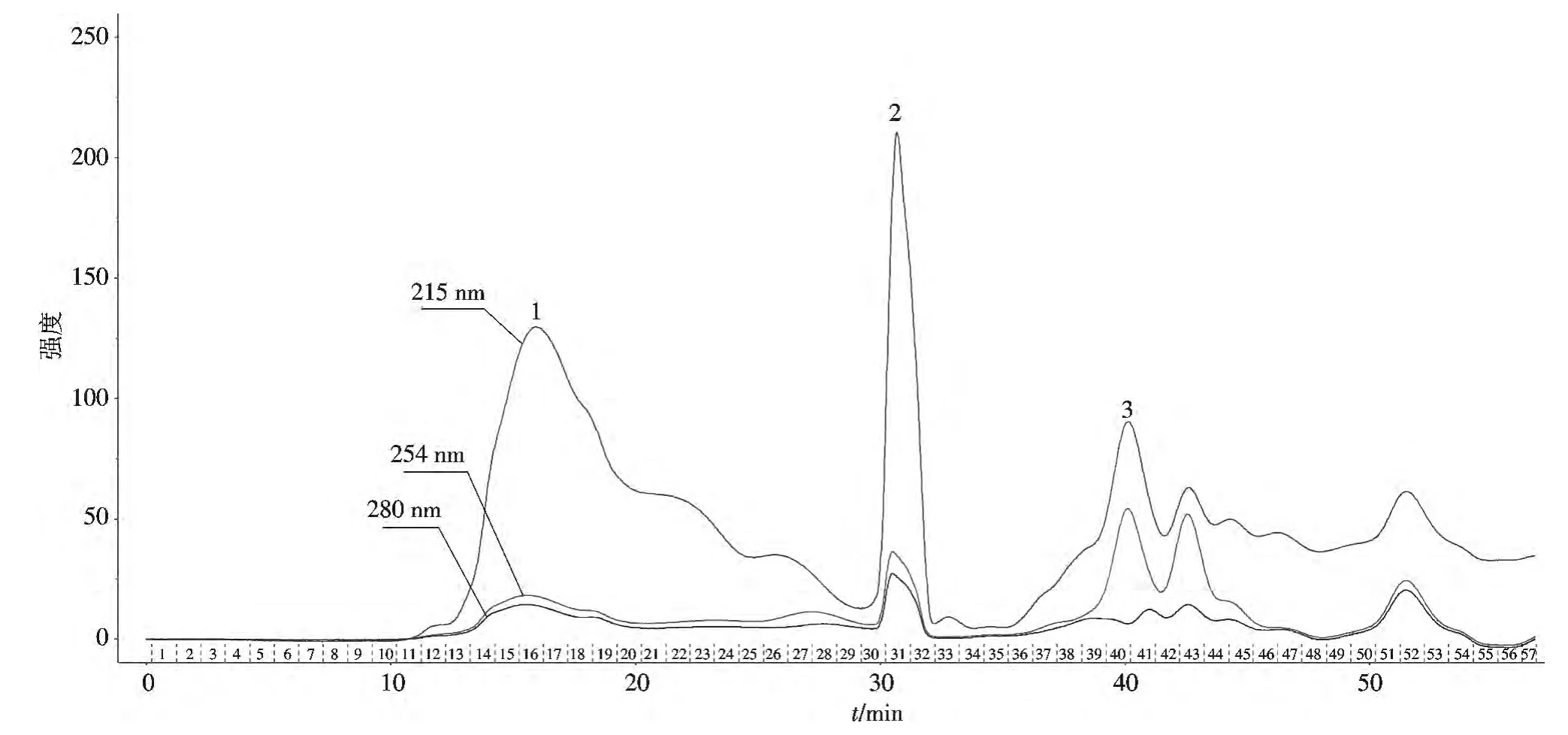
图6 新菌株HX08 活性物质的HPLC 分析Fig.6 HPLC chromatograms of activity produced by the strain HX08
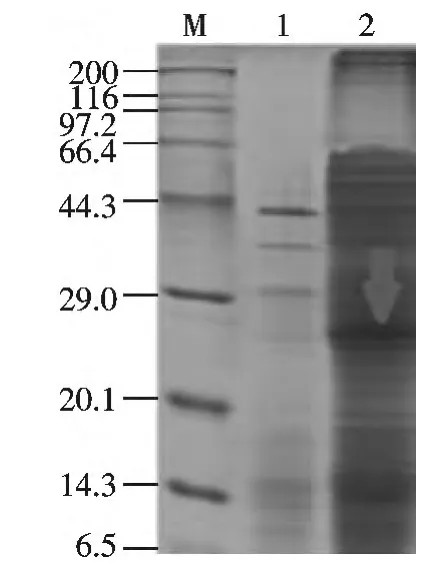
图7 HX08 菌株SDS-PAGE 图谱分析Fig.7 SDS-PAGE pattern analysis of the strain HX08

图8 HX08 菌株杀虫活性蛋白LTQ-MS 图谱Fig.8 LTQ-MS pattern of bioactive protein
3 讨论
根据该菌在平板上的菌落形态,初步推断为芽胞杆菌类,故采用高温法筛选,优化了菌株的分离过程,提高了分离效率.本研究通过一系列方法,对从湖南长沙市采集到的土样中利用高温条件筛选到的219 株芽胞杆菌中,分离得到一株新菌株并进行了鉴定和归类.将测得的16S rRNA 基因序列在NCBI 中以blast 搜寻,该株菌与Bacillus subtilis strain CU12(JX489167.1)具有很高相似性,序列相似性为99%,可认为属于枯草芽胞杆菌中一个新的菌株(HX08).
研究发现枯草芽胞杆菌Bacillus subtilis 在低pH 环境下也可以诱导合成草酸脱羧酶[7-8],枯草芽胞杆菌生防菌株Bs-916 可产生抗菌蛋白对核盘菌(Sclerotinia sclerotiorum)和立枯丝核菌(Rhizoctonia solani)的菌丝生长具有明显的抑制作用,随后鉴定该蛋白为草酸脱羧酶[9-10].该酶单体结构含有2 个结构相似的cupin结构域,并且在每个域的中心部位含有一个金属结合位点,和周围的氨基酸残基结合成为双核中心,另外它的N-末端还含有短螺旋突出肽链[8],该酶的Mn2+催化活性中心可能主要是在结构域II 的结合位点上[11-16],本研究分离出的活性物质的具体杀虫机理需要进一步深入研究.HX08 菌株60 h 的发酵液杀虫效果更为明显,说明进入生长稳定期后菌株的杀虫活性物质仍然继续增加,能提高杀虫效果.鉴于目前市场很少有能有效防治鳞翅目害虫的枯草芽胞杆菌微生物制剂[17-18],本实验分离出对棉铃虫等鳞翅目害虫有致死毒力的杀虫菌株,对研究草酸脱羧酶杀虫作用分子机制及研发新型杀虫剂提供了重要基础,为生态农业和绿色农产品产业发展提供支撑.
[1]刘志恒.现代微生物学[M].北京:科学出版社,2002.
[2]李 明,双 宝,李海涛,等.枯草芽孢杆菌的研究与应用[J].东北农业大学学报,2009,40(9):111-114.
[3]程洪斌,刘晓桥,陈红漫.枯草芽孢杆菌防治植物真菌病害研究进展[J].上海农业学报,2006,22(1):109-112.
[4]温海燕.枯草芽孢杆菌的分离与初步鉴定[J].兽医科技,2012(3):118-119.
[5]曹茂新,洪 枫,朱利民.草酸脱羧酶及其应用[J].中国生物工程杂志,2005,25(Z):170-175.
[6]LIU Y,CHEN Z,NG T B,et al.Bacisubin,an antifungal protein with ribonuclease and hemagglutinating activities from Bacillus subtilis strain B-916[J].Peptides,2007,28(3):553-559.
[7]刘永锋,陈志谊,周明国,等.枯草芽孢杆菌Bs-916 的抑菌活性及其抑菌物质初探[J].农药学学报,2007,9(1):92-954.
[8]于俊杰,陈志谊,胡建坤,等.枯草芽孢杆菌Bs-916 草酸脱羧酶基因Bacisubin 的克隆、原核表达及其表达产物的酶活性分析[J].江苏农业学报,2012,28(3):497-502.
[9]李林珂,高玉千,崔 锦,等.一株蛋白酶产生菌的筛选及酶学性质研究[J].河南农业科学,2006(3):50-52.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,1999:370-384.
[11]BANERJEE A B,BOSE S K.Amino-acid configuration of mycobacillin[J].Nature,1963,200:471.
[12]TAMEHIRO N,OKAMOTO Y,OKAMOTO S,et al.Bacilysocin,a novel phospholipid antibiotic produced by Bacillus subtilis 168[J].Antimicrob agents chemother,2002,46:315-320.
[13]沈锦玉,尹文林,曹 铮,等.枯草芽孢杆菌B115 抗菌蛋白的分离纯化及部分性质[J].水生生物学报,2005,29(6):689-693.
[14]白延琴,辛小玲,来有志,等.枯草芽孢杆菌的分离筛选[J].畜牧兽医杂志,2013,32(2):24-27,31.
[15]BESSON F,MICHEL G.Isolation and characterization of new iturins:iturin D and iturin E[J].J Antibiotics,1987,40(4):437-442.
[16]DELEU M,PAQUOT M,NY LANDER.Fengycin interaction with lipidmono layers at the air aqueous interface implications for the effect of fengycin on b iologicalm emb ranes[J].Colloid Interface Sci,2005,283(2):358-365.
[17]陈志谊,许志刚,陆 凡,等.拮抗细菌B-916 培养液对水稻纹枯病菌的抗生活性及其抗菌物质的研究[J].江苏农业学报,2000,16(3):148-152.
[18]罗楚平,陈志谊,刘永锋,等.生防菌Bs-916 合成脂肽类化合物Bac 操纵子突变株构建及功能[J].微生物学报,2009,49(4):445-452.
