单纯疱疹病毒包膜糖蛋白gC合成及验证
2014-12-18张宇姚煦顾汉艳王宝玺刘军
张宇 姚煦 顾汉艳 王宝玺 刘军
单纯疱疹病毒包膜糖蛋白gC合成及验证
张宇 姚煦 顾汉艳 王宝玺 刘军
目的利用基因工程技术表达单纯疱疹病毒(HSV)包膜糖蛋白(gC)并进行验证。方法分两段合成gC蛋白,分别合成基因GC-F和GC-R,并分别将基因亚克隆进pSumo-Mut(含Stu I和Xho I酶切位点)和pCzn1(含Nde I和XhoI酶切位点)表达载体,获得pSumo-Mut-GC-F和pCzn1-GC-R质粒。将两重组质粒转化ArcticExpressTM(DE3)原核宿主菌,异丙基硫代半乳糖苷(IPTG)诱导表达目的蛋白,经Ni柱亲和纯化,最终获得高纯度蛋白。采用Western印迹法检测重组GC-F和GC-R两段蛋白与HSV IgG的结合情况。结果应用全基因合成方法获得GC-F和GC-R基因片段,经SDS-PAGE鉴定分析,主要分布于沉淀层,经亲和层析后获得的蛋白纯度在80%以上,并可被人抗HSV-1抗体(IgG)阳性血清识别。结论利用基因工程技术构建融合表达载体,并经IPTG诱导成功表达gC蛋白,与HSV-1感染血清反应阳性,是后续进行功能研究的理想实验材料。
湿疹;单纯疱疹病毒属;包膜糖蛋白
特应性皮炎(atopic dermatitis,AD)患者存在皮肤屏障功能异常如抗微生物肽分泌减少[1],加之免疫平衡倾向Th2型为主导[2],所以AD患者对多种病原微生物易感,并直接影响疾病的严重度[3]。单纯疱疹病毒1型(HSV-1)感染引起的疱疹样湿疹(eczema herpeticum)是AD较严重的并发症。HSV-1有12种特异性抗原糖蛋白,包膜糖蛋白(glycoprotein C,gC)是其中主要的亚型。HSV包膜蛋白在病毒的吸附、入侵和刺激机体产生免疫反应中具有重要作用,其中包膜糖蛋白gC蛋白具有重要的抗原表位,能诱发机体特异性免疫应答。病毒糖蛋白可与树突细胞表面的识别糖基结构的模式识别受体C型凝集素受体结合,内吞至细胞内后,引发机体的免疫反应[4]。为揭示HSV-1 gC蛋白在AD发病中的作用和机制,本研究在体外诱导合成了HSV-1包膜糖蛋白gC,并经过验证证实纯化获得的糖蛋白片段可与HSV-1感染患者血清中的特异性HSV-1抗体结合。
材料与方法
一、材料
pSumo-Mut质粒和pCzn1表达质粒(南京钟鼎生物技术有限公司),DH5α为本实验室保存,ArcticExpressTM(DE3)(美国Agilent Tehnologies公司),蛋白参照物(美国Invitrogen公司),Sumo蛋白酶(南京钟鼎生物技术有限公司),异丙基-β-D-硫代半乳糖苷(IPTG)、丙烯酰胺-甲叉双丙烯酰胺(Acr-Bis)、三羟甲基氨基甲烷(美国Sigma公司),十二烷基硫酸钠(SDS,美国Amersco公司),四甲基乙二胺(TEMED,美国 Bio-Rad公司),Tyrptone、酵母浸液(英国Oxoid公司),0.22 μm无菌滤器和透析袋(美国Millpore公司),Ni2+-IDA亲和层析胶(美国Novagen公司),琼脂糖(美国Sigma公司),DNA胶纯化试剂盒、质粒小提试剂盒(美国AXYGEN公司),鼠抗6组氨酸蛋白His单克隆抗体(美国abcam公司,货号AB1791),兔抗鼠HRP标记的多克隆抗体(美国Millpore公司,货号AP113p),鼠抗人HSV-1 gC包膜蛋白抗体(美国abcam公司,AB6509)。其他试剂均为国产分析纯。
二、方法
1.pSumo-Mut-GC-F和pCzn1-GC-R载体构建及鉴定:根据Genebank查找的gC蛋白全长序列,选取最大一段ORF,分别合成基因GC-F和GC-R,包括设计的酶切位点基因片段。其中GC-F防止蛋白移码,在启动密码子后额外增加碱基T。全基因合成后,利用1%琼脂糖电泳并切胶回收两段基因片段。胶回收产物GC-F片段分别以Stu I和Xho I内切酶酶切,连接于pSumo-Mut载体,获得pSumo-Mut-GC-F质粒,见图1a。胶回收产物GC-R片段分别以Nde I和XhoI内切酶酶切,连接pCzn1载体,获得pCzn1-GC-R质粒,见图1b。
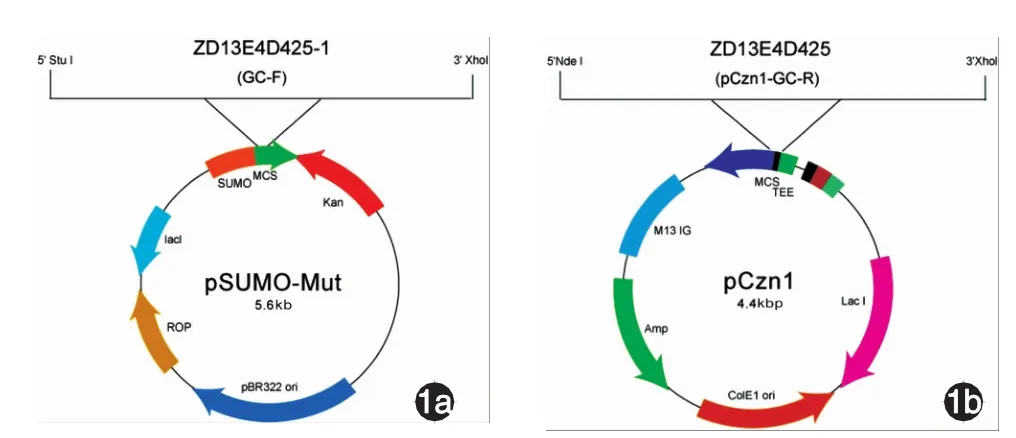
图1 pSumo-Mut-GC-F和pCzn1-GC-R载体构建 1a:pSumo-Mut-GC-F质粒图;1b:pCzn1-GC-R质粒图
2.pSumo-Mut-GC-F和pCzn1-GC-R载体转化至大肠杆菌ArcticExpressTM(DE3):分别将pSumo-Mut-GC-F和pCzn1-GC-R重组质粒5 ng加入100 μl ArcticExpressTM(DE3)感受态细菌中,置冰上20 min;42℃热激90 s,迅速置冰中5 min;加入600 μl 37℃预热的LB培养液;37℃,220 r/min振摇1 h,离心后全部涂布于含50 mg/L Kan的LB平板,37℃倒置培养过夜;挑取转化平板上的单克隆接种于含50 mg/L卡那霉素的3 ml LB培养液试管中,37℃220 r/min振摇过夜;翻译后GC-F蛋白序列为:MNWSHPQFEKSSGSSGGHHHHHHGGSG GSGSDSEVNQEAKPEVKPEVKPETHINLKVSDGSSE IFFKIKKTTPLRRLMEAFAKRQGKEMDSLRFLYDGI RIQADQAPEDLDMEDNDIIEAHREQIGGMSETASTG PTITAGAVTNASEAPTSGSPGSAASPEVTPTSTPNPN NVTQNKTTPTEPASPPTTPKPTSTPKSPPTSTPDPKPK NNTTPAKSGRPTKPPGPVWCDRRDPLARYGSRVQI RCRFRNSTRMEFRLQIWRYSMGPSPPIAPAPDLEEV LTNI,双划线区域为Sumo蛋白,划线区域为目的蛋白GC-F,融合蛋白Sumo-GC-F理论分子量为30 910,GC-F蛋白理论分子量为16 740。翻译后GC-R蛋白序列为:MNHKVHHHHHHMIGEVTPATQGMY YLAWGRMDSPHEYGTWVRVRMFRPPSLTLQPHAV MEGQPFKATCTAAAYYPRNPVEFDWFEDDRQVFN PGQIDTQTHEHPDGFTTVSTVTSEAVGGQVPPRTFT CQMTWHRDSVTFSRRNATGLALVLPRPTITMEFGV RHVVCTAGCVPEGVTFAWFLGDDPSPAAKSAVTAQ ESCDHPGLATVRSTLPISYDYSEYICRLTGYPAGIPV LEHHGSHQPPPRDPTERQVIEAIEWVG,加上N端的His标签,蛋白理论分子量为29 340,GC-R蛋白理论分子量为27 910。
3.不同浓度IPTG诱导pSumo-Mut-GC-F和pCzn1-GC-R载体融合蛋白的表达:将少量扩繁的阳性单克隆培养液扩大培养,按1∶100接种于含50 mg/L卡那霉素的30 ml LB培养液中,37℃220 r/min振摇至菌体A600为0.4(约2 h);取出1 ml培养物,10 000×g室温离心2 min,用100 μl 1×上样缓冲液重悬菌体上清及沉淀(未IPTG诱导表达组);向剩余的培养物中加入终浓度0.1~1 mmol/L的IPTG。37℃220 r/min振摇4 h,诱导GC-F和GC-R融合蛋白表达。
4.GC-F-Sumo和GC-R-His融合蛋白的纯化及鉴定:将IPTG诱导表达的培养菌液低温离心6 000×g,10 min,菌体沉淀重悬于20 ml溶解缓冲液[20 mmol/L Tris-HCl,含1 mmol/L苯甲基磺酰氟化物(PMSF)和细菌蛋白酶抑制剂,pH 8.0],超声破碎(功率400 W,4 s,间歇8 s,共20 min);将超声破碎的细胞裂解液4℃10 000×g离心20 min,收集沉淀;使用包涵体洗涤液(20 mmol/L Tris,1 mmol/L EDTA,2 mol/L尿素,1 mol/L NaCl,1%Triton X-100,pH 8.0)洗涤包涵体3次;用溶解缓冲液[20 mmol/L Tris,5 mmol/L二硫苏糖醇(DTT),8 mol/L尿素pH8.0],按一定比例溶解包涵体,4℃放置过夜;室温,17 540×g离心15 min;将包涵体溶解液滴加到20 mmol/L Tris,pH8.0缓冲液逐步成倍梯度稀释,缓慢搅拌;至尿素浓度达到0.5 mol/L时,将蛋白溶液装入透析袋,于4℃、20 mmol/L磷酸盐缓冲溶液、pH7.4中透析过夜。
Ni柱亲和纯化:将以上所得蛋白,利用Biologic LP层析系统,上样至Ni2+-IDA结合缓冲液预平衡的Ni2+-IDA-Sepharose CL-6B亲和层析柱(0.8 cm,2 cm);分别用Ni2+-IDA结合缓冲液、Ni2+-IDA洗涤缓冲液(160 mmol/L Tris-HCl,20 mmol/L咪唑,0.5 mol/L NaCl,pH7.9)、Ni2+-IDA洗脱琼脂糖凝胶(160 mmol/L Tris-HCl,250 mmol/L咪唑,0.5 mol/L NaCl,pH7.9)冲洗,至流出液A280值到达基线时,分别收样;取所收各管样品10 μl。
纯化GC-F-Sumo和GC-R-His蛋白鉴定:对诱导表达的培养菌液进行变复性和Ni柱亲和纯化后,获得的GC-F-Sumo融合蛋白和GC-R-His融合蛋白进行10%SDS-PAGE分析。
5.Western印迹检测重组蛋白:分别取合成的gC两段重组蛋白GC-F和GC-R各10 μl加入等体积2×样品缓冲液,充分混匀后90℃水浴5 min,然后2 600×g离心1 min,每个泳道上样20 μl;上样完毕后,聚丙烯酰胺凝胶先90 V跑完积层胶,再将电压升至200 V直到电泳结束;电泳结束后,取下凝胶进行转膜,恒压100 V转膜,约为1.5 h;电转结束后,取下膜后先用磷酸盐缓冲溶液洗涤4次,每次5 min。然后置于5%脱脂奶粉封闭液中封闭37℃,1 h;用封闭液稀释一抗,膜在一抗稀释液中37℃反应1 h;洗膜4次,每次5 h;用含5%牛奶的封闭液稀释二抗。膜在二抗中37℃反应1 h;洗膜ECL显影。
结 果
一、pSumo-Mut-GC-F和pCzn1-GC-R融合基因表达载体构建
全基因合成的方法得到带有Stu I和Xho I酶切位点的gC-F,酶切后连接入pSumo-Mut原核表达载体,连接后Stu I酶切位点消失;带有Nde I和XhoI酶切位点的gC-R连接入pCzn1载体,获得pCzn1-GC-R质粒。将构建好的重组质粒pSumo-Mut-GC-F用Xba I和Xho I双酶切,电泳后得2条片段,2片段的位置与理论值一致(1条是5 183 bp,1条是901 bp),说明克隆成功(图2)。将构建好的重组质粒pCzn1-GC-R用Nde I和XhoI双酶切,电泳得2条线性片段,2片段的位置与理论值一致(1条为4 380 bp,1条为753 bp),说明克隆成功(图2)。将质粒送Invitrogen公司测序,测序结果显示,GC-F-ORF和GC-R-ORF区域与合成基因序列100%一致。
二、0.5 mmol/L IPTG 37℃诱导pSumo-Mut-GC-F和pCzn1-GC-R载体融合蛋白的表达
挑取转化平板上成功将pSumo-Mut-GC-F和pCzn1-GC-R载体转化至大肠杆菌ArcticExpressTM(DE3)阳性单克隆菌落,扩繁摇菌。取出1 ml培养物作为IPTG阴性诱导组(未IPTG诱导表达组),加入终浓度0.1~1 mmol/L的IPTG进行诱导(IPTG诱导表达组)。10%SDS-PAGE蛋白电泳分析,未加入诱导剂IPTG组GC-F-Sumo蛋白条带杂乱,含有非特异性蛋白较多,0.5 mmol/L IPTG诱导组蛋白条带清晰,且沉淀中获得的目的蛋白条带清晰,非特异性蛋白干扰较少(图3)。含pCzn1-GC-R质粒菌液培养物中加入终浓度0.5 mmol/L IPTG后,分别在11℃和37℃条件下进行诱导表达。10%SDSPAGE分析,GC-R-His蛋白电泳结果见图4。
三、GC-F-Sumo和GC-R-His蛋白纯化及鉴定
将0.5 mmol/L IPTG诱导表达的培养菌液沉淀进行变复性和Ni柱亲和纯化后,获得纯化的GCF-Sumo融合蛋白,10%SDS-PAGE分析纯度在80%以上,45 000附近(图5a)。纯化的GC-R-His融合蛋白,10%SDS-PAGE分析纯度在85%以上,35 000附近(图5b)。

图2 重组质粒pSumo-Mut-GC-F、pCzn1-GC-R双酶切电泳图M:标准参照物;1:重组质粒pSumo-Mut-GC-F;2:重组质粒pCzn1-GC-R

图4 IPTG诱导pCzn1-GC-R载体融合蛋白的表达 GC-R-His融合蛋白经0.5 mmol/L IPTG在低温11℃和37℃诱导条件下,上清及沉淀中均可表达,且菌体沉淀中获得的目的蛋白条带清晰,非特异性蛋白干扰较少。M:标准参照物;1:37℃未诱导;2:37℃IPTG诱导菌液沉淀;3:37℃IPTG诱导菌液上清;4:11℃未诱导;5:11℃IPTG诱导菌液沉淀;6:11℃IPTG诱导菌液上清
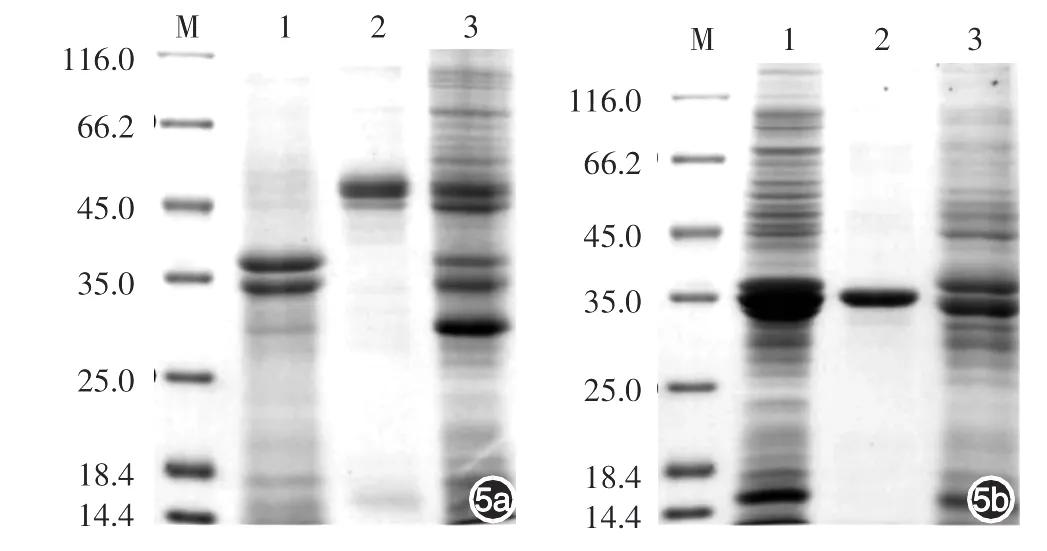
图5 GC-F-Sumo(5a)和GC-R-His(5b)蛋白纯化及鉴定 M:标准参照物;1:流出液;2:洗脱液;3:0.5 mmol/L IPTG诱导。经变复性Ni柱纯化后GC-F-Sumo融合蛋白纯度达80%以上,GC-R-His融合蛋白纯度在85%以上
四、Western印迹检测重组蛋白
1.使用抗His单克隆抗体检测重组蛋白:一抗为鼠抗人His单克隆抗体,二抗为兔抗鼠HRP标记的多克隆抗体。经抗His抗体鉴定,表达的两段gC蛋白(GC-F-Sumo和GC-R-His)均有阳性条带,确系含有His标签,见图6。
2.使用抗HSV-1 gC包膜单克隆抗体检测重组蛋白:一抗鼠抗人HSV-1 gC单克隆抗体,1∶1 000稀释;二抗为兔抗小鼠HRP标记的多克隆抗体,1∶2 500。经抗HSV-1 gC鉴定,表达的两段gC蛋白(GC-F-Sumo和GC-R-His)均无阳性条带,由于此一抗为商品化的单克隆抗体,是以HSV为抗原进行免疫,筛选单克隆抗体,获得的抗体不一定针对本研究诱导合成蛋白gC衣壳蛋白抗原位点。
3.使用HSV IgG阳性血清检测重组蛋白:一抗为患者血清,摸索稀释条件为1∶10;二抗为兔抗人HRP-IgG,1∶500稀释。对照组为健康人血清,1∶10稀释。经血清鉴定,表达的两段gC蛋白(GC-F-Sumo和GC-R-His)均有阳性条带,证明gC蛋白表达成功,见图7。
讨 论
研究发现,约3%~6%的AD患者易并发HSV感染引起的疱疹样湿疹[5],导致病情加重和治疗困难。并且HSV感染使AD患者对多种过敏原的敏感性增加,更易使免疫反应向Th2型极化和加重病情,并能减少表皮内产生干扰素-γ(IFN-γ)的Th1细胞数量,导致多种感染,最常见的为金黄色葡萄球菌、化脓性链球菌和绿脓杆菌感染[6]。还有学者推测HSV加重AD皮损的原因可能与金黄色葡萄球菌相似,包括HSV作为超抗原引起免疫反应,使局部T细胞活化,释放细胞因子等[7];但具体机制还不清楚,有待于进一步深入研究。
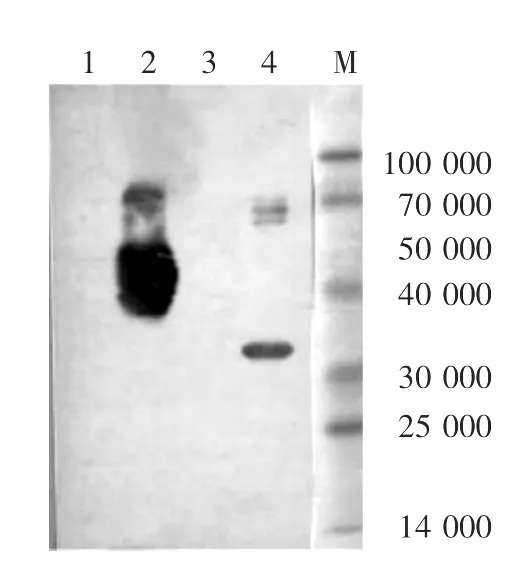
图6 抗His单克隆抗体检测重组蛋白 表达的两段gC蛋白(GC-F-Sumo和GCR-His)均有阳性条带,确系含有His标签。M:标准参照物;1、3:空白对照;2:GC-F-Sumo蛋白;4:GC-R-His
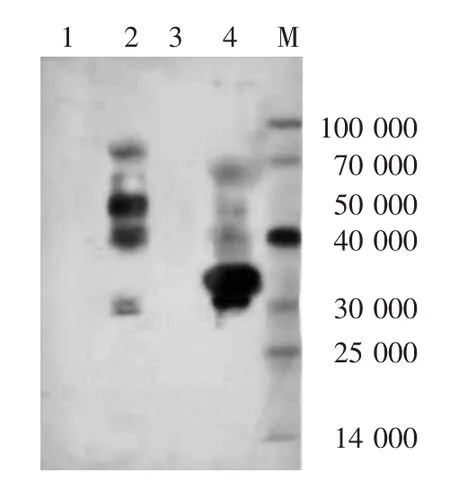
图7 使用感染单纯疱疹病毒患者血清(HSV IgG阳性)检测重组蛋白 表达的两段gC蛋白(GC-F-Sumo和GC-R-His)均有阳性条带,证明gC蛋白表达成功 M:标准参照物;1、3:健康人血清;2、4:感染HSV患者血清
有研究显示,HSV-1包膜糖蛋白gC可与树突细胞(DC)表面的C型凝集素受体DC-SIGN结合,结合量与DC-SIGN受体的表达量成正比。HSV-1经与DC-SIGN结合后,介导了病毒的内吞进入树突细胞内,导致细胞感染[4]。进入DC细胞内18 h后,HSV仍以粒子形式存在,而树突细胞的免疫刺激能力减弱[8],还可以通过细胞-细胞接触形式将HSV传播给接触的细胞,在扩大感染及免疫逃避中起重要作用。我们的前期研究工作显示(数据尚未发表),AD患者树突细胞表面表达DC-SIGN数量明显增加,并且与患者病情呈正相关;DC-SIGN特异性识别抗原表面的糖基结构在体外可与多种病原菌或过敏原的糖基蛋白特异性结合,介导特应性皮炎的发病。故我们推测HSV的包膜糖蛋白gC通过C型凝集素受体,在介导特应性皮炎的发病中可能发挥了重要作用。
为进行后续的实验研究,我们在本实验中应用全基因合成方法获得gC的两个基因片段GC-F和GC-R,分别克隆至pSumo-Mut和pCzn1两表达载体中。因为HSV蛋白包膜具有糖基化结构,糖基化是糖蛋白被识别结合的重要因素之一,所以我们选择体外诱导合成gC在原核宿主菌中表达,具有糖基化结构并可被C凝集素受体识别。经SDS-PAGE鉴定,分析融合蛋白主要分布于沉淀,通过变复性的方式,重溶后Ni亲和纯化,最终获得纯度在80%以上的GC-F-Sumo和GC-R-His蛋白。经人抗HSV-1血清检测GC-F-Sumo和GC-R-His表达成功。希望为进一步研究HSV如何引起树突细胞感染及介导何种型别免疫应答提供材料。
[1]Hata T R,Kotol P,Boguniewicz M,et al.History of eczema herpeticum is associated with the inability to induce human βdefensin(HBD)-2,HBD-3 and cathelicidin in the skin of patients with atopic dermatitis[J].Br J Dermatol,2010,163(3):659-661.
[2]Wollenberg A,Zoch C,Wetzel S,et al.Predisposing factors and clinical features of eczema herpeticum:a retrospective analysis of 100 cases[J].J Am Acad Dermatol,2003,49(2):198-205.
[3]Luca N J,Lara-Corrales I,Pope E.Eczema herpeticum in children:clinical features and factors predictive of hospitalization [J].J Pediatr,2012,161(4):671-675.
[4]de Jong MA1,de Witte L,Bolmstedt A,et al.Dendritic cells mediate herpes simplex virus infection and transmission through the C-type lectin DC-SIGN [J].J Gen Virol,2008,89(Pt 10):2398-2409.
[5]Tay Y K,Khoo B P,Goh C L.The epidemiology of atopic dermatitis at a tertiary referral skin center in Singapore [J].Asian Pac J Allergy Immunol,1999,17(3):137-141.
[6]Wollenberg A,Wetzel S,Burgdorf WH,et al.Viral infections in atopic dermatitis:pathogenic aspects and clinical management[J].J Allergy Clin Immunol,2003,112(4):667-674.
[7]Beck L A,Boguniewicz M,Hata T,et al.Phenotype of atopic dermatitis subjects with a history of eczema herpeticum [J].J Allergy Clin Immunol,2009,124(2):260-269.
[8]Novak N,Peng W M.Dancing with the enemy:the interplay of herpes simplex virus with dendritic cells[J].Clin Exp Immunol,2005,142(3):405-410.
Synthesis and verification of herpes simplex virus envelope glycoprotein gC
Zhang Yu*,Yao Xu,Gu Hanyan,Wang Baoxi,Liu Jun.*Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s:Yao Xu,Email:dryao_xu@126.com;Liu Jun,Email:drliu_jun@126.com
Objective To synthesize herpes simplex virus(HSV)envelope glycoprotein gC using gene engineering techniques,and to verify its expression.Methods Two separate parts of the HSV envelope glycoprotein gC,i.e.,GC-F and GC-R,were respectively synthesized.The GC-F and GC-R genes were synthesized,subcloned into the expression vectors pSumo-Mut(containing recognition sequences for endonucleases Stu1 and XhoI)and pCzn1(containing recognition sequences for endonucleases NdeI and XhoI)respectively to form the recombinant plasmids pSumo-Mut-GC-F and pCzn1-GC-R.E.coliBL21 Arctic Express(DE3)cells were transformed with the two recombinant plasmids separately.Isopropyl thiogalactoside(IPTG)was used to induce the expression of target protein which was subsequently purified by nickel affinity chromatography.Finally,Western blot was performed to verify the reactivity of the synthesized protein with the sera of HSV-1-positive patients.Results Both GC-F and GCR genes were synthesized by a total gene synthesis method.As sodium dodecyl sulfate polyacrylamide gel electropheresis(SDS-PAGE)showed,the fusion proteins were mainly distributed in the sediment layer.The purity of GC-F and GC-R proteins was over 80%after purification by affinity chromatography.Western blot showed that both of the proteins were reactive with anti-HSV-1 antibody-positive sera.Conclusions Fusion expression vectors have been constructed for the gC protein,and IPTG successfully induces its expression.Moreover,the resulting proteins could react with anti-HSV-1 antibody-positive sera,and may serve as an ideal experimental material for next functional study.
Eczema;Simplexvirus;Glycoprotein C
10.3760/cma.j.issn.0412-4030.2014.08.013
国家自然科学基金(81171501);江苏省自然科学基金(BK2011127)
210042南京,中国医学科学院北京协和医学院皮肤病研究所(张宇、姚煦、顾汉艳、王宝玺);南京大学医学院附属鼓楼医院皮肤科(刘军)
姚煦,Email:dryao_xu@126.com;刘军,Email:drliu_jun@126.com
2013-12-19)
(本文编辑:颜艳)
