抗幽门螺杆菌抗体阳性慢性荨麻疹患者血清对人皮肤肥大细胞释放组胺作用的研究
2014-12-18康尔恂陈宏泉闫丽萍李杰韩春玉夏秀娟
康尔恂 陈宏泉 闫丽萍 李杰 韩春玉 夏秀娟
抗幽门螺杆菌抗体阳性慢性荨麻疹患者血清对人皮肤肥大细胞释放组胺作用的研究
康尔恂 陈宏泉 闫丽萍 李杰 韩春玉 夏秀娟
目的探讨抗幽门螺杆菌(Hp)抗体与慢性荨麻疹(CU)发病的关系。方法选择13C呼吸实验阳性、抗Hp抗体阳性的CU患者为实验组,健康人为对照组。用CU患者血清孵育人皮肤肥大细胞原代细胞株(HMC),检测血清是否可刺激HMC细胞释放组胺。用抗Hp抗体(IgG)刺激HMC细胞,检测其是否具有活化细胞释放组胺的作用。检测CU患者血清中是否也含有高亲和力受体(FcεRI)抗体或抗IgE抗体。分别用抗FcεRI抗体、抗IgE抗体刺激HMC细胞,检测其活化HMC细胞释放组胺作用。结果CU患者组血清活化HMC细胞释放组胺作用(3.13±0.93)高于健康对照组(2.92±0.75,t=2.39,P<0.05),4例CU患者血清中同时存在抗FcεRI抗体、3例存在抗IgE抗体。分别用这两种抗体阳性的CU患者血清孵育HMC细胞,释放组胺量均高于健康对照组(t值分别为4.82、6.34,均P<0.01),但用只含有抗Hp抗体CU患者血清孵育HMC细胞无释放组胺作用(与健康对照组比较,t=1.74,P>0.05)。抗Hp抗体(IgG)无激活HMC细胞释放组胺作用(与阴性对照血清比较,t=1.95,P>0.05),抗FcεRI抗体、抗IgE抗体均可激活HMC细胞释放组胺(与阴性对照血清比较,t值分别为3.72、3.02,均P<0.01)。结论抗Hp抗体对CU无致病作用,血清中同时存在抗FcεRI抗体或抗IgE抗体可导致部分Hp感染者同时患有CU。
荨麻疹;幽门螺杆菌;抗体;肥大细胞
研究表明,幽门螺杆菌(Helicobacter pylori,Hp)感染与慢性荨麻疹(CU)发病有关,但发病机制仍不明确。本研究选择抗Hp抗体阳性、同时患有CU的Hp现症感染者,通过检测患者血清以及纯化的抗Hp抗体是否具有刺激体外培养人皮肤肥大细胞原代细胞株(HMC)释放组胺作用,再进一步检测患者血清中是否还存在可导致CU的抗FcεRI抗体或抗IgE抗体,探讨抗Hp抗体与CU发病的关系。
对象与方法
一、对象
青岛大学医学院附属烟台毓璜顶医院皮肤科门诊50例伴有Hp感染的CU患者为实验组,男23例,女27例,年龄(35±6)岁;50例无Hp感染,不患有CU的健康人为对照组,男21例,女29例,年龄(37±4)岁。CU患者入选标准:①皮肤风团、瘙痒每天或几乎每天发作,时起时退,病程>6周;②13C呼吸实验阳性、抗Hp抗体阳性。CU患者排除标准:荨麻疹患者被确诊为胆碱能荨麻疹、寒冷性荨麻疹、皮肤划痕症、压迫性荨麻疹、日光性荨麻疹等物理性荨麻疹或荨麻疹性血管炎。健康对照组均来自于我院体检中心的健康志愿者,入选标准:①近1年无荨麻疹和胃病史;②13C呼吸实验、抗Hp抗体均为阴性。健康对照组排除标准:①随访过程中受试者13C呼吸实验阳性或抗Hp抗体阳性;②随访过程中,受试者出现荨麻疹症状。本研究经过本院伦理委员会批准,所有受试者均签署知情同意书。
二、方法
1.使用试剂:10%小牛血清为北京索莱宝生物科技有限公司产品;HMC为青岛诺赛科贸有限公司产品;1640培养液(美国Hyclone公司);组胺检测试剂盒(上海亨代劳商贸有限公司);小鼠抗人FcεRI抗体、小鼠抗人IgE抗体检测试剂盒为美国Rapidbio公司产品;抗Hp-IgG抗体、抗FcεRI抗体、抗IgE抗体为英国Abcam公司产品。
2.血清采集:抽取受试者外周静脉血10 ml,400×g10 min分离血清,将分离的血清样本编号后置于-20℃冰箱备用。
3.肥大细胞培养:将HMC接种于含10%小牛血清的1640培养液,置于37℃、5%CO2培养箱内培养至对数生长期。
4.CU患者血清活化HMC释放组胺的检测:将105/ml的HMC细胞悬液100 μl加入96孔细胞培养板,每孔内加入CU患者血清100 μl,以健康对照血清作为对照组,每例30个孔,37℃孵育20 min,按组胺检测试剂盒操作检测组胺释放量。
5.CU患者血清中抗FcεRI抗体和抗IgE抗体检测:按小鼠抗人FcεRI抗体检测试剂盒和小鼠抗人IgE抗体检测试剂盒说明书操作,检测CU患者血清中抗FcεRI抗体、抗IgE抗体是否阳性。
6.抗Hp-IgG抗体活化HMC释放组胺检测:将105/ml HMC细胞悬液100 μl加入96孔细胞培养板,分别加入含2 mg/L抗Hp-IgG抗体的健康人血清100 μl,并设只加健康人血清的阴性对照组,每组30个孔。37℃孵育20 min,按组胺检测试剂盒操作,检测组胺释放量。
7.抗FcεRI抗体及抗IgE抗体刺激HMC细胞释放组胺检测:将105/ml的HMC细胞悬液100 μl加入96孔细胞培养板,分别加入含2 mg/L抗FcεRI抗体、2 mg/L抗IgE抗体的健康人血清100 μl、不含抗FcεRI抗体及抗IgE抗体的阴性对照血清,每组30个孔,孵育20 min后,分别按组胺检测试剂盒操作,检测培养孔内组胺释放量。
8.统计学方法:所有数据均采用SPSS17.0统计软件进行分析。使用t检验和Wilcoxon秩和检验。
结 果
一、CU患者血清刺激HMC细胞释放组胺量检测结果
CU患者组血清刺激HMC细胞释放组胺量高于健康对照组。4例(8%)CU患者血清抗FcεRI抗体阳性,3例(6%)抗IgE抗体阳性,这两种抗体阳性CU患者血清刺激HMC细胞释放组胺量高于健康对照组。43例只含抗Hp抗体CU患者血清(86%)对HMC细胞无刺激释放组胺作用。见表1。
表1 抗幽门螺杆菌抗体阳性慢性荨麻疹患者血清中各抗体刺激HMC细胞释放组胺量比较(±s)
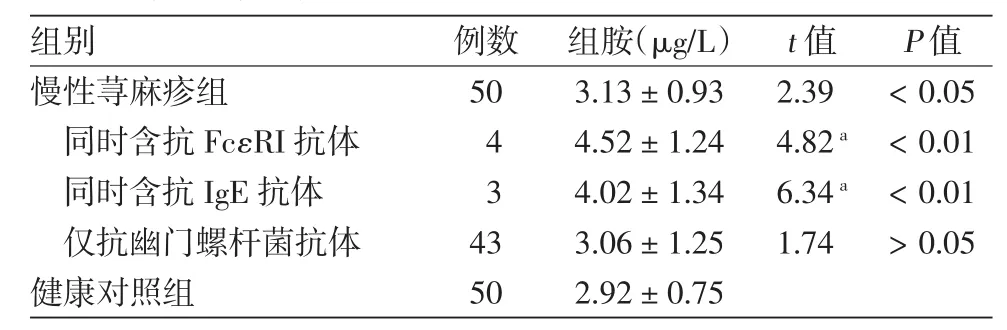
表1 抗幽门螺杆菌抗体阳性慢性荨麻疹患者血清中各抗体刺激HMC细胞释放组胺量比较(±s)
注:慢性荨麻疹患者血清刺激HMC细胞释放组胺量与对照组比较,a:秩和检验
组别 例数 组胺(μg/L) t值 P值慢性荨麻疹组 50 3.13±0.93 2.39 <0.05同时含抗FcεRI抗体 4 4.52±1.24 4.82a <0.01同时含抗IgE抗体 3 4.02±1.34 6.34a <0.01仅抗幽门螺杆菌抗体 43 3.06±1.25 1.74 >0.05健康对照组 50 2.92±0.75
二、抗Hp-IgG抗体、抗FcεRI抗体、抗IgE抗体刺激HMC细胞释放组胺量检测结果
与未加抗体的阴性对照组比较,抗Hp抗体无刺激HMC细胞释放组胺作用,抗FcεRI抗体和抗IgE抗体均可刺激HMC细胞释放组胺,释放量高于阴性对照组。见表2。
表2 抗Hp-IgG抗体、抗FcεRI抗体、抗IgE抗体刺激HMC细胞释放组胺量比较(±s)
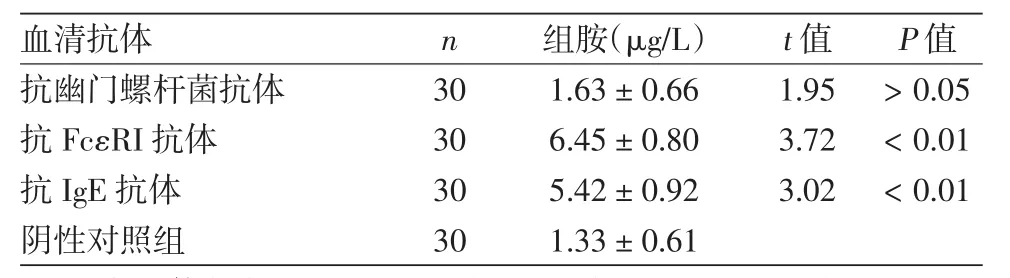
表2 抗Hp-IgG抗体、抗FcεRI抗体、抗IgE抗体刺激HMC细胞释放组胺量比较(±s)
注:各抗体刺激HMC细胞释放组胺量与阴性对照组比较
血清抗体 n 组胺(μg/L) t值 P值抗幽门螺杆菌抗体 30 1.63±0.66 1.95 >0.05抗FcεRI抗体 30 6.45±0.80 3.72 <0.01抗IgE抗体 30 5.42±0.92 3.02 <0.01阴性对照组 30 1.33±0.61
讨 论
回顾有关Hp感染与CU发病关系研究文献,许多研究者认为,Hp感染与CU相关,部分Hp感染的CU患者经抗Hp治疗后,症状可改善或完全缓解,并提出实验室检测是否存在Hp感染对于治疗CU是有指导作用[1-3]。但研究也表明,抗Hp治疗并不是对所有 Hp 感染的 CU 患者有效[4-5]。Kaplan 等[6]认为,抗Hp抗体可活化肥大细胞释放组胺,导致CU发病,但目前还没有抗Hp抗体可活化肥大细胞释放组胺的直接证据。本研究首先用患有Hp感染的CU患者血清孵育HMC细胞,发现CU患者血清具有刺激HMC细胞释放组胺的作用。进一步研究发现,50例CU患者中有4例血清抗FcεRI抗体阳性,3例抗IgE抗体阳性,这7例CU患者血清具有刺激HMC细胞释放组胺的作用。而使用仅含抗Hp抗体(IgG)孵育HMC细胞,无活化HMC细胞释放组胺作用。表明抗FcεRI抗体和抗IgE抗体具有明确的活化肥大细胞释放组胺作用,部分Hp感染的CU患者是由这两种自身抗体引起的。单纯抗Hp治疗可能对这两种自身抗体阳性的CU患者无效[7-8]。Hp感染的CU中部分归因于血清中存在针对肥大细胞自身抗体(抗FcεRI抗体或抗IgE抗体),属慢性自身免疫性荨麻疹(CAU)。因此,对于患Hp感染的CU患者,除常规抗Hp治疗外,自身血清皮肤试验(ASST)有助于对CU性质的鉴别,有利于对CU的针对性治疗[9]。
[1]Ben Mahmoud L,Ghozzi H,Hakim A,et al.Helicobacter pyloriassociated with chronic urticaria[J].J Infect Dev Ctries,2011,5(8):596-598.
[2]Campanati A,Gesuita R,Giannoni M,et al.Role of small intestinal bacterial overgrowth andHelicobacter pyloriinfection in chronic spontaneous urticaria:a prospective analysis [J].Acta Derm Venereol,2013,93(2):161-164.
[3]ShakouriA,CompalatiE,LangDM,etal.EffectivenessofHelicobacter pylorieradication in chronic urticaria:evidence-based analysis using the Grading of Recommendations Assessment,Development,and Evaluation system[J].Curr Opin Allergy Clin Immunol,2010,10(4):362-369.
[4]Akashi R,Ishiguro N,Shimizu S,Kawashima M.Clinical study of the relationship betweenHelicobacter pyloriand chronic urticaria and prurigo chronica multiformis:effectiveness of eradication therapy for Helicobacter pylori[J].J Dermatol,2011,38(8):761-766.
[5]Magen E,Mishal J.Possible benefit from treatment ofHelicobacter pyloriin antihistamine-resistant chronic urticaria [J].Clin Exp Dermatol.2013,38(1):7-12.
[6]Kaplan AP,Greaves M.Pathogenesis of chronic urticaria[J].Clin Exp Allergy,2009,39(6):777-787.
[7]孙丽伟,李杰,康尔恂,等.慢性特发性荨麻疹相关抗体与发病的关系[J].中华皮肤科杂志,2013,46(6):390-393.
[8]康尔恂,李杰,孙丽伟,等.B淋巴细胞刺激因子对慢性特发性荨麻疹患者抗FcεRI抗体和抗IgE抗体产生的影响[J].中华皮肤科杂志,2013,46(10):707-710.
[9]Fernando S,Broadfoot A.Chronic urticaria-assessment and treatment[J].Aust Fam Physician,2010,39(3):135-138.
Effect of sera from chronic urticaria patients with anti-Helicobacter pyloriantibodies on the release of histamine by human mast cells
Kang Erxun*,Chen Hongquan,Yan Liping,Li Jie,Han Chunyu,Xia Xiujuan.*Department of Dermatology,Yantai Yuhuangding Hospital Affiliated to Medical College of Qingdao University,Yantai 264000,Shandong,China
Kang Erxun,Email:kangerxun2000@163.com
Objective To investigate the relationship between anti-Helicobacter pylori(Hp)antibodies and development of chronic urticaria(CU).Methods Fifty CU patients with positive13C-urea breath test and anti-Hp antibodies,as well as 50 healthy human controls were recruited in this study.Serum samples were collected from all the subjects.The samples from the patients were subjected to tests for anti-high affinity IgE receptor(anti-FcεRI)and-IgE antibodies.Human mast cells(HMCs)were classified into several parts to be incubated with the sera of patients with CU,the sera of healthy controls with anti-IgE and-FcεRI antibodies respectively for 20 minutes.Those incubated with the sera of healthy controls without these antibodies served as the control.Subsequently,the levels of histamine released by HMCs were measured by enzyme-linked immunosorbent assay(ELISA).Results The sera of CU patients showed a stronger ability to activate HMCs to release histamine than those of healthy controls((3.13±0.93)μg/L vs(2.92 ± 0.75)μg/L,t=2.39,P< 0.05).Anti-FcεRI antibodies were detected in 4 patients,and anti-IgE antibodies in 3 patients.A significant increase was observed in the levels of histamine released by HMCs incubated with anti-FcεRI antibody-positive and anti-IgE antibody-positive patient-derived sera(t=4.82,6.34,respectively,bothP< 0.01),but not in those incubated with patient-derived sera only positive for anti-Hp antibodies(t=1.74,P> 0.05)compared with those incubated with healthy control-derived sera.In comparison with the antibody-free healthy control-derived sera,those with anti-Hp IgG antibodies showed no significant effect on the release of histamines by HMCs(t=1.95,P> 0.05),whereas those with anti-FcεRI antibodies and anti-IgE antibodies exhibited an obvious promoting effect(t=3.72,3.02,respectively,bothP< 0.01).Conclusions The anti-Hp antibodies appears to have no role in the pathogenesis of CU,but the presence of anti-FcεRI and anti-IgE antibodies may contribute to the initiation of CU in patients with Hp infection.
Urticaria;Helicobacter pylori;Antibody;Mast cells
10.3760/cma.j.issn.0412-4030.2014.08.009
山东省科技发展计划(2011GSF11819)
264000山东烟台,青岛大学医学院附属烟台毓璜顶医院皮肤科(康尔恂、闫丽萍、韩春玉、夏秀娟),检验科(李杰);青岛大学附属医院皮肤科(陈宏泉)
康尔恂,Email:kangerxun2000@163.com
2013-11-25)
(本文编辑:吴晓初)
