转谷氨酰胺酶对Cheddar干酪力学性质的影响*
2014-12-16刘贺李君庚平朱丹实慧丽娟王勃何余堂马涛
刘贺,李君,庚平,朱丹实,慧丽娟,王勃,何余堂,马涛
(渤海大学化学化工与食品安全学院,食品科学研究院,辽宁省食品安全重点实验室,食品贮藏加工及质量安全控制工程技术研究中心,辽宁锦州,121013)
干酪是世界上消费最大的农产品之一,2012年就超过2 000万t,全球市场预计超过了600亿美元[1]。在传统的Cheddar干酪生产过程中,酪蛋白凝乳的结构形式会使乳清蛋白流失,乳清蛋白是众所周知的具有高营养价值和多功能性的食品。乳清蛋白的营养和功能特性与其结构和生物功能相关[2]。主要的乳清蛋白有β-乳球蛋白和α-乳白蛋白,分别占乳清蛋白总量的50%和20%,其余部分主要由免疫球蛋白、牛血清白蛋白、蛋白胨和一些小蛋白分子构成[3]。乳清蛋白集合到干酪中不仅可以提高营养价值和产量,同时也改变了奶酪的功能性质。
转谷氨酰胺酶(TGase)是食品和药物管理局(FDA,2010)公认的安全可食用的添加剂[4]。它可以催化转酰基反应,从而导致蛋白质(或多肽)之间发生共价交联;它还可以使蛋白质改性,以使蛋白质的塑性、持水性、水溶性和功能性得到改善;还可以保护食品中的赖氨酸免受各种化学反应的破坏等。凝乳是干酪制作的重要环节,显著影响干酪的理化性质,任何使酪蛋白胶束、脂肪分子、水分子、矿物质等发生变化的工艺过程都有可能造成干酪流变学特性与质地的变化[5]。然而凝乳是一个动态的过程,只有连续监测才能准确揭示其胶体结构和状态的动态变化。
本实验将TGase与凝乳酶同时作用牛乳,通过微流变仪观察和分析牛乳凝乳形成过程中真实的内在变化。本研究还跟踪干酪发酵周期,以测定不同含量TGase对Cheddar干酪发酵过程中质构特性的影响,以及通过低场核磁检测发酵过程中水分的分布情况。同时采用流变仪研究添加TGase对成熟后的Cheddar干酪流变特性的影响规律。从凝胶结构和力学特性来探讨TGase对干酪凝乳形成及对干酪品质的影响机制。
1 材料与方法
1.1 材料与试剂
鲜奶来自光明牧场;凝乳酶FROMASE 750 XLG,荷兰帝斯曼公司;直投式干酪发酵剂CHOOZIT RA21 LYO 50 DCU,丹麦丹尼斯克公司;转谷氨酰胺酶(TGase),丹麦丹尼斯克公司。
1.2 仪器与设备
质构仪TA-XT plus,英国SMS;核磁共振成像仪NMI20,中国纽迈电子科技有限公司;流变仪DHR-1,美国TA仪器公司;微流变仪Rheolaser Lab,法国Formulaction公司。
1.3 切达干酪制备
将鲜牛乳于72℃巴氏杀菌后使用,向冷却的牛乳中加入发酵剂0.004 g/L,搅拌均匀,水浴静置在32℃。当pH降到6.4~6.5时加入凝乳酶3 000 u/mL,凝乳30~35 min。对照组同时分别添加15 u/L(TG1)、30 u/L(TG2)转谷氨酰胺酶。切割后用搅拌刀将凝乳块推开,每2~3 min升温1℃,缓慢升高到41℃。恒温搅拌,直至乳清pH降到5.6~5.7。用60目的滤布分离乳清和凝乳,将凝乳粒堆叠在干酪槽的中部,每隔10 min翻动1次,进一步排除乳清,直至乳清pH值达到5.2~5.3为止。将堆砌的干酪切成3 cm大小立方体,添加2%NaCl,混合均匀。入模压榨12 h后将干酪从模具中取出,真空包装,并于4℃保藏。
1.4 凝乳过程微流变测定
牛乳发酵pH降到5.4~5.5时,添加凝乳酶和TGase,将样品倒入样品池中。样品体积20 mL,温度32℃,分析时长15 h。取样时要尽量避免过大的剪切力,通过Rheolaser直接分析。
1.5 质构测定
分别取1~6个月的干酪样品,室温下放置30 min。TPA测定参数:每组干酪切割为规则正方体(1.5 cm×1.5 cm×1.5 cm);测量前探头下降速率 1 mm/s;测试速率 5 mm/s;测试后探头回程速率 5 mm/s;下压高度为样品高度的35%;触发力5 g;探头类型P100。剪切力测定参数:测量前探头下降速率0.5 mm/s;测试速率0.5 mm/s;测试后探头回程速率10 mm/s;下降距离为25 mm;触发力50 g;探头类型A/BC。每组样品测定3次。
1.6 NMR自旋-自旋弛豫时间测定
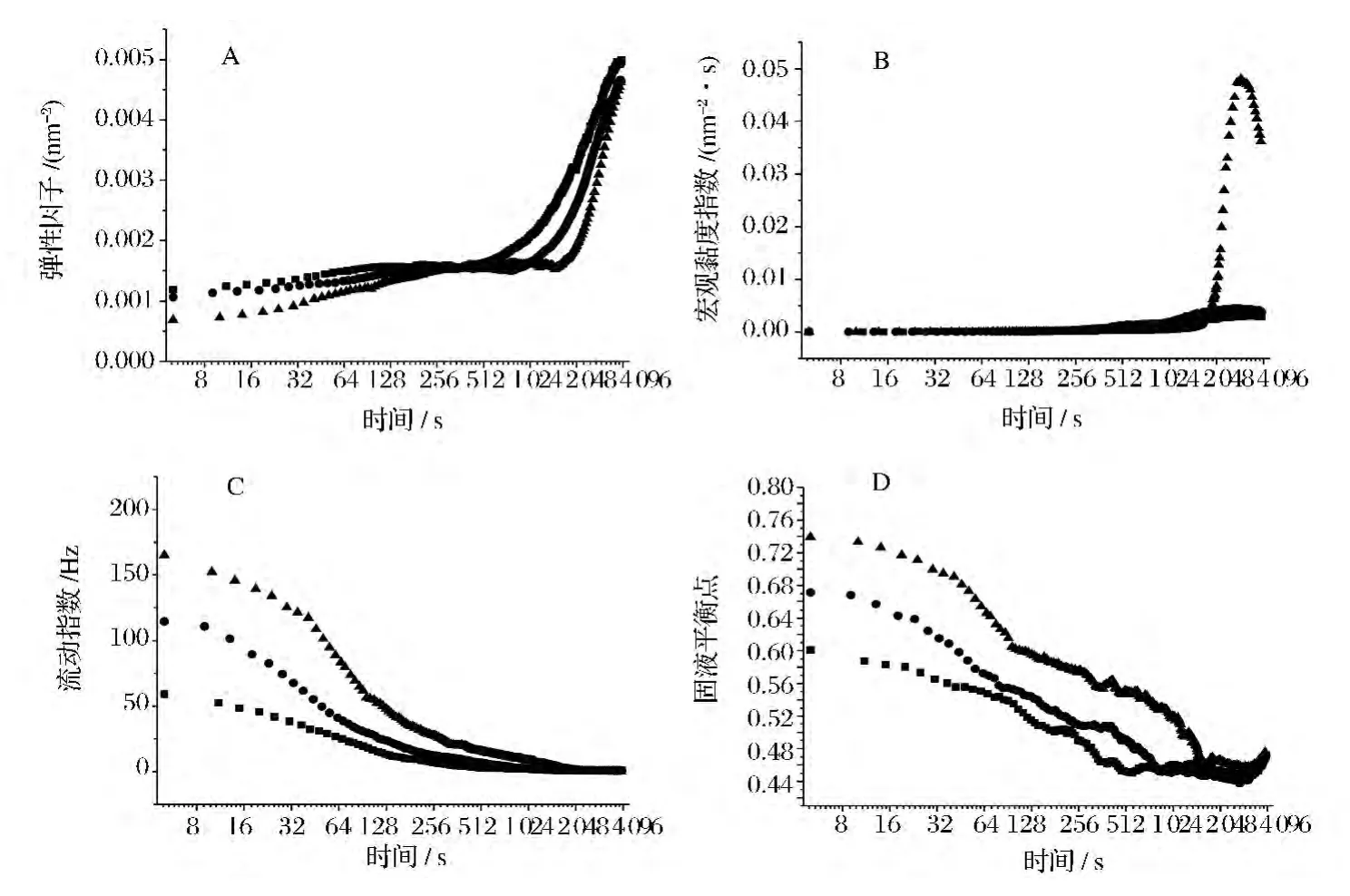
图1 TGase对牛奶凝乳过程微流变的影响Fig.1 Effect of TGase on micro rheological process of milk curd
干酪样品在4℃温度下保存,分别在贮存的第1、2、4、6月测定样品的自旋 -自旋弛豫时间 T2(ms)。每组奶酪切割为规则长方体(0.5 cm×0.5 cm×1.5 cm),装于15 mm 外径的试管底部,置于磁场中心位置的射频线圈的中心。参数设定:重复时间TR=1 500 ms;半回波时间τ=300 μs;累加次数NS=8;回波个数EchoCnt=4 000。CMPG指数衰减曲线用仪器自带的MultiExp Inv Analysis软件进行反演,得到T2值。
1.7 干酪成熟末期流变测定
取一定量干酪放在85℃样品池中融化,选用直径40 mm的不锈钢平行板系统,板间距为1 500 μm。变温振荡扫描:剪应变0.5%,频率1.0 Hz,降温速率为2.5℃/min,降温范围由85℃至20℃,每10 s仪器会自动采集1次数据。频率振荡扫描:剪应变0.5%,温度20 ℃,频率取0.1~10 Hz。
2 结果与讨论
2.1 凝乳过程微流变测定
通过Rheolase可以观察到样品黏弹性、流动性随时间的变化,明晰TGase在凝乳过程的作用(图1)。
图1(A)显示了弹性因子(EI)随凝乳时间的变化。初始阶段,在凝乳酶的作用下,3组干酪的弹性因子均缓慢上升,对照组的EI值大于TG1、TG2。凝乳10 min后,对照组EI值显著上升,首先达到最高的强度。添加TGase含量越高EI值越小,说明TGase在凝乳过程中减弱了凝乳的强度。图1(B)表明不同样品的宏观黏度指数(MI)随凝乳时间的变化。凝乳30 min之内,MI值缓慢增加,TGase含量对样品粘性没有影响,此时酪蛋白在凝乳酶作用下形成凝胶,这种凝胶体系是靠很弱的非共价键,主要是氢键来维持。30 min之后,TG2 MI值显著高于TG1及对照组,表明此时TGase在乳蛋白的分子内或分子间形成ε-(γ-谷氨酰)赖氨酸键结合了乳清蛋白分子,使通常条件下不能形成凝胶的乳蛋白形成凝胶,引入了新的共价键,使凝胶特性发生很大改变。图1(C)表示流动指数(FI)随时间的变化,凝乳30 min内属于凝胶结构恢复阶段,样品FI随时间变化不断的减小,表明样品结构在不断地恢复,待稳定之后即为样品本身的弹性。对照组流动指数最小,说明TGase含量会提升凝乳的流动性,TGase含量越高越不利于凝胶结构恢复。随凝乳时间延长,对照组及TG1达到平衡,结构趋于稳定,TG2 FI值迅速下降达到最小值,说明此时TGase交联乳清蛋白分子具有更致密的网络结构和较小的蛋白颗粒胶束,并且胶团间空隙较小,导致较低的脱水收缩作用,结构更稳定。图1(D)表明了凝固时间,对照组5 min后达到固液平衡点(SLB)0.5,形成凝胶,TGase含量越高形成凝胶的时间越长。随着时间延长,SLB值越来越小,表明凝胶结构更稳定。
2.2 不同储存期干酪质构的变化
干酪的质构特征是表征干酪成熟变化的重要指标,它与干酪的组成、成熟度、结构以及分子间的作用力等有关[6]。表1中列出了储存1~6个月、不同TGase含量的干酪TPA检验的质构参数。从TPA质构曲线中可以得到与人的感官评价相关的质构特性参数。3组干酪在成熟1~3个月期间其硬度、黏着性、咀嚼性和剪切力均升高,在成熟3个月时达到最大值,成熟后期(4~6月)程下降趋势。这是由于干酪成熟前期水分的流失和微生物的新陈代谢作用,使含水量不断下降,导致干酪质地变硬,而随着干酪成熟的进行,Cheddar中的蛋白质和脂肪被微生物和酶不断降解,如 αs1-酪蛋白、β-酪蛋白和 κ-酪蛋白缓慢发生降解[7],整体干酪体系变得松散,硬度、黏着性、咀嚼性随着下降。添加TGase显著提升了干酪的硬度、剪切力(P<0.05),图2的 NMR分析表明,添加TGase降低了游离水峰面积的比例,说明TG1、TG2含有较少的水分含量,导致干酪硬度增加。另一方面是因为κ-酪蛋白分子位于酪蛋白胶束的表面,其中有4个谷氨酸残基能够作为TGase潜在的交联位点,从而使 κ-酪蛋白能够被 TGase交联[8],形成新的共价键,减少了酪蛋白网络结构的分解,提升了干酪的硬度和剪切力等。TGase对干酪的弹性影响不显著。由于硬度增加,直接导黏着性和咀嚼性显著增加(P<0.05),而添加30 u/L TGase黏着性小于添加15 u/L TGase,可能是因为TGase含量过高阻碍了蛋白质降解为肽链和氨基酸,而这些蛋白质的降解物亲水基团较多,对干酪的黏着性起到贡献作用。添加TGase后,酪蛋白和脂肪分解成小分子物质过程中酪蛋白的网络结构受到破坏较轻,所以在咀嚼性上没有对照组口感细腻。
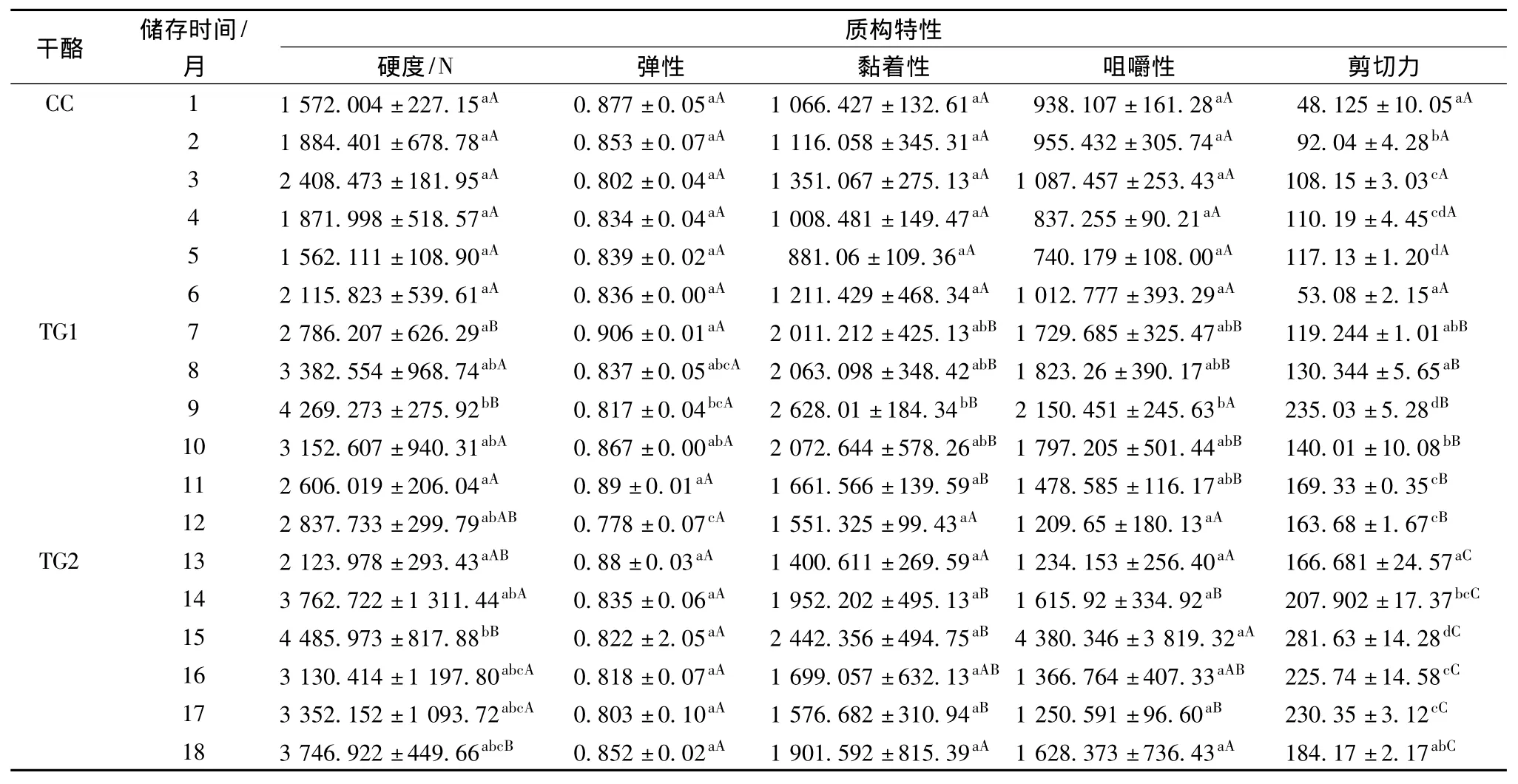
表1 TGase对Cheddar干酪在成熟过程中质构的影响Table 1 Effect of TGase on texture of Cheddar cheese during ripening
2.3 干酪成熟过程水分分布的变化

图2 TGase对Cheddar干酪在成熟过程中水分分布的影响Table 2 Effect of TGase on moisture distribution of Cheddar cheese during ripening
CPMG脉冲序列检测到干酪中两部分水分的弛豫性质,指数衰减曲线拟合得到2个峰,即T21、T22如图2所示。图2为不同成熟期Cheddar干酪水分分布随贮藏时间的变化情况。自旋-自旋弛豫时间越长表示这部分水分的流动性越强,T21的弛豫时间变化范围在8~87 ms,代表与干酪中的蛋白质结合紧密的结合水;T22弛豫时间变化范围为57~201 ms,代表与干酪中的蛋白质结合松散的自由水。结合水部分所占的峰比例较高,占总峰比例的83.6%~94.8%,是干酪中存在的第一大类水分,其变化也影响着干酪的品质与结构。随着贮藏时间的增加,蛋白质和脂肪发生水解,T21弛豫时间延长,峰面积比例变大,说明结合水的比例变大且流动性增强。成熟过程中TG2弛豫时间小于 TG1,整体小于对照组,这是因为TGase含量高的样品的氢质子和大分子(主要是蛋白质)结合更紧密,而蛋白质的聚集会降低氢质子的弛豫时间,是因为偶极子之间的相互作用变弱,所以生物大分子阻碍了水分子的移动[9]。T22对应干酪中的自由水,TGase对自由水的影响较显著,可以明显看出峰的移动规律。对照组干酪自由水弛豫时间最长,游离出来的水束缚能力薄弱,添加TGase后峰向左移动,改善了游离水的自由度。峰面积的比例有减小的趋势,说明这部分水的流动性变差,对照组变化较明显。
2.4 TGase添加量对干酪流变性的影响
干酪具有黏弹性,体现在既具有固体的弹性,又具有液体的黏性,干酪的质地受流变学特性影响很大[10]。G'称为动力学剪切的弹性模量,是每次剪切变形中可恢复的能量,代表物质的弹性部分。由图3可以看出,不同TGase含量干酪的弹性模量变化趋势相似,在20~85℃下随着温度的升高迅速下降,温度升高,脂肪流动性增强,干酪的流变特性趋于黏性而非坚硬性。当温度升高到60℃时,弹性模量下降平缓。随着TGase浓度的增大,弹性模量升高,在升温过程中,对照组变化幅度最小,最先达到平稳,这可能是由于TGase交联更多的乳清蛋白大分子,导致干酪蛋白与脂肪的比例发生变化,而脂肪含量在干酪的熔化中占有非常重要的作用,它可以降低酪蛋白网络密集,所以对照组更快的发生延伸和熔化。G"称为动力学剪切的损耗模量,是每次剪切变形中消耗掉的能量,代表物质的黏性部分。其变化趋势同弹性模量相似,但变化值低于弹性模量。
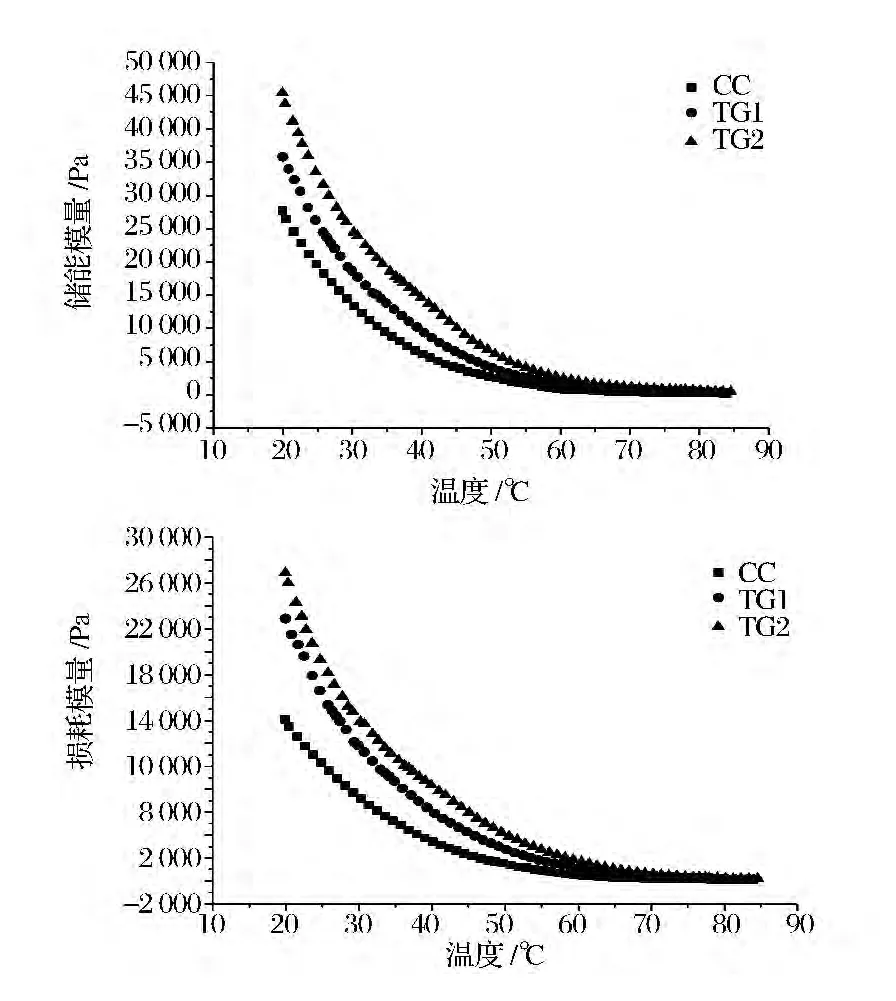
图3 升温过程中TGase对Cheddar干酪模量的影响Fig.3 Effect of TGase on modulus of Cheddar cheese during heating
由图4可以看出,干酪的弹性模量和损耗模量随频率的增大而增大,而TGase含量越高,干酪的弹性模量及损耗模量越高,说明该产品的弹性部分和黏性部分都增加了。这种现象早有学者McMaho等表明,干酪生产中必须满足酪蛋白与脂肪之比等于某个常数(此常数为0.95)。当酪蛋白与脂肪比值降低时,所制作的干酪弹性模量降低,干酪变得发软而缺乏弹性,甚至在表面析出油滴;当酪蛋白与脂肪比值增加时,则会引起干酪发黏、发硬而使质构发生改变[11-12]。
3 结论
由于发酵过程中凝乳酶、微生物蛋白酶以及TGase等协同发挥作用,TGase能够促进分子间的或分子内的交联与聚合,形成新的共价键,所以对干酪的力学性质及水分分布影响较大。随TGase含量增加干酪硬度、咀嚼性及剪切力显著增加,而黏着性降低,弹性则不受TGase处理的影响。成熟后末期,由于蛋白质水解程度的增加,整体干酪体系变得松散,硬度、黏着性、咀嚼性随着下降。TGase对自由水的影响显著,发酵过程中TG2弛豫时间小于TG1,整体小于对照组,添加TGase后峰向左移动,改善了游离水的自由度。在凝乳阶段,添加TGase会降低凝乳的弹性因子,随凝乳时间延长,黏性显著升高,TGase对流动性的影响越明显,流动性显著降低。TG1、TG2由于交联更多的乳清蛋白大分子,脂肪比例降低,低温时TG1和TG2模量较高,当高温时,均开始出现了一个较平缓的幅度。频率扫描中,干酪的黏弹性随频率的增加而增加,TGase含量越高,干酪的模量越高。
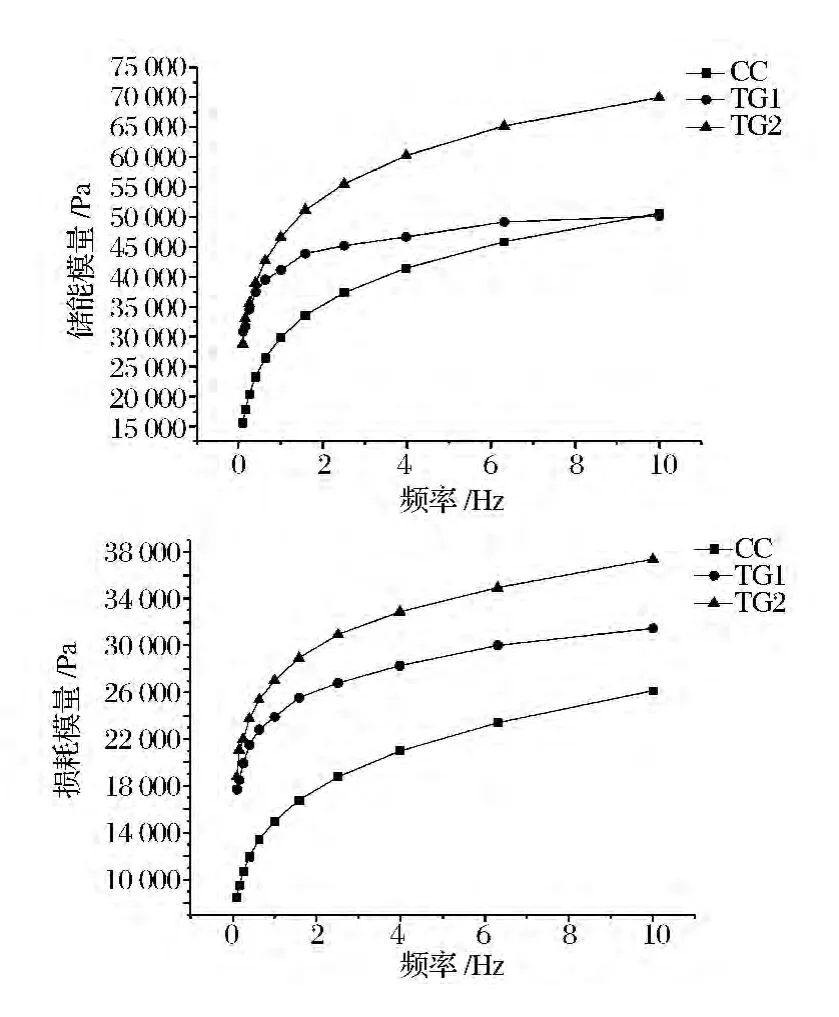
图4 频率扫描震荡TGase对Cheddar干酪模量的影响Fig.4 Effect of TGase on modulus of Cheddar cheese during oscillation frequency sweep
[1]Barbaros Özer,A Adnan Hayaloglu,Hüyla Yaman,et al.Simultaneous use of transglutaminase and rennet in whitebrined cheese production[J].International Dairy Journal,2013,33(2):129-134.
[2]JN De Wit.Nutritional and functional characteristics of whey proteins in food products[J].Journal of Dairy Science,1998,81(3):597-608.
[3]Ana R Madureira,Cláudia I Pereira,Ana MP Gomes,et al.Bovine whey proteins-overview on their main biological properties[J].Food Research International,2007,40(10):1 197-1 211.
[4]Priscilla Nuernberg Rossa,Vívian Maria Burin ,Marilde T Bordignon-Luiz.Effect of microbial transglutaminase on functional and rheological properties of ice cream with different fat contents[J].LWT-Food Science and Technology,2012,48(2):224-230.
[5]刘晶,韩清波,张耀广.干酪质地及流变学特性的研究进展[J].食品研究与开发,2006,27(10):170-172.
[6]Malcolm Bourne.Food texture and viscosity:concept and measurement[M].San Diego:Academic Press,2002:229-427.
[7]Daniela D Voigt,François Chevalier,John A Donaghy,et al.Effect of high-pressure treatment of milk for cheese manufacture on proteolysis,lipolysis,texture and functionality of Cheddar cheese during ripening[J].Innovative Food Science & Emerging Technologies,2012,13(1):23-30.
[8]Ranjan Sharma,Peter Chr Lorenzen ,Karsten B Qvist.Influence of transglutaminase treatment of skim milk on the formation of ε-cγ-glutamyl)lysine and the susceptibility of individual proteins towards crosslinking[J].International Dairy Journal,2001,11(10):785-793.
[9]BP Hills,SF Takacs ,PS Belton.The effects of proteins on the proton NMR transverse relaxation times of water:I.N-ative bovine serum albumin[J].Molecular Physics,1989,67(4):903-918.
[10]MH Tunick.Rheology of dairy foods that gel,stretch,and fracture[J].Journal of Dairy Science,2000,83(8):1 892-1 898.
[11]Hannemieke Luyten.The rheological and fracture properties of Gouda cheese[M].Wageningen:Luyten,1988:138-223.
[12]Robert L Fife,Donald J McMahon ,Craig J Oberg.Functionality of low fat Mozzarella cheese[J].Journal of Dairy Science,1996,79(11):1 903-1 910.
