溶剂体系下Lipozyme RM IM催化卵磷脂乙醇解及其他醇对乙醇解的影响*
2014-12-16马娇娜杨国龙杨若茜毕艳兰孙尚德
马娇娜,杨国龙,杨若茜,毕艳兰,孙尚德
(河南工业大学 粮油食品学院,河南 郑 州,450001)
溶血磷脂与天然磷脂相比不仅保留了磷脂的亲水和亲油基团,还能减少非极性基团而明显增加其亲水性能、改善了磷脂因HLB值偏低而导致的应用范围受限的情况,更适合用作O/W型乳化剂,已经广泛应用于食品、医药、化妆品、饲料加工等领域[1-3]。
脂肪酶催化大豆卵磷脂改性制备溶血卵磷脂的方法包括水解法和醇解法。其中,脂肪酶水解卵磷脂会产生过多的脂肪酸,且不利于酶和产品的回收。国内对脂肪酶醇解的应用一般集中于油脂醇解制备生物柴油,而对催化磷脂醇解方面的报道较少,因此有必要对其做深入研究。另有报道表明,脂肪酶在不同醇中的反应活性不同,且不同醇的组合会对酯交换反应产生不同作用[4]。因此,本研究选用脂肪酶(Lipozyme RM IM)催化卵磷脂乙醇解,并研究其他醇对卵磷脂乙醇解反应的影响。
1 材料与方法
1.1 主要材料与仪器
大豆卵磷脂(PC),沈阳天峰生物工程技术有限公司;Lipozyme RM IM,诺维信公司赠送;十七酸甲酯标准样品,购自Sigma公司;三氯甲烷、甲醇及甲酯化用正己烷,色谱纯;溶剂用正己烷、无水乙醇、正丁醇、叔丁醇、1,2-丙二醇、丙三醇等试剂均为分析纯,使用前经分子筛脱水处理。
MK-6S棒状薄层色谱分析仪,日本三菱公司;Agilent 6890N型气相色谱仪,美国 Agilent公司;BSA224S电子天平,赛多利斯科学仪器有限公司(Max 220 g,d=0.1 mg);DF-101Z 集热式恒温加热磁力搅拌器,巩义市京华仪器有限责任公司。
1.2 实验方法
1.2.1 卵磷脂的脂肪酸组成分析
卵磷脂的甲酯化方法采用三氟化硼甲酯化法[5]。气相色谱检测条件为:Agilent 6890N型气相色谱仪;氢火焰离子化检测器(FID);毛细管柱,BPX-70(30.0 m × 250 μm × 0.25 μm,澳大利亚 SGE 公司);进样口温度,210℃;柱温,180℃;检测器温度,300℃。
卵磷脂的相对分子质量计算公式:
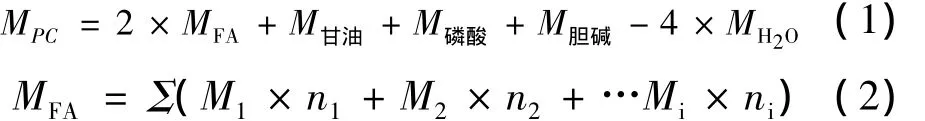
式中:MPC,卵磷脂的分子质量;MFA,脂肪酸的平均分子质量;M甘油,甘油的分子质量;M磷酸,磷酸的分子质量;M胆碱,胆碱的分子质量;MH2O,水的分子质量;Mi,脂肪酸的分子质量;ni,脂肪酸的摩尔百分含量。
1.2.2 Lipozyme RM IM催化卵磷脂醇解制备溶血卵磷脂
称取一定量卵磷脂溶于正己烷中,根据卵磷脂与醇中羟基的摩尔比加入一定量乙醇,再向体系中加入微量水,恒温下搅拌20 min后,加入适量脂肪酶,醇解反应开始,定时取样进行检测分析。考察反应温度、加酶量(以 PC质量计)、溶剂比(PC∶正己烷,g∶mL)、底物比(PC∶醇中羟基,mol∶mol)、加水量(PC∶水,g∶uL)对LPC转化率的影响,确定PC乙醇解的适宜条件,进一步研究X醇(正丁醇、叔丁醇、1,2-丙二醇和丙三醇)对乙醇解的影响。
1.2.3 原料卵磷脂及其醇解产物的组成分析
采用棒状薄层色谱/氢火焰离子化检测器(TLC/FID)分析原料卵磷脂及其醇解产物中卵磷脂(PC)、溶血卵磷脂(LPC)、甘油磷脂酰胆碱(GPC)及其他物质的相对含量。将卵磷脂及其醇解产物溶解于三氯甲烷中,配制成浓度为10~20 mg/mL的溶液,取1 μL溶液点于薄层色谱棒上,在溶剂体系下展开后在90℃红外烘箱中干燥5 min,然后进行检测分析。展开液:V(CHCl3)∶V(CH3OH)∶V(H2O)=42∶22∶2.5。检测条件:氢气流速,100 mL/min;空气流速,1.5 L/min;扫描速度,30 s/棒。
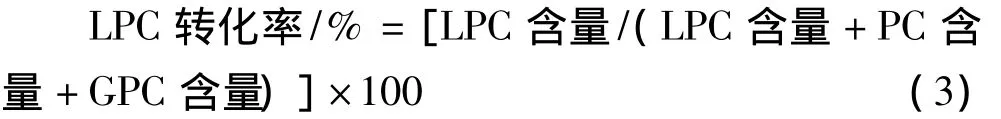
2 结果与讨论
2.1 原料大豆卵磷脂
利用TLC/FID对大豆卵磷脂PC含量进行检测,结果如图1所示。图1中卵磷脂峰面积明显大于其他物质的峰面积,原料中PC含量为97.2%,纯度较高,符合实验要求。

图1 大豆卵磷脂TLC/FID图谱Fig.1 TLC/FID chromatograph of soy phosphatidylcholine
大豆卵磷脂经三氟化硼甲酯化后,其脂肪酸组成利用气相色谱进行检测,结果见表1。由公式1和公式2计算可知,大豆卵磷脂中脂肪酸的平均分子量为277.5,卵磷脂分子量为 794.0。

表1 大豆卵磷脂主要脂肪酸组成Table 1 Major fatty acid composition of soy phosphatidylcholine
2.2 溶剂体系中Lipozyme RM IM催化卵磷脂乙醇解
以有机溶剂为介质进行酶催化反应具有如下优点:提高脂溶性底物的溶解度;易于酶的回收和再利用;易于产物的分离纯化;酶在有机溶剂中的热稳定性比水中高[6]。有机溶剂中酶的稳定性增强是因为非水体系中没有充足的导致某些酶失活的水分子[7]。极性强的有机溶剂可能因夺取酶维持其构象的必需水而对酶的催化活力不利[8]。本实验选择非极性的正己烷作为溶剂,研究该体系下醇的相互作用对Lipozyme RM IM催化卵磷脂乙醇解的影响。
2.2.1 温度对乙醇解反应的影响
温度是影响酶催化活性和反应速率的重要因素(如图2所示)。

图2 温度对反应过程中LPC转化率的影响Fig.2 Effect of temperature on LPC conversion during reaction
当反应温度为40℃时,醇解反应速率明显高于30℃,LPC转化率达到平衡时所用时间较短,反应16 h后LPC转化率即可达93%。这是由于反应温度较低时,酶活力较低,随着反应温度的升高,酶活力逐渐增强直到最佳催化活力,同时反应体系粘度降低,传质阻力减小,促进了醇解反应的进行。但过高的反应温度则会使酶变性失活。此结果与Demirkol等[9]及Elizabeth[10]研究一致,Lipozyme RM IM 等脂肪酶在30~50℃活性较高。本反应中温度为50℃时,随着反应体系扩散系数的提高,初期反应速率较高,但反应10 h后LPC转化率骤降。结合图3可知,温度过高不仅会影响酶的催化活性,还会导致副产物的生成。随着反应的进行,LPC发生醇解反应,GPC含量急剧升高,最终导致LPC转化率的显著降低。从增大产物得率和缩短反应时间考虑,以40℃为最佳反应温度。王渝鹭等[11]研究了无溶剂体系中Lipozyme RM IM催化卵磷脂制备溶血卵磷脂,确定了乙醇解的最适温度为30℃,溶剂体系下最适温度40℃与其相比有所升高,这是因为酶在有机溶剂中的热稳定性增强,且无溶剂体系中短碳链醇对酶的毒害作用较大[12]。

图3 温度对反应过程中GPC含量的影响Fig.3 Effect of temperature on GPC content during reaction
2.2.2 加水量对乙醇解反应的影响
有机溶剂中,微量水是维持酶活性所必需的因素[13]。图4 为加水量(PC:水,g∶μL)对 PC 乙醇解的影响。
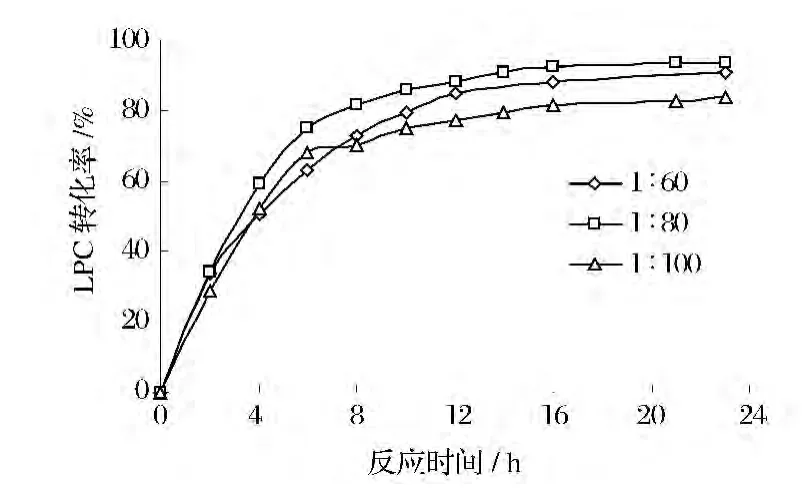
图4 加水量对反应过程中LPC转化率的影响Fig.4 Effect of water amount on LPC conversion during reaction
加水量为1∶80 g∶μL时,醇解反应速率和 LPC转化率都高于1∶60 g∶μL,说明加水量过低时,酶无法有效发挥其催化活力。由于水分影响酶蛋白的结构完整性、活性位点的极性与稳定性,加入适量水可维持酶的三维构象结构使其处于最佳催化活性状态[14]。但过量的水则会抑制酶的活性,甚至促进副反应的发生[15]。当加水量为 1∶100(g∶μL)时,反应速率和产品最终得率都明显低于其他2个考察水平,是因为水分添加量过大,水分子在酶活性位点之间形成水束,产生的介电屏蔽作用掩盖了活性位点的极性,进而降低了酶的催化活性[14]。Selmi等[16]发现当酶中含水量足够多时,加水后效果反而不好。
2.2.3 加酶量对乙醇解反应的影响
如图5所示,加酶量为10%时,反应24 h尚未达到平衡且LPC转化率仅为82%,而加酶量为15%和20%时,反应皆于16 h达到平衡,LPC转化率分别为92%、95%。酶促反应主要是酶的活性基团与底物作用的结果,随着加酶量的增加,活性基团增加,酶与底物的接触机率增大,从而使得反应速率得到提高。Bernardes等[17]研究Lipozyme RM IM催化大豆油醇解制生物柴油时发现当加酶量为20%时酯产量明显高于7%时的产量。本实验也证实了Oliveira等[18]的报道,加酶对酯生产有积极作用。使用较多加酶量有助于避免酯交换量过低,因酶随时间的延长而逐渐失活[19]。加酶量继续增加,在一定面积的反应界面上,酶浓度最终达到饱和,反应趋于平衡[20]。加酶量15%和20%对催化醇解反应的结果差别不大,从节约成本方面考虑,选择15%为最适加酶量。

图5 加酶量对反应过程中LPC转化率的影响Fig.5 Effect of enzyme load on LPC conversion during reaction
2.2.4 底物比对乙醇解反应的影响
底物比影响醇解反应速率并决定反应的平衡点。当底物比为1∶2(mol∶mol)时,反应速率和LPC转化率较1∶3(mol∶mol)时都明显低(图 6),这是由于较低底物比条件下乙醇的浓度较低,与卵磷脂碰撞机率小,底物结合少导致反应速率低。随着底物比的增大,卵磷脂与乙醇的结合机率增大,促进醇解反应的进行。当底物比为1∶4(mol∶mol)时,反应达到平衡的时间及产品得率较1∶3(mol∶mol)时无明显差异,主要原因是底物摩尔比为1∶3(mol∶mol)时,底物达到饱和,酶分子都能有效的与底物相结合,进一步增加底物比也很难提高产品中LPC的含量。另外,Ber-nardes等[17]研究大豆油醇解制生物柴油时发现,当醇/油摩尔比为10∶1时乙酯产量明显比摩尔比为6∶1低,因为蛋白质在含有短碳链醇(如甲醇、乙醇)的反应体系中不稳定,溶剂体系下过量乙醇会促进脂肪酶的抑制或失活。Hass等[21]研究脂肪酶催化大豆甘三脂和卵磷脂醇解合成脂肪酸乙酯时发现,对于两种底物,酶活通常随乙醇浓度的增加而降低。Oliveira等[22]也报道了过量乙醇对酶促反应有抑制作用。
从缩短反应时间和提高产品得率方面考虑,结合成本因素,1∶3(PC:醇中羟基,mol∶mol)为最适底物比。
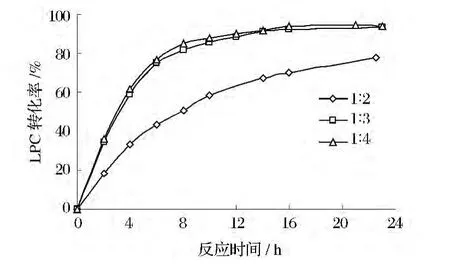
图6 底物比对反应过程中LPC转化率的影响Fig.6 Effect of substrate ratio on LPC conversion during reaction
2.2.5 溶剂比对乙醇解反应的影响
溶剂比过低时,底物浓度较高,体系黏稠传质阻力增大,酶催化反应受到底物抑制作用;溶剂比过高时,会降低底物与酶的碰撞机率,从而影响反应速率。实验发现溶剂比对LPC转化率的影响并不显著,反应趋势基本一致(图7)。

图7 溶剂比对反应过程中LPC转化率的影响Fig.7 Effect of solvent ratio on LPC conversion during reaction
从节约生产成本考虑,溶剂比越低越好,但溶剂比过低会使溶液粘度过大,体系不会很好的混合,且妨碍取样的准确性[21]。综上,选择1∶2(PC∶正己烷,g∶mL)为最适溶剂比。与王渝鹭等[11]的研究结果相比,醇解反应达到平衡所用的时间减少了一半,反应速率大大提高,这与 Hass等[21]和 Shaw 等[23]报道一致,无溶剂体系中醇解反应速率较正己烷中进行较快。
2.3 其他醇对卵磷脂乙醇解的影响
通过单因素实验,确定了有机溶剂体系下脂肪酶Lipozyme RM IM催化大豆卵磷脂乙醇解制备溶血卵磷脂的适宜条件:温度40℃,加酶量15%(以PC质量计),溶剂比 1∶2(PC∶正己烷,g∶mL),底物比 1∶3(PC∶醇中羟基,mol∶mol),加水量 1∶80(PC∶水,g∶μL)。
在此基础上,考察其他醇对卵磷脂乙醇解的影响。从醇的碳链长度、醇的级别出发,综合考虑经济因素,选择X醇为正丁醇、叔丁醇、1,2-丙二醇和丙三醇。乙醇与X醇的比例为X醇羟基占醇溶液总羟基摩尔数的百分比。
2.3.1 正丁醇对PC乙醇解反应的影响
向乙醇溶液中添加羟基摩尔比为10%、20%和30%的正丁醇,发现其反应速率和LPC转化率随反应时间的变化与乙醇解基本一致(图8),正丁醇对卵磷脂乙醇解无明显作用。
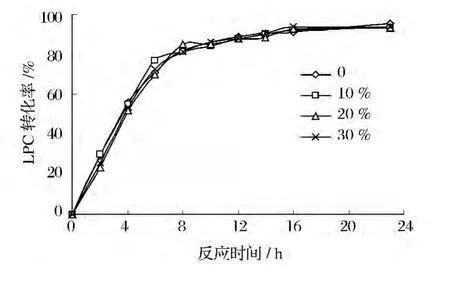
图8 乙醇与正丁醇相互作用对LPC转化率的影响Fig.8 Effect of interaction of ethanol and n-butanol on the PLC conversion
Rodrigues等[24]研究了无溶剂体系下几种脂肪酶催化油脂在短碳链醇中的酯交换反应,发现Lipozyme RM IM在低分子质量醇(甲醇、乙醇)中易失活,而在正丁醇中转化率较高。本实验结果与其不一致可能是由于底物组成及底物比不同,且乙醇和正丁醇在溶剂体系下被稀释以致各自对酶的影响被削弱,同时正丁醇的空间结构与乙醇相近,虽然碳链长度较乙醇略有增长,但在最适乙醇解条件下其分子动能与传质能力并未受到影响。正丁醇对卵磷脂的乙醇解未表现出明显的促进或抑制作用。
2.3.2 叔丁醇对PC乙醇解反应的影响
近年来,在酶促油脂酯交换制备生物柴油的研究中,叔丁醇的使用备受重视。甲醇等短碳链醇与油脂的溶解性不好且易使酶失活,加之醇解反应产物甘油对酶有毒害作用,使得酯交换率较低[25]。叔丁醇因其对甲醇和甘油等溶解性较好,有助于酶的激活并使固定化脂肪酶稳定性增强,而广泛用作酶促酯交换反应介质[26-27]。本实验向乙醇溶液中添加不同羟基摩尔比的叔丁醇,发现其反应速率和LPC转化率随反应时间的变化与乙醇解基本一致,叔丁醇对卵磷脂乙醇解未表现出显著地促进或抑制作用(图9)。

图9 乙醇与叔丁醇相互作用对LPC转化率的影响Fig.9 Effect of interaction of ethanol and t-butanol on the PLC conversion
卵磷脂醇解不同于甘三脂醇解中叔丁醇所表现出的积极作用,可能是因为底物的不同,卵磷脂比甘三脂极性大,对醇的溶解性好,且反应过程中甘油产生量很小。另外,叔丁醇与乙醇相比,支链结构使其分子中羟基受到的空间位阻较大,因此可能导致底物碰撞机率的减少。
2.3.3 1,2-丙二醇对 PC 乙醇解反应的影响
反应初期PC乙醇解速率受丙二醇的影响不大(图10),因反应初始阶段溶剂体系下底物与酶之间尚处饱和状态,在传质能力较强的情况下底物间的差异还未表现出来。反应一段时间后,随着丙二醇添加比例的增大,反应速率和LPC转化率都随之降低,主要原因是含相同摩尔量的羟基时,与乙醇相比丙二醇分子体积较大,在溶液中传动能力差。且丙二醇极性较大,在非极性的正己烷中溶解性和分散性较差,不利于反应底物的接触。随着添加比例继续增大至20%、30%时,丙二醇对乙醇解的抑制作用不再增加,可能是由于丙二醇分子中羟基占分子体积的比例较大,有利于它与磷脂和酶的接触。Nelson等[28]研究发现,在正己烷溶剂中,Lipozyme RM IM在直链醇中的催化活性比在支链醇中好。溶剂体系下丙二醇对卵磷脂的乙醇解反应表现出一定的抑制作用。

图10 乙醇与1,2丙二醇相互作用对LPC转化率的影响Fig.10 Effect of interaction of ethanol and α-propelene glycol on the PLC conversion
2.3.4 丙三醇对PC乙醇解反应的影响
同丙二醇相似,丙三醇对PC的乙醇解反应也有一定的抑制作用(图11)。
有报道说甘油可能会由于传质限制而降低固定化酶活性[29-30]。脂肪酶在正己烷中有较高活性,但丙三醇在其中溶解性不好,会被固定化酶吸附堵塞通道,抑制反应。
3 结论
有机溶剂体系下,通过单因素实验确定了脂肪酶Lipozyme RM IM催化大豆卵磷脂乙醇解制备溶血卵磷脂的最适反应条件:温度40℃,加酶量15%(以PC 质量计),溶剂比1∶2(PC∶正己烷,g∶mL),底物比1∶3(PC∶醇中羟基,mol∶mol),加水量 1∶80(PC∶水,g∶μL)。在此基础上,考察醇的相互作用对卵磷脂乙醇解的影响,发现正丁醇和叔丁醇对PC乙醇解无明显影响,1,2-丙二醇和丙三醇对PC乙醇解表现出抑制作用。

图11 乙醇与丙三醇相互作用对LPC转化率的影响Fig.11 Effect of interaction of ethanol and glycerol on the PLC conversion
[1]汪勇,欧仕益,李爱军,等.流态溶血磷脂性能及HLB值的测定[J].中国油脂,2003,28(1):58-60.
[2]刘晔,裘爱泳.溶血磷脂的性能研究[J].中国油脂,1999,24(5):48-50.
[3]潘丽,谷克仁,常振刚.溶血磷脂乳化稳定性研究[J].粮食与油脂,2007,20(3):23-25.
[4]Kim M,DiMaggio C,Yan S,et al.The synergistic effect of alcohol mixtures on transesterification of soybean oil using homogeneous and heterogeneous catalysts[J].Appl Catal,A:General,2010,378(2):134-143.
[5]李桂花,钱向明,毕艳兰.油料油脂检测与分析[M].北京:化学工业出版社,2006:107-109.
[6]阮新,曾健青,张镜澄,等.有机溶剂中脂肪酶催化酯交换反应的研究[J].广州化学,1998,23(1):26-31.
[7]杨峰,毛多斌,黄顺利,等.不同介质中酶催化活性及稳定性的研究[J].河南化工,2008,25(9):1-5.
[8]刘晔,刘雳,陈亮.高稳定性磷脂的酶催化合成及应用[J].日用化学品科学,2000,23(1):196-199.
[9]Demirkol S,Aksoy H A,Tuter M,et al.Optimization of enzymatic methanolysis of soybean oil by response surface methodology[J].J Am Oil Chem Soc,2006,83(11):929-932.
[10]Aransiola E.F.Lipase catalysed ethanolysis of Jatropha oil for biodiesel production [J].Energy Environ Res,2013,3(1):85-92.
[11]王渝鹭,杨国龙,毕艳兰,等.Lipozyme RM IM催化大豆卵磷脂乙醇解制备溶血卵磷脂[J].河南工业大学学报:自然科学版,2012,33(2):35-38.
[12]Kaieda M,Samukawa T,Kondo A,et al.Effect of methonal and water conents on production of biodiesel fuel from plant oil catalyzed by various lipases in a solventfree system[J].J Biosci Bioeng,2001,91(1):12-15.
[13]Kim J,Kim BG.Lipase-catalyzed synthesis of lysophosphatidylcholine using origanic cosolvent for in situ water activity control[J].J Am Oil Chem Soc,2000,77(7):791-797.
[14]凌文慧,曹栋,陈国安,等.脂肪酶催化大豆卵磷脂和亚油酸酯交换反应的研究[J].中国油脂,2011,36(3):10-14.
[15]Haas M J,Cichowicz D J,Phillips J,et al.The hydrolysis of phosphatidylcholine by an immobilized lipase:Optimization of hydrolysis in organic solvents[J].J Am Oil Chem Soc,1993,70(2):111-117.
[16]Selmi B,Thomas D.Immobilized lipase-catalyzed ethanolysis of sunflower oil in a solvent-free medium[J].J Am Oil Chem Soc,1998,75(6):691-695.
[17]Bernardes O L,Bevilaqua J V.Biodiesel fuel production by the transesterification reaction of soybean oil using immobilized lipase [J].Appl Biochem Biotechnol,2007,137-140(12):105-114.
[18]Oliveira DD,Luccio MD,Faccio C.Optimization of enzymatic production of biodiesel from castor oil in organic solvent medium [J].Appl Biochem Biotechnol,2004,115(1-3):771-780.
[19]Santos AMP,Oliveira MG,Maugeri F.Modelling thermal stability and activity of free and immobilized enzymes as a novel tool for enzyme reactor design[J].Bioresour Technol,2007,98(16):3 142-3 148.
[20]史永革,陈斌斌,谷克仁.磷脂酶A1催化大豆粉末磷脂水解工艺研究[J].粮油食品科技,2009,17(5):21-23.
[21]Hass M.J.,Scott K.M.Diesel fuel as a solvent for the lipase-catalyzed aicoholysis of triglycerides and phosphatidylcholine[J].J Am Oil Chem Soc,1996,73(11):1 497-1 504.
[22]Oliveira D D,Filho I D N,Luccio M D.Kinetics of enzyme-catalyzed alcoholysis of soybean oil in n-Hexane[J].Appl Biochem Biotechnol,2005,121(1-3):231-242.
[23]Shaw J F,Wang D L,Wang Y J.Lipase-catalysed ethanolysis and isopropanolysis of triglycerides with longchain fatty acids[J].Enzyme Microb Technol,1991,13(7):544-546.
[24]Rodrigues R C,Volpato G,Wada K,et al.Enzymatic synthesis of biodiesel from transesterification reactions of vegetable oils and short chain alcohols[J].J Am Oil Chem Soc,2008,85(10):925-930.
[25]Royon D,Daz M,Ellenrieder G,et al.Enzymatic production of biodiesel from cotton seed oil using t-butanol as a solvent[J].Bioresour Technol,2007,98(3):648-653.
[26]Sim J H,Kamaruddin A H,Bhatia S.Biodiesel(FAME)productivity,catalytic efficiency and thermal stability of Lipozyme TL IM for crude palm oil transesterification with methanol[J].J Am Oil Chem Soc,2010,87(9):1 027-1 034.
[27]LI L L,DU W,Liu D H,et al.Lipase-catalyzed transesterification of rapeseed oils for biodiesel production with a novel organic solvent as the reaction medium[J].J Mol Catal B:Enzym,2006,43(1-4):58-62.
[28]Nelson L A,Foglia T A,Marmer W N.Lipase-catalyzed production of biodiesel[J].J Am Oil Chem Soc,1996,73(9),1 191-1 195.
[29]Dossat V,Combes D,Marty A.Continuous enzymatic transesterification of high oleic sunflower oil in a packed bed reactor:Influence of the glycerol production [J].Enzyme Microb Technol,1999,25(3-5):194-200.
[30]Fjerbaek L,Christensen K V,Norddahl B.A review of the current state of biodiesel production using enzymatic transesterification[J].Biotechnol Bioeng,2009,102(5):1 298-1 315.
