2010~2011年四川省部分地区牛乳生产链金黄色葡萄球菌及其肠毒素基因的分布*
2014-12-16韩新锋凡琴刘书亮朱冬梅赖海梅吴聪明3
韩新锋,凡琴,刘书亮,2,朱冬梅,2,赖海梅,2,吴聪明3,
1(四川农业大学食品学院,四川 雅安,625014)
2(农产品加工及贮藏工程四川省重点实验室,四川雅安,625014)
3(中国农业大学动物医学院,北京,100193)
金黄色葡萄球菌(Staphylococcus aureus)广泛存在于自然界,是引起食物中毒的重要致病菌,在美国、加拿大和中国引起的金黄色葡萄球菌食物中毒分别占整个细菌性食物中毒的33%、45%和50%[1],由此造成的经济损失也相当惨重。金黄色葡萄球菌能产生多种外毒素,其中,以耐热性肠毒素(Staphylococcal enterotoxins,SEs)引起的食物中毒最为普遍,已成为世界性卫生问题,包括中国在内的许多国家都将金黄色葡萄球菌肠毒素作为国内和国家进出口食品微生物必检指标之一。金黄色葡萄球菌肠毒素是一类结构相关、毒力相似、抗原性不同的外毒素,迄今已发现十几种金黄色葡萄球菌肠毒素并定位其基因,主要包括以下几种类型,即传统类型的SEA、SEB、SEC、SED和 SEE,新型的 SEG、SEH、SEI和 SEJ等[2]。引发的食物中毒95%与分型中的A、B、C、D及E型肠毒素相关[3],其中A型和D型占主导地位,B型、C型次之,E型的出现率最低,各肠毒素毒力不一,A型毒素毒力较强,D 型较弱[4-5]。
乳及乳制品营养成分比较完全,含有丰富的蛋白质,是易被金黄色葡萄球菌污染的主要动物性食品之一[6]。奶牛乳腺炎疾病是生鲜牛乳金黄色葡萄球菌一次污染的最主要原因,此外,生鲜牛乳挤出后,由于罐装、贮藏、运输、消毒等条件不合格亦会造成金黄色葡萄球菌的二次污染[7-8]。近些年来,国内外关于乳及乳制品中金黄色葡萄球菌污染、产肠毒素特性报道增多,分离株多携带肠毒素基因。乳及其成品中金黄色葡萄球菌及其肠毒素的存在已对食品安全构成严重威胁。本文旨在调查四川乳品生产链中金黄色葡萄球菌的污染情况,分析分离株中最常见引起食物中毒的4种肠毒素基因的携带情况,为食源性金黄色葡萄球菌风险评估以及乳品生产中HACCP的建立提供依据。
1 材料和方法
1.1 样品来源
2010年4月至2011年6月从四川省部分牛乳生产企业采集生鲜牛乳693份,生产车间半成品牛乳112份,成品牛乳88份,合计893份。
1.2 实验菌株
金黄色葡萄球菌7147(SEA阳性)、X1(SEB阳性)、B4(SEC阳性)、C8(SED阳性),作为SEs基因检测的阳性菌株。大肠杆菌ATCC25922、藤黄微球菌ATCC10209、肠炎沙门氏菌 C1CC21482,用于 SEs基因检测阴性对照,由四川农业大学食品微生物实验室保存。
1.3 培养基
7.5 %氯化钠肉汤、Baird-Parker(B-P)琼脂培养基、金黄色葡萄球菌显色培养基、冻干兔血浆、卵黄亚碲酸钾增菌液购自杭州微生物试剂有限公司。金黄色葡萄球菌产毒培养基,购自青岛高科园海博生物技术有限公司。无菌脱纤维兔血购自成都奥克生物技术有限公司。
1.4 主要试剂
GoldViewTMDNA 染料、DL 2000 DNA Marker、溶菌酶购自天根生化科技(北京)有限公司。Taq DNA聚合酶、10 ×PCR buffer、dNTP mixture(2.5 mmol/L)、MgCl2(25 mmol/L)购自宝生物工程(大连)有限公司。TIANamp Bacteria DNA Kit提取试剂盒购自天根生化科技(北京)有限公司。
1.5 金黄色葡萄球菌的分离、鉴定
采集的样品按照国家标准GB/T 4789.10—2010《食品微生物学检验——金黄色葡萄球菌检验》进行检验。具体方法如下:样品经7.5%氯化钠肉汤增菌培养,B-P平板分离纯化、选取B-P平板上疑似菌落再次划线于B-P平板直至分纯,对纯化菌株进行革兰氏染色镜检、溶血试验、血浆凝固酶试验及科玛嘉显色试验,分离鉴定出金黄色葡萄球菌。阳性菌株加入终浓度为20%的甘油,-20℃保存。

1.6 多重PCR检测SEs基因及16S rDNA
检测的肠毒素基因分别为SEA、SEB、SEC、SED,16S rDNA为内参基因,引物由宝生物工程(大连)有限公司合成(表1)。

表1 引物序列及产物大小[9-10]Table 1 Primer sequences and predicted sizes of PCR product for the amplification of S.aureus target genes
利用多重PCR对126株金黄色葡萄球菌的肠毒素基因携带情况进行检测。首先将菌株接种于5 mL LB肉汤,37℃培养24 h,收获菌体,采用 TIANamp Bacteria DNA Kit提取试剂盒提取细菌基因组DNA,-20℃保存备用。将菌株7147、X1、B4基因组 DNA按1∶1∶1混合制成 SEA、SEB、SEC 阳性模板,-20℃保存备用。
多重PCR检测肠毒素基因的反应系统经优化后采用2个扩增体系。PCR反应体系1(用于SEA、SEB、SEC 基因的检测):10 ×PCR buffer 5 μL,MgCl2(25 mmol/L)4 μL,dNTPmixture(2.5 mmol/L)2 μL,DNA 模板 2 μL,SEA(10 μmol/L)、SEB(10 μmol/L)、SEC(10 μmol/L)引物各 0.75μL,Taq DNA 聚合酶(1.25 U)2 μL,灭菌超纯水加至 50 μL。
PCR反应体系2(用于SED基因的检测):10×PCR buffer 5 μL,MgCl2(25 mmol/L)4 μL,dNTP mixture(2.5 mmol/L)2 μL,DNA 模板 2 μL,SED(10 μmol/L)引物 0.75 μL、16S rDNA 引物(10 μmol/L)0.15 μL,Taq DNA 聚合酶(1.25 U)2 μL,灭菌超纯水加至 50 μL。
两个体系的PCR反应条件均为:94℃,10 min;之后 95℃,1 min,62℃,45 s,72℃,1 min,进行 30 个循环;最后72℃延伸10 min。吸取2 μL PCR扩增产物上样于2%琼脂糖凝胶(0.5×TBE),80 V电压电泳30 min后,置于凝胶成像系统中观察、拍照,分析电泳结果。
2 结果与分析
2.1 金黄色葡萄球菌分离株的形态特征
金黄色葡萄球菌在B-P琼脂平板上菌落呈圆形,表面光滑、凸起、湿润,直径1 mm左右,灰黑至黑色,有光泽,有浅色(非白色)的边缘,周围绕以不透明圈(沉淀),其外常有一清晰带,其直径为3~5mm;在血琼脂平板上菌落呈金黄色或白色,周围有溶血圈;在科玛嘉显色平板上呈红色或粉红色;革兰氏染色显示,金黄色葡萄球菌为无芽孢、无荚膜成对或成堆排列的葡萄状G+球菌(图1)。
2.2 金黄色葡萄球菌分离株的生化鉴定结果
893份牛乳样品经增菌、分离培养和接触酶试验后,参照GB/4789.10-2010对纯化菌株进行革兰氏染色镜检、溶血及血浆凝固酶试验,将纯化分离株点种于科玛嘉显色培养基观察显色试验结果,共分离出191株金黄色葡萄球菌菌株(表2)。
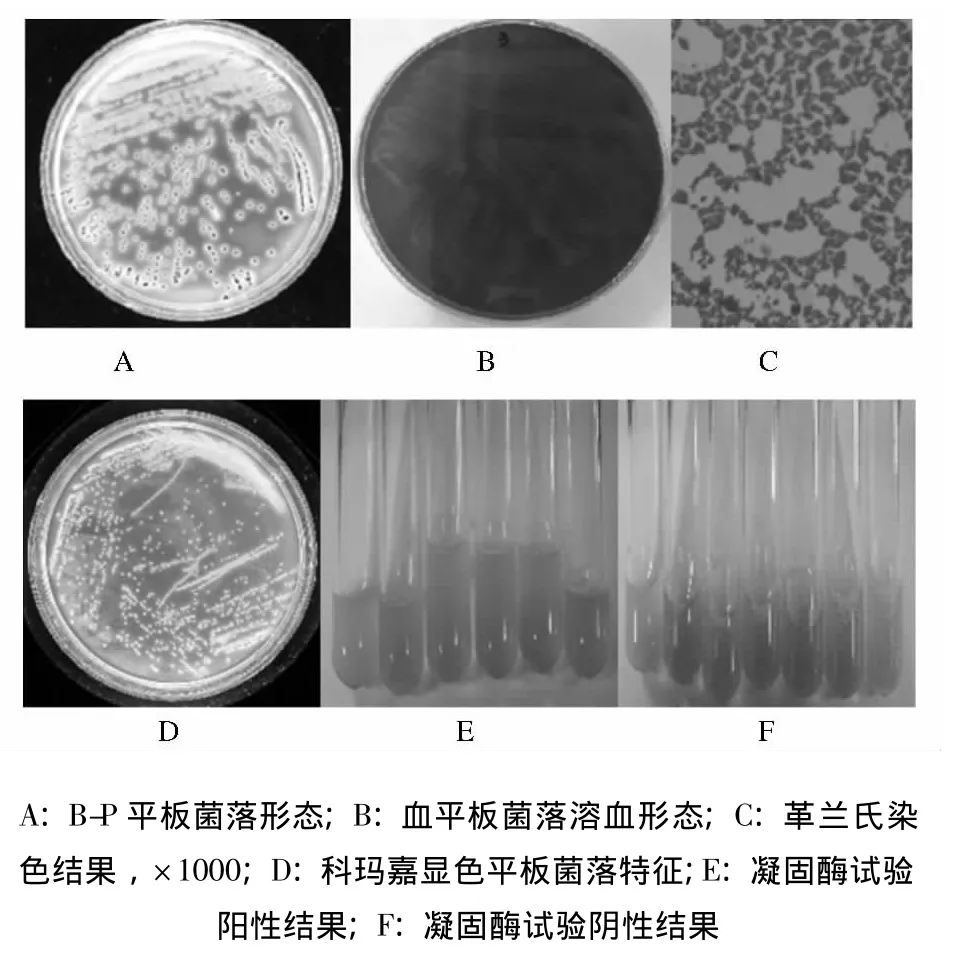
图1 金黄色葡萄球菌的菌落特征及个体形态特征Fig.1 Colony and individual morphous characteristics of S.aureus
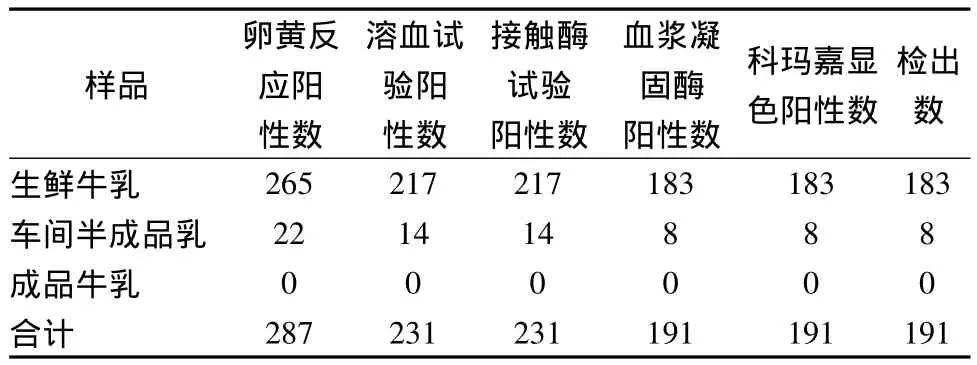
表2 乳品生产链中金黄色葡萄球菌的鉴定结果Table 2 Phenotypic identification results of S.aureus in the milk production chain
2.3 金黄色葡萄球菌的污染情况
牛乳生产链各个环节金黄色葡萄球菌总检出率为21.4%(191株),生鲜牛乳、车间半成品牛乳和成品牛乳的检出率分别为26.4%(183株)、7.1%(8株)及0.0%(0株)。
2.4 SEs基因的多重PCR检测结果
2.4.1 肠毒素基因多重PCR检测结果
通过优化反应条件所建立的多重PCR方法针对SEA、SEB、SEC基因可在同一体系同时特异性地扩增出3条目的条带,片段大小分别为521 bp、667 bp和284 bp。针对SED和内参基因16S rDNA可在同一体系同时特异性地扩增出2条目的条带,大小分别为385bp和228 bp,表明所建立的多重PCR方法检测金黄色葡萄球菌的肠毒素基因准确、可靠(图2)。
2.4.2 SEA、SEB、SEC基因多重PCR检测结果
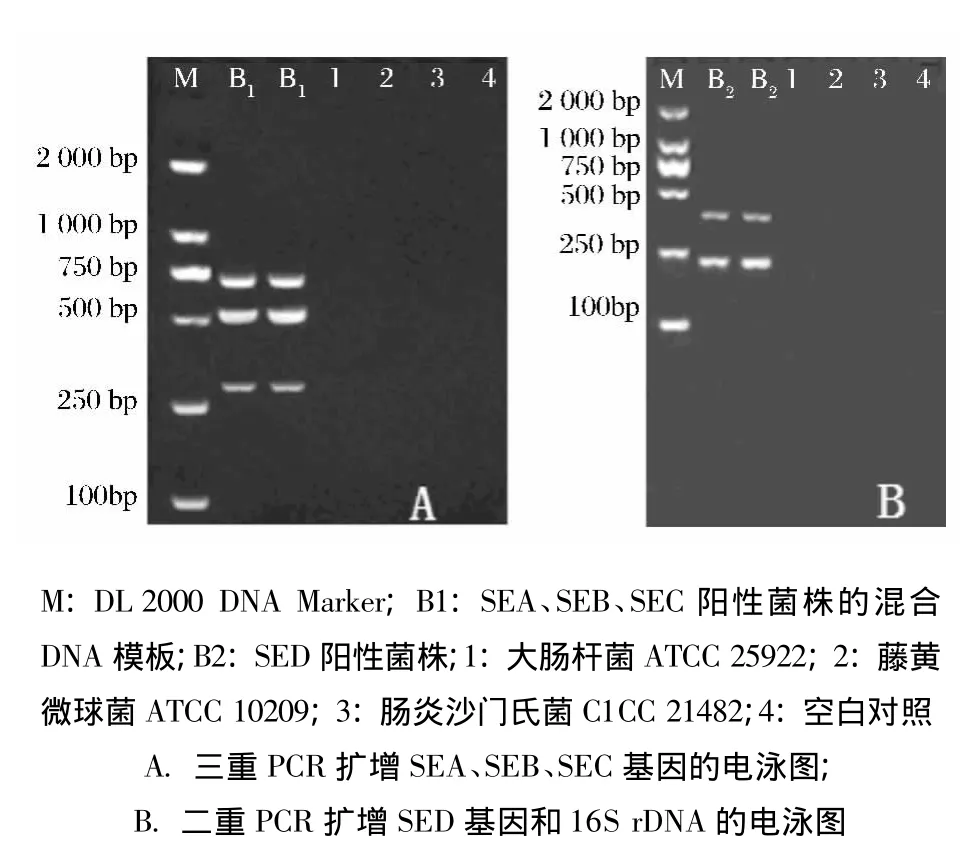
图2 多重PCR检测金黄色葡萄球菌肠毒素基因和16S rDNA的特异性试验结果Fig.2 Multiplex PCR results for the amplification of enterotoxin genes and 16s rDNA of S.aureus
来自不同生产环节的121株金黄色葡萄球菌有16株携带SEA基因,13株携带SEB基因,7株携带SEC基因,以上菌株均为生鲜牛乳源。半成品牛乳样品中未检测出肠毒素基因携带菌株(图3)。

图3 多重PCR检测牛乳生产链中部分金黄色葡萄球菌分离株SEA、SEB和SEC肠毒素基因电泳图Fig.3 Examples of multiplex PCR results for the detection of SEA,SEB,SEC genes of S.aureus isolates
2.4.3 SED及16S rDNA目标片段PCR鉴定
不同生产环节的121株金黄色葡萄球菌有4株携带SED基因,且均为生鲜牛乳源;所有菌株均可扩增出16S rDNA基因片段(图4)。
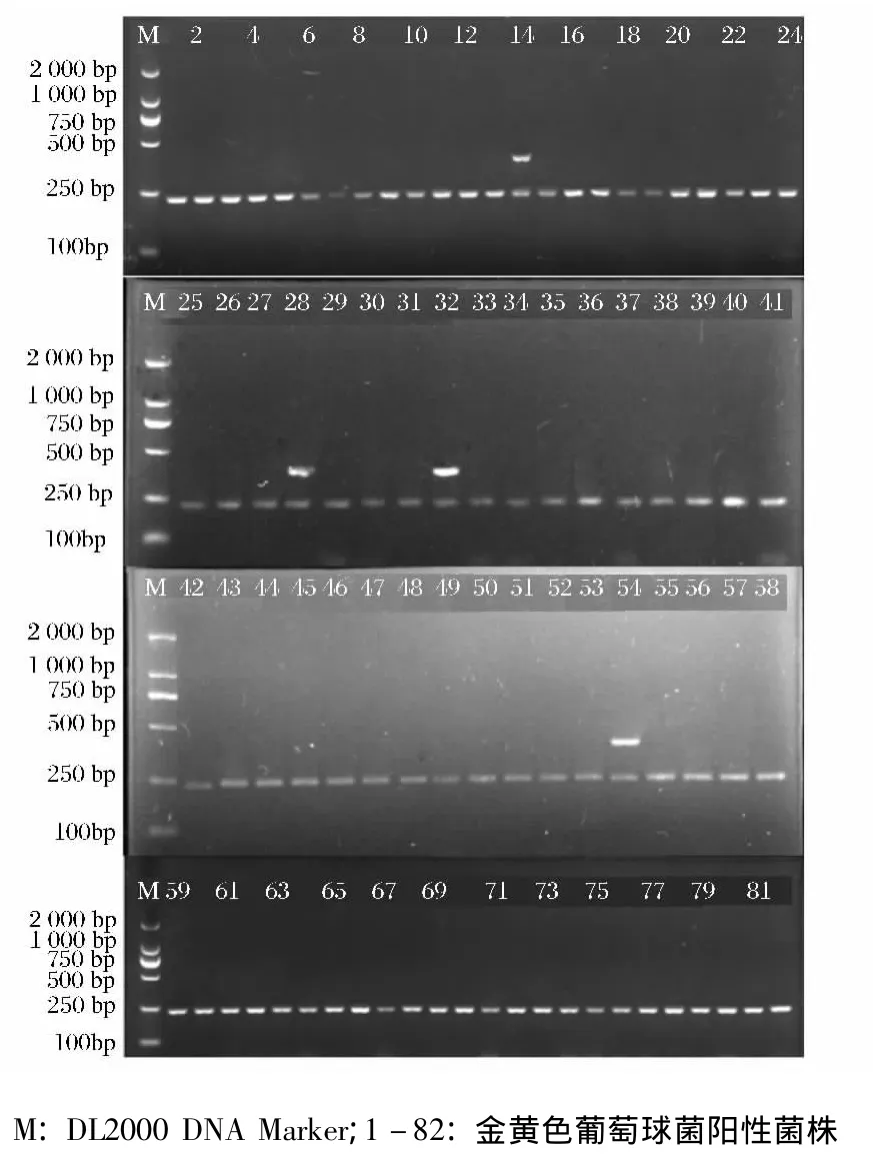
图4 多重PCR检测牛乳生产链中部分金黄色葡萄球菌分离株SED肠毒素基因和16S rDNA电泳图Fig.4 Examples of multiplex PCR results for the detection of SED gene and 16S rDNA of S.aureus isolates
2.5 各型肠毒素基因检出率统计
121株金黄色葡萄球菌肠毒素基因总检出率为22.3%(27株),生鲜牛乳源、中间过程乳源及成品乳源菌株肠毒素基因携带率分别为23.9%(27株)、0.0%(0株)及0.0%(0株)。不同生产环节的121株金黄色葡萄球菌单一SEA、SEB、SEC、SED基因检出率分别为 9.0%(11株)、4.1%(5株)、0.8%(1株)及0.8%(1株)。同时携带SEA-SEB、SEB-SEC、SEA-SED、SEA-SEB-SEC、SEB-SEC-SED 基因的菌株检出率分别为1.6%(2株)、1.6%(2株)、0.8%(1株)、1.6%(2株)、1.6%(2 株)。各分型 SEA、SEB、SEC、SED基因的总检出率分别为13.2%(16株)、10.7%(13株)、5.8%(7 株)、3.3%(4 株),生鲜牛乳源金黄色葡萄球菌各分型SEA、SEB、SEC、SED基因的总检出率与整体差异不大,分别为14.2%(16株)、11.5%(13 株)、6.2%(7 株)、3.5%(4 株);车间半成品牛乳和成品牛乳未检出携带 SEA、SEB、SEC、SED基因的金黄色葡萄球菌。金黄色葡萄球菌分离株携带的肠毒素基因总的情况为,分离株中SEA、SEB基因的存在比例较高,其它依次是SEC和SED基因。
3 讨论
国家标准将血浆凝固酶试验作为金黄色葡萄球菌判定的重要依据,但一些非金黄色葡萄球菌可以产生活性较大的蛋白酶(假凝固酶)使结果出现假阳性。本试验在国家标准的基础上,加做了金黄色葡萄球菌的科玛嘉显色试验,进一步提高了金黄色葡萄球菌表型检测结果的准确性。16S rDNA是细菌鉴定、分类的“金标准”。在多重PCR体系2中,所建立的多重PCR能够对金黄色葡萄球菌SED基因和保守序列同时进行鉴定,结果显示金黄色葡萄球菌分离株16S rDNA基因鉴定结果与表型鉴定的符合率为100.0%。
采用国标方法检测四川省部分乳品企业牛乳生产链中金黄色葡萄球菌的污染情况显示,金黄色葡萄球菌的总检出率是21.4%,其中,生鲜牛乳的检出率最高,为 26.4%,与 Normanno(38.4%)[4]、徐勤(15.20%)[11]、Lee(29.6%)[12]等的报道有所不同,表明生鲜牛乳中金黄色葡萄球菌的污染情况存在地区差异。易明梅[7]认为饲养和挤奶等环节牛体卫生消毒不彻底会导致奶牛相互之间金黄色葡萄球菌交叉污染致病;胡东良[13]对采集的340份生鲜乳进行检测,发现混装奶桶(罐)生鲜乳的金黄色葡萄球菌污染率(58.8%)高于奶牛个体(39.0%)。值得注意的是,虽然牛乳在生产过程中通过超高温瞬时杀菌(UHT)或巴氏杀菌,可以杀死牛乳中绝大多数病原微生物,但是如果原料乳中存在的金黄色葡萄球菌在合适条件下产生肠毒素,由于其具有高度的热稳定性,不能通过热力杀菌消除,依然会对乳品的质量安全带来隐患。因此,要减少金黄色葡萄球菌对生鲜牛乳的污染,除降低奶牛乳腺炎疾病的患病率和淘汰患化脓性乳腺炎的奶牛外,还应及时将挤出的乳迅速冷至10℃以下,定期对奶罐、奶车、牛奶贮藏罐及生产环境进行消毒。随着生产链的延伸,半成品牛乳及成品牛乳的污染率降低至7.1%和0.0%,与Normanno[4]、Can[14]、张兰荣[15]等报道结果基本一致。为防止食物中毒事件的发生,必须高度重视乳制品的金黄色葡萄球菌及其肠毒素的监测,加强对原料牛乳的监控,严格控制生产工艺流程中各个可能污染环节,重视对包装材料的消毒,避免成品牛乳受外界因素的影响而再次污染,保障产品检验合格方可出厂。
金黄色葡萄球菌新型肠毒素的检出比例日益增多,肠毒素蛋白纯化以及特异性抗体的制备难度较大,使得ELISA方法在肠毒素检测及肠毒素分型中应用的局限性越来越明显。用PCR技术监测食品中金黄色葡萄球菌及其肠毒素基因或对其进行分型具有特异性好、灵敏度高、节约时间的特点,具有良好的应用前景。Peles等[8]利用多重PCR技术检测发现27.1%牛奶源金黄色葡萄球菌携带SEs基因,其中以SEB基因最普遍;Pereira等[9]利用多重PCR对148株食源性金黄色葡萄球菌检测发现69%的分离株携带 SEs基因,其中以 SEA-SEG、SEA-SEG-SEI、SEGSEI基因携带菌株最为普遍;张严峻等[16]对生鲜牛乳源金黄色葡萄球菌的肠毒素基因检测发现,65.5%的菌株携带肠毒素基因,其中51.7%的菌株携带SEA基因,17.2%的菌株携带其他传统肠毒素基因(SEB~SEE),41.2%的菌株携带新型肠毒素基因(SEG~SEJ)。本研究中22.3%(27株)的菌株携带一种及多种肠毒素基因,低于上述报道,以SEA基因的携带率最高,为13.2%,其次为SEB基因,SED基因的携带率最低,说明SEA在金黄色葡萄球菌引起的食物中毒中占有重要地位,与国外SEB基因在牛乳源金黄色葡萄球菌中分布比例较高[2,8]或SEA基因最高、SED其次[17]的研究结果存在差异,这可能与分离株地域、宿主差异等不同有关。处于生产链不同环节的分离株肠毒素基因分布情况有很大差异,生鲜牛乳中肠毒素基因携带菌株检出率为23.9%,车间半成品牛乳和成品牛乳未检测出肠毒素基因携带菌株。
有研究表明,肠毒素编码基因常出现在质粒、原噬菌体、毒力岛上,在一个独立单元上,它们可同时携带一种或多种肠毒素基因,如SEB-SElK-SElQ存在于毒力岛 SaPI1上,SEC-SElL-txt存在于毒力岛 SaPI2上,SEC-SElL存在于毒力岛SaPI3上,SEA由噬菌体φSa3mu携带,SED 由质粒 PIB485携带[18]。因此,同一株菌可同时携带两种或两种以上的肠毒素基因,且不同基因型的检出率与菌株有一定的关联度。曹虹等[19]认为各肠毒素型之间关系最为密切的是SEA与SEC,Akindden等[20]发现患乳房炎奶牛产的牛奶中分离的肠毒素基因SED和SEJ基因的检出呈完全的连锁关系。本文所分离的9株生鲜牛乳源金黄色葡萄球菌携带有多种肠毒素基因型(SEA-SEB 2株;SEB-SEC 2株;SEA-SED 1株;SEA-SEB-SEC 2株;SEB-SEC-SED 2株),且不同基因型的检出率与菌株具有一定的关联性。各肠毒素分型间关系最为密切的是SEB和SEC基因(6株同时携带SEB和SEC基因),其次为SEA和SEB(4株同时携带SEA和SEB基因),观察发现,SEC与SEA、SEC及SED的出现也呈现一定的连锁关系。
本文研究了四川地区乳品生产加工环节中金黄色葡萄球菌的污染情况,分析了乳品生产链中金黄色葡萄球菌分离株肠毒素基因的分布规律,为乳及其制品中由肠毒素引起的食源性疾病的暴发提供了监测、追踪依据,为食品安全监管提供了数据支持。
[1] 蒋原.食源性病源微生物检测指南[M].北京:中国标准出版社,2010:98-109.
[2] Boerema JA,Clemens R,Brightwell G.Evaluation of molecular methods to determine enterotoxigenic status and molecular genotype of bovine,ovine,human and food isolates of Staphylococcus aureus[J].International Journal of Food Microbiology,2006,107(2):192-201.
[3] Cremonesi P,Luzzana M,Brasca M,et al.Development of a multiplex PCR assay for the identification of Staphylococcus aureus enterotoxinic strains from milk and dairy products[J].Molecular Cell Probes,2005,19(5):299-305.
[4] Normanno G,Firinu A,Virgilio S,et al.Coagulase-positive Staphylococci and Staphylococcus aureus in food products marketed in Italy [J].International Journal of Food Microbiology,2005,98(1):73-79.
[5] Lawrynowicz-Paciorek M,Kochman M,Piekarska K,et al.The distribution of enterotoxin and enterotoxin-like genes in Staphylococcus aureus strains isolated from nasal carriers and food samples [J].International Journal of Food Microbiology,2007,117(3):319-323.
[6] Jakobsen RA,Heggebo R,Sunde EB,et al.Staphylococcus aureus and Listeria monocytogenes in Norwegian raw milk cheese production[J].Food Microbiology,2011,28(3):492-496.
[7] 易明梅.上海地区牛奶乳房炎主要致病菌分析及基因治疗初探[D].上海:上海交通大学,2008.
[8] Peles F,Wagner M,Varga L,et al.Characterization of Staphylococcus aureus strains isolated from bovine milk in Hungary[J].Journal of Clinical Microbiology,2007,118(2):186-193.
[9] Pereira V,Lopes C,Castro A,et al.Characterization for enterotoxin production,virulence factors,and antibiotic susceptibility of Staphylococcus aureus isolates from various foods in Portugal[J].Food Microbiology,2009,26(3):278-282.
[10] Løvseth A,Loncarevic S,Berdal KG.Modified multiplex PCR method for detection of pyrogenic exotoxin genes in Staphylococcal isolates[J].Journal of Clinical Microbiology,2004,42(8):3869-3872.
[11] 徐勤,巢国祥.生牛奶中金黄色葡萄球菌污染状况及耐药性状研究[J].中国卫生检验杂志,2005,15(8):972-973.
[12] Lee JH.Methicillin(oxacillin)-resistant Staphylococcus aureus strains isolated from major food animals and their potential transmission to humans[J].Applied and Environmental Microbiology,2003,69(11):6489-6494.
[13] 胡东良,林雁春,刘佩红,等.乳及乳制品中金黄色葡萄球菌的分布及其理化特性研究[J].食品科学,1996,17(4):69-73.
[14] Can H Y,Celik T H.Detection of enterotoxigenic and antimicrobial resistant S.aureus in Turkish cheeses[J].Food Control,2012,24(1-2):100-103.
[15] 张兰荣,王连秀,张文利.食品中金黄色葡萄球菌的污染状况及耐药性分析[J].中国食品卫生杂志,2004,16(1):35-36.
[16] 张严峻,张俊彦,梅玲玲,等.金黄色葡萄球菌肠毒素基因的分型和分布[J].中国食品卫生杂志,2005,15(6):682-684.
[17] Morandi S,Brasca M,Lodi R,et al.Detection of classical enterotoxins and identification of enterotoxin genes in Staphylococcus aureus from milk and dairy products[J].Veterinary Microbiology,2007,124(1-2):66-72.
[18] Argudín M Á,Mendoza MC,Rodicio MR.Food poisoning and Staphylococcus aureus enterotoxins [J].Toxins,2010,2(7):1 751-1 773.
[19] 曹虹,王敏,郑荣,等.金黄色葡萄球菌临床分离株肠毒素基因的调查分析[J].南方医科大学学报,2012,32(5):738-745.
[20] Akineden O,Annermuller C,Hasson A A,et al.Toxin genes and other characteristics of Staphylococcus aureus isolates from milk of cows with mastitis[J].Clinical and Diagnostic Laboratory Immunology,2001,8(5):959-964.
