纳米传感器在食品检验中的应用*
2014-12-16王晓岑井晶滕刚王哲于艳燕
王晓岑,井晶,滕刚,王哲,于艳燕
1(黑龙江省孤儿职业技术学校,哈尔滨黑龙江,150025)
2(哈尔滨工业大学极端环境营养与防务研究所,哈尔滨黑龙江,150090)
3(哈尔滨工业大学食品科学与工程学院,哈尔滨黑龙江,150090)
4(北大荒马铃薯研究院,哈尔滨 黑龙江,161005)
纳米传感器将纳米技术与物理、化学、生物和信息技术融合,较传统的检测装置比,具有尺寸小、质量轻、能耗低、选择性强、检出限低等特点。2005年,纳米传感器全球市场价值是1.85亿美元,而到了2012年,其市场价值飙升至172亿美元,预计到2020年,纳米相关产业将给全球经济带来3万亿美元的市场价值,并在今后10年提供600万个就业岗位。时至今日,该领域技术的研发取得了蓬勃发展,已经有许多专门的公司在制造纳米传感器,并已应用到电子计算机、通信、能源生产、医药和食品等多个领域[1-2]。食品质量安全对消费者的健康是至关重要的,纳米传感器可以实时监测食品中气体、香味、化学污染物和病原体的变化,能在源头上控制食品的质量,提示消费者在产品新鲜程度和风味鼎盛时期及时购买,这不但有利于食品质量的控制,而且这种技术也有助于提高食品安全性并降低食源性疾病的发生机率。例如,纳米传感器可以直接放入食品包装材料中,在那里它们将作为“电子舌头“或“鼻子”检测食品腐败变质过程中释放的化学物质,它们捕捉反映食品气味、微生物、毒素和污染物的信号后,通过改变条带颜色或生成相关信号等来表征食品的质量[3-4]。
1 纳米小分子传感器
用来检测食品中小分子的纳米传感器,是基于金属纳米粒子与被检测物发生显色反应,产物浓度与吸光度值之间呈线性关系,根据比色法来检测目标物在食品中的含量。逯乐慧等通过研究发现,红色的金纳米粒子——氰尿酸基团与三聚氰胺结合呈现蓝色,当样品中没有三聚氰胺时,显色为红色,随着三聚氰胺含量的升高,蓝色逐渐变深。通过这种技术可以精确检测原料奶和婴儿配方奶粉中三聚氰胺的含量,检出限是 2.50 μg/L[5]。用 18-冠醚-6 修饰的黄金纳米粒子(GNPs)能与胺形成复合物,该GNPs的表面等离子体共振条带具有较高的消光系数和光谱灵敏度,通过视觉观察和光谱分析均可实现三聚氰胺快速、灵敏的检测,三聚氰胺的检测范围是10~500 μg/L,检出限为6 μg/L,这远低于美国食品和药品管理局对婴儿配方奶粉中三聚氰胺1 mg/L的容许量[6]。除利用检测物吸收光的显色反应外,小分子检测系统还能借助于荧光标记技术。例如,荧光增强酶联免疫吸附实验(EFLISA),可检测食品中以蛋白质为基础的分析物。麦胶蛋白(Gli)是导致麦胶性肠病的主要原因,Maria Staiano等采用银纳米粒子岛膜(SIFs)和经罗丹明标记的抗麦胶蛋白抗体结合的传感器,应用金属增强荧光释放法(TIRF)检测食品中的麦胶蛋白,检出限是60 μg/L。传感器示意图如图1所示,首先Gli被SIFs表面涂有抗Gli的抗体捕获,然后捕获后的Gli与经荧光标记的抗-Gli抗体孵育,经荧光团标记的抗Gli抗体与抗原结合的信号通过TIRF检测。

图1 传感器原理示意图[7]Fig.1 Principle of sensor[7]
这种方法能精确检出无麸质食品中湿面筋含量,对麦胶性肠病易感人群的饮食选择具有指导意义[7]。逯乐慧等发明了一种以金纳米粒子为基础的荧光传感器,利用氰化物腐蚀诱导金纳米团簇发生荧光猝灭的原理,来检测食品、土壤、水和生物样品中的氰化物,由于氰化物和金纳米团簇中金原子的埃尔斯纳反应,该传感器有很好的选择性。此传感器检测氰离子的检出限可达到2.0×10-7mol/L,这约等于世界卫生组织规定饮用水中氰化物上限(2.7×10-6mol/L)的1/14。此外,将氰化物标准品分别掺入到地下水、自来水、池塘水和湖水等一些水样后,再使用传感系统进行分析表明,这种方法的加标回收率大于93%[8]。Vicky等发明了以脂质体为基础的纳米生物传感器,能检出含量极低的有机磷农药敌敌畏和对氧磷。他们将乙酰胆碱酯酶、吡喃酮(荧光pH指示剂)固定在纳米脂质体的内部,当酶促反应发生时,光信号被捕捉。增加农药量能导致乙酰胆碱酯酶的活性降低,从而脂质中荧光pH指示剂的信号减弱。当敌敌畏和对氧磷下降到10-10mol/L水平时,脂质体的生物传感器信号才减弱。这种生物传感器系统已成功应用于饮用水样品中有毒有害物质的检测[9]。Ellen等利用发光效率高的半导体纳米晶体(核:CdSe-ZnS;壳:量子点)和免疫荧光抗体制成的传感器,采用夹心免疫法能同时检测霍乱毒素、蓖麻毒素、志贺氏毒素和葡萄球菌肠毒素B。使用荧光抗体标记量子点发光技术还能检测出一些以蛋白质为基础的细菌毒素,例如,肉毒毒素A已经能在pmol/L的水平上检出[10]。这种技术有益于提高食品安全性、降低食源性致病菌诱发疾病的机率。
在食品检验中,以纳米材料传感器为基础的电化学检测也是一种流行方法,与比色法和荧光法相比,这种方法精度更高,它可以避免被检测物对光的散射和吸收造成的系统误差。许多电化学传感器的工作原理是利用导电纳米材料(如,碳纳米管)联结选择性抗体,当靶分析物结合到抗体时,通过检测材料导电性的变化来推算分析物的含量。由蓝藻产生的微囊藻毒素-LR(MCLR)是水污染的罪魁祸首之一,Nicholas等发现,将MCLR抗体绑定到单壁碳纳米管表面时,会产生电流的变化,根据检测物浓度与电流强度的线性关系可推算出MCLR的检出范围是0.6~10 nmol/L,这项技术已经被世界卫生组织应用于饮用水中MCLR的检测,如图2所示[11]。
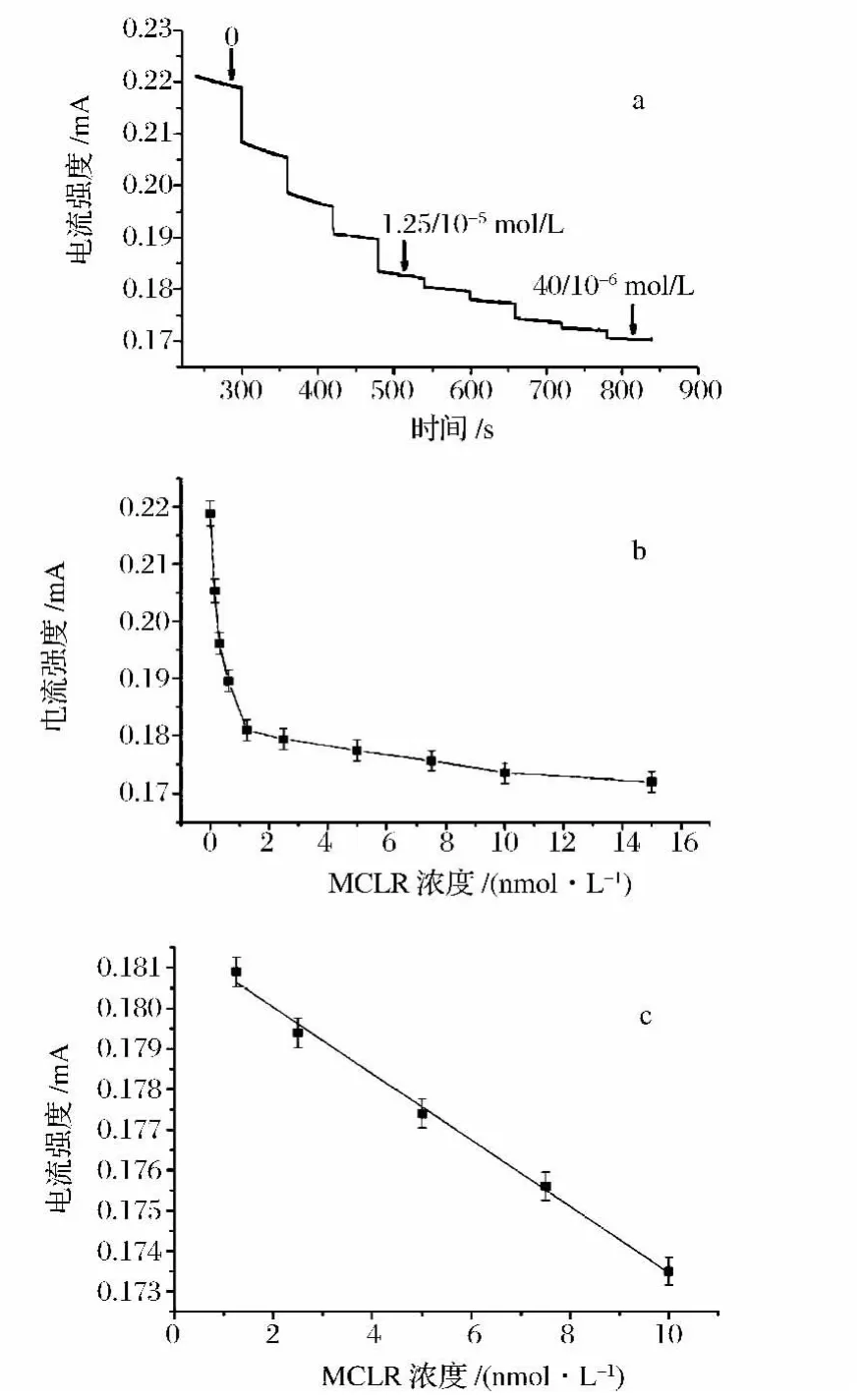
图2 MCLR的检测结果(a)和检测校准曲线(b)和(c)[11]Fig.2 The sensing results of MCLR(a)and the calibration curve of determination(b)and(c)[11]
类似的方法有,利用金纳米粒子和葡萄糖敏感酶制成的生物传感器可用于检测商业饮料中葡萄糖的含量[12],一种可重复使用的压电金纳米粒子免疫传感器,已经被应用到检测牛奶样品中黄曲霉毒素B1,该方法的检出限是10 ng/L[13]。其他以电化学为基础的纳米材料传感器包括:基于氧化铈纳米粒子和壳聚糖纳米复合材料检测食源性真菌污染物,如赭曲霉毒素A、金黄色葡萄球菌[14];分别用硅纳米线晶体管和碳纳米管(CNTs)检测金色葡萄球菌肠毒素B和霍乱毒素[15-16]。使用碳纳米管能定性和定量检测食品中的着色剂(软饮料中的丽春红4R、诱惑红;番茄酱或辣椒粉中的苏丹红1号[17-18]),并且着色剂的含量与其特定氧化峰值呈线性关系。需要注意的是分析物不限于有害物质:一项研究表明,基于碳纳米管的电化学检测的微流体装置,可用来检测苹果和香子兰豆中抗氧化物质、风味物质和维生素的含量[19]。
2 纳米气敏传感器
包装内多余的水分和氧气是导致食品腐败变质的重要原因,但许多分析包装内水分和气体含量的方法必须破坏包装。食品的传统检验采取抽检方式,这种方式需要大量资金和时间投入,且不能确保未抽到的产品达到食品质量和安全标准。因此,实时监控食品包装顶空气体含量是保障食品安全的有效措施。Mills等将纳米TiO2或纳米SnO2颗粒与氧化还原染料(亚甲基蓝)结合,制成的光敏变色检测器,可用于检测食品包装内的氧气,当包装内有氧存在时,检测器的条带由白色变为蓝色,虽然这种方法很难定量分析食品包装内的氧气含量,但它仍然能给消费者和零售商提供一个简单、直观的评判方法,并确保气调包装(MAP)的密封和完整性[20]。一种基于碳包覆纳米铜粒子分散在硅表面活性剂膜中的光学湿度传感器,可用于食品包装内水分含量的测定,在潮湿的环境中,聚合物基体的溶胀引起纳米粒子分离度增大,这些变化导致传感器反射或吸收不同颜色的光,呈现不同的颜色。从而可在不破坏包装的情况下,根据传感器的不同颜色来准确检测包装内的水分含量[21]。Christoph von Bultzingslowen等研制了一种带CO2检测装置的气调包装,它是将荧光pH指示剂1-羟基芘-3,6,8-三磺酸(HPTS)固定在经疏水性有机改性的二氧化硅基质上(ORMOSIL)。使用十六烷基三甲基氢氧化铵作为内部缓冲系统。通过双荧光体定位技术(DLR),按照相位法测量荧光的寿命,从而实现检测CO2含量的目的。这种CO2传感器的检测范围是0.08% ~100%,分辨率达到1%,并且与O2交叉灵敏度只有0.6%[22]。其他一些与食品质量安全相关的气体传感器系统包括:利用二萘嵌苯荧光纳米纤维,采用荧光淬灭法检测鱼和肉腐败时产生的胺,理论检出限可达到ng/L水平[23-24];利用SnO2纳米颗粒和TiO2微米棒复合材料的电导变化,检测肉腐败产生的胺,检出限能达到 mg/L水平[25];利用 ZnOTiO2纳米复合材料或SnO纳米带的一系列电子传感器,可检测食品中是否存在的挥发性有机物,包括丙酮、乙醇和一氧化碳[26-27];WO3-SnO2纳米复合材料制备的传感器能检测乙烯气,这项技术在评价果蔬成熟方面具有潜在的应用价值[28]。
3 纳米微生物传感器
食源性致病菌是引发食物中毒的重要因素,因此开发方便快捷、成本低廉的食源性致病菌检测装置尤为重要。常用的生物检测方法是,基于选择性抗体-抗原相互作用的免疫学检测。以纳米材料为基础的微生物传感器采用了同样的方法,他们具有光学和电学性能相结合的特点,易功能化表面,所以与基于宏观材料的化学或生物方法相比,有更灵敏的选择性和更快的检测速度。由于纳米材料独特的电学和光学性能,越来越多地依赖纳米材料的病原体检测正逐渐代替了传统的微生物分析方法。
当检测复杂基质时(如食品样品混浊,光的散射,颜色多样和其他许多干扰等),食品系统的检测要求目标生物与周围的环境隔离,确保信号—噪声比足够大,以便于观察。通常情况下,这种技术被称为免疫磁性分离法(IMS)。IMS是利用磁性纳米颗粒与选择性抗体结合,能从食品基质中实现对靶相生物目标的快速分离,可在样品的前处理中使用。磁性纳米颗粒由于其极高的比表面积,有利于提高分析物的捕获效率,捕获的分析物经纯化后即可进行标准的分析检测,如图3所示。
特定的细菌菌株或菌种的选择性抗体(如大肠杆菌)被绑定到磁性纳米粒子的表面(如三氧化二铁)。如果目标分析物存在于复杂的基质中(如食物、血液等),且有许多潜在的干扰(如其他细菌、病毒、蛋白质、食物或血液等)。把功能化的纳米粒子添加到基质后,它们能有选择地、高效地捕获目标分析物。当把上清液倾倒出后,剩下的就是经磁场隔离的与磁性纳米颗粒结合的分析物。然后对余下的物料进行定量分析。
在人工污染的牛奶中,连接选择性单核细胞增生李斯特菌抗体的磁性氧化铁纳米粒子也可以用来有效地分离目标菌种,并通过实时荧光定量PCR(RT-PCR)对他们进行分析检测[29]。IMS还被用于从新鲜碎牛肉中分离大肠埃希菌,捕集效率>94%,且对非测试的细菌没有干扰[30]。磁性纳米粒子不仅可以从基质中绑定和隔离微生物,他们还可以将分离和检测目标微生物同时进行。相对于那些靶标生物,具有更小尺寸的纳米粒子与目标检测物结合前后,会产生比较大的、很容易观察到的电/光特性的变化,这使得微生物检测变得更加容易。有许多例子表明了纳米材料在这方面的应用,磁性纳米粒子可用于从污染全脂奶中分离副结核分枝杆菌,并且通过观察共轭诱导的磁性颗粒凝聚在水质子附近的自旋—自旋弛豫时间(T2)来确定细菌的含量,此方法不易受基质中其他细菌干扰[31]。与其相类似的方法还有,通过测量结合的和未结合的氧化铁颗粒磁化率的变化(颗粒流体动力学体积的相关变化)能有效检测被感染的牛血清中的布鲁氏菌抗体[32]。高度灵敏的纳米技术还有一个显著的优点,就是能减少检测所需的时间。El-Boubbou利用糖分子附着的磁性纳米氧化铁颗粒,只用5 min就能在样品上清液中分离88%的大肠杆菌,然后用荧光染色法对大肠杆菌进行定量分析[33]。Irudayaraj等改进了这种方法,使用菌株特异性抗体(大肠杆菌O157:H7抗体或鼠伤寒沙门氏菌抗体)代替糖分子,在2%的牛奶和菠菜提取物中分离靶标生物,并用红外光谱法定量检测,检测范围是104~105CFU/mL,30 min内即可完成全部实验[34]。李延斌等利用IMS从试验样品中分离大肠杆菌,半导体纳米晶体(量子点)作为荧光标记,检测范围为103~107CFU/mL,总检测时间只有2 h,而传统的细菌平板培养方法为18~24 h[35]。纳米材料还可以用于多重分析检测,条形码式检测方法就是利用选择性抗体结合到多金属纳米线的特定区域磁场,采用光学方法检测细菌、病毒和蛋白质毒素[36]。
电化学与纳米材料配合使用也能有效检测食品中的微生物,利用选择性抗体作为传感元件、导电纳米材料作为电信号元件制成的传感器被用来检测食品中的致病微生物,通过变化整个纳米级元件的电路、电导或电阻即可被用来检测相应的微生物。李延斌等发明了涂有选择性的单核细胞增生李斯特菌抗体的导电二氧化钛纳米线束,并将它们置于2个金电极之间,在受污染的样品中,细菌与抗体结合使纳米线束的阻抗发生变化。利用这种技术,他们能够在1 h内完成对单核细胞增生李斯特菌的检测,检出限低至4.7×102CFU/mL,并不受其他食源性致病菌的干扰,传感器工作原理如图4所示[37]。

图4 基于阻抗原理检测细菌的示意图[37]Fig.4 Impedance-based detection of bacteria[37]
图4-a中,经正丁巯醇配体保护的金电极,用导电的TiO2纳米线束连接。目标细菌选择性抗体被绑定到纳米线束上。当传感器置于含目标生物的复杂基质中时,经绑定的电阻就会发生改变,因此细菌与抗体的结合很容易被观察到。图4-b表明在对照介质中,金电极两端电阻没有变化。图4-c表明在细菌介质中,免疫选择绑定的电极中电阻变化明显。
Sudeshna开发了一种生物传感器,它是通过捕捉抗原—抗体相互作用后电子电荷流动所产生的阻力信号,来反映食品中的蜡样芽胞杆菌的含量。该生物传感器使用选择性抗体作为传感元件、聚苯胺纳米线作为分子的电信号传感器。这种传感器包含四个膜,即样品前处理、共轭、捕获和吸收膜。检测技术是基于毛细管流动原理,允许液体样品从一个膜运动到另一个膜。从样品前处理到最终检出结果仅用时6 min,该传感器的检测范围是 10 ~ 102CFU/mL[38]。Raquel等将抗沙门氏菌抗体吸附于单壁碳纳米管上,并涂装吐温20进行保护,以防止其他细菌或蛋白质的非特异性结合,能在1 h内完成沙门氏菌的检测,且能排除化脓性链球菌和宋内氏志贺氏菌对检出结果的干扰,检出限为 1.0 ×102CFU/mL[39]。So Hyemi等发现单壁碳纳米管场效应晶体管(SWNTFET)绑定大肠埃希氏菌后,导电率下降50%以上,这种材料为微生物快速检测提供了平台[40]。
4 结论
现阶段,纳米传感器技术可以与传统的抽检法结合,虽然仍不能反映全部产品的质量,但较传统检测方法能更加精确、迅捷的检测食品质量。将纳米传感器整合到食品包装的无创动态检测方法,虽然能动态监控食品的质量,但是当纳米传感器捕获食品的相关信息时,纳米粒子也可能从包装材料中迁移到食品中去,需要注意其使用的安全问题,必须对纳米粒子进行全面的安全评估后才能使用。
纳米传感器从实验室研发到在食品工业中的应用,尚处于起步阶段。制约纳米传感器发展的因素主要有以下几个方面,(1)纳米材料成本。制造纳米传感器的材料,如金、银等材料的价格昂贵,广泛应用会导致使用成本过高。(2)纳米材料安全性。有些材料,如金、银或硅等材料在宏观尺度上会损害人类和动物的健康,当他们以纳米尺度存在时,纳米粒子有更强的反应活性,可能会产生更大的毒性。这些物质在体内导致氧化应激增加,反过来又可以产生自由基,可能导致DNA突变,诱发癌症,甚至造成死亡。(3)纳米传感器与宏观世界的联系问题。纳米传感器需要一系列配套装置,它们能在纳米尺寸上与传感器建立联系,这样才能实现纳米传感器与宏观世界的双向沟通。为了解决上述问题,亟待研发成本低廉、进入人体不产生毒副作用的新纳米材料来替代现有的致毒材料。建立健全完善的纳米材料安全评价体系也是非常必要的,只有做到有章可循、有据可查,才能推动该产业既安全又快速地发展。加大力度开发高相容性的纳米级集成电路,使纳米传感器与计算机建立联结,并创建相应的程序软件,将使试验数据分析更加精确。
[1] Zatirostami A.Performance materials,nano-biotechnology in agriculture as biological sensors[J].Australin Journal of Basic and Applied Sciences,2011,5(8):981-985.
[2] Roco M C,Mirkin C A,Hersam M C.Nanotechnology research directions for societal needs in 2020[M].Springer,2010:1-29.
[3] Dirk Lange,Christoph Hagleitner,Andreas Hierlemann,et al.Complementary metal oxide semiconductor cantilever arrays on a single chip:mass-sensitive detection of volatile organic compounds[J].Analytical Chemistry,2002,74(13):3 084-3 095.
[4] Garcia M,Aleixandre M,Gutiereez J,et al.Electronic nose for wine discrimination[J].Sensors and Actuators B:Chemical,2006,113(2):911-916.
[5] Kelong Ai,Yanlan Liu,Lehui Lu.Hydrogen-bonding recognition-induced color change of gold nanparticles for visual detection of melamine in raw milk and infant formula[J].Journal of the American Chemical Society,2009,131(27):9 496-9 497.
[6] Hua Kuang,Wei Chen,Wenjing Yan,et al.Crown ether assembly of gold nanoparticles:Melamine sensor[J].Biosensors and Bioelectronics,2011,26(5):2 032-2 037.
[7] Maria Staiano,Evgenia G Matveeva,Mauro Rossi,et al.Nanostructured silver-based surfaces:new emergent methodologies for and easy detection of analytes[J].ACS Applied Materials& Interfaces,2009,1(12):2 909-2 916.
[8] Yanlan Liu,Kelong Ai,Lehui Lu,et al.Gold-nanocluster-based fluorescent sensors for highly sensitive and selective detection of cyanide in water[J].Advanced Functional Materials,2010,20(6):951-956.
[9] Vicky Vamvakaki,Nikos A.Chaniotakis.Pesticide detec-tion with a liposome-based nano-biosensor[J].Biosensors and Bioelectronics,2007,22(12):2 848-2 853.
[10] Ellen R.Goldman,Aaron R.Clapp,George P.Anderson,et al.Multiplexed toxin analysis using four colors of quantum dot fluororeagents[J].Analytical Chemistry,2004,76(3):684-688.
[11] Libing Wang,Wei Chen,Nicholas A Kotov,et al.Simple,rapid,sensitive,and versatile SWNT-paper sensor for envirnomental toxin detection competitive with ELISA[J].Nano Letters,2009,9(12):4 147-4 152.
[12] Caglar Ozdemir,Fatma Yeni,Dliek Odaci,et al.Electrochemical glucose biosensing by pyranose oxidase immobilized in gold nanoparticale-polyaniline/AgCl/gelatin nanocomposite matrix[J].Food Chemistry,2010,119(1):380-385.
[13] Jin Xiaoyong,Jin Xuefang,Chen Liguo,et al.Piezoelectric immunosensor with gold nanoparticles enhanced competitive immunoreaction technique for quantification of Aflatoxin B1[J].Biosensors and Bioelectronics,2009,24(8):2 580-2 585.
[14] Kaushik A,Solanki P R,Pandey M K,et al.Cerium oxide-chitosan based nanobiocomposite for food borne mycotoxin detection[J].Applied Physics Letters,2009,95(17):173703-173703-3.DOI:10.10631/1.3249586.
[15] Nirankar N Mishra,Wusi C Maki,Eric Cameron,et al.Ultra-sensitive detection of bacterial toxin with silicon nanowire transistor[J].Lab Chip,2008,8(6):868-871.
[16] Subramanian Viswanathan, Wu Li-chen, Ming-ray Huang,et al.Electrochemical immunosensor for cholera toxin using liposomes and poly(3,4-ethylenedioxythiophene)-coated carbon naotubes[J].Analytical Chemistry,2006,78(4):1 115-1 121.
[17] Zhang Yu,Zhang Xiaojun,Lu Xiaohua,et al.Muti-wall carbon nanotube film-based electrochemical sensor for rapid detection of Ponceau 4R and Allura Red[J].Food Chemistry,2010,122(3):909-913.
[18] Mo Zhirong,Zhang Yafen,Zhao Faqiong,et al.Sensitive voltammetric determination of Sudan I in food samples by using Gemini surfactant-ionic liquid-multiwalled carbon nanotube composite film modified glassy carbon electrodes[J].Food Chemistry,2010,121(1):233-237.
[19] Gonzalez Crevillen A,Monica Avila,Martin Pumera,et al.Food analysis on microfluidic devices using ultrasensitive carbon nanotubes dectectors[J].Analytical Chemistry,2007,79(19):7 408-7 415.
[20] Andrew Mills.Oxygen indicators and intelligent inks for packaging food[J].Chemical Society Reviews,2005,34(12):1 003-1 011.
[21] Norman A.Luechinger,Stefan Loher,Evagelos K.Athanassiou,et al.Highly sensitive optical detection of humidity on polymer/metal nanoparticle hybrid films[J].Langmuir,2007,23(6):3 473-3 477.
[22] Christoph von Bultzingslowen,Aisling K McEvoy,Colette McDoagh,et al.Sol-gel based optical carbon dioxide sensor employing dual luminophore referencing for application in food packaging technology[J].Analyst,2002,127(11):1 478-1 483.
[23] Che Yanke,Yang Xiaomei,Stephen Loser,et al.Expedient vapor probing of organic amines using fluorescent nanofibers fabricated from an n-type organic semiconductor[J].Nano Letters,2008,8(8):2 219-2 223.
[24] Yanke Che,Ling Zang.Enhanced fluorescence sensing of amine vapor based on ultrathin nanofibers[J].Chemical Communications,2009,34:5 106-5 108.
[25] Zhang Wen-hui,Zhang Wei-de.Fabrication of SnO2-ZnO nanocomposite sensor for selective sensing of trimethylamine and the freshness of fishes[J].Sensors and Actuators B:Chemcial,2008,134(2):403-408.
[26] Comini E,Faglia G,Sberveglieri G,et al.Tin oxide nanobelts electrical and sensing properties[J].Sensors and Actuators B:Chemical,2005,111-112(11):2-6.
[27] Davide Barreca,Elisabetta Comini,Angelo P.Ferrucci,et al.First example of ZnO-TiO2nanocomposites by chemical vapor deposition:structure,morphology,composition,and gas sensing performances[J].Chemistry of Materials,2007,19(23):5 642-5 649.
[28] Yootana Pimtong-Ngam,Sirithan,Jiemsirilers,Sitthisuntorn Supothina.Preparation of tungsten oxide-tin oxide nanocomposites and their ethylene sensing characteristics[J].Sensors and Actuators A:Physical,2007,139(1/2):7-11.
[29] Hua Yang,Liangwei Qu,Adrienne N.Wimbrow.Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PRC[J].International Journal of Food Microbiology,2007,118(2):132-138.
[30] Madhukar Varshney,Liju Yang,Li Suxiao et al.Magnetic nanoparticle-antibody conjugates for the separation of Escherichia coli O157:H7 in ground beef[J].Journal of Food Protection,2005,68(9):1 804-1 811.
[31] Charalambos Kaittanis,Saleh A.Naser and J.Manuel Perez.One-step,nanoparticle-mediated bacterial detection with magnetic relaxation[J].Nano Letters,2007,7(2):380-383.
[32] Andrea Fornara,Petter Johansson,Karolina Petersson,et al.Tailored magnetic nanoparticles for direct and sensitive detection of biomolecules in biological samples[J].Nano Letters,2008,8(10):3 423-3 428.
[33] Kheireddine El-boubbou, Cyndee Gruden and Xuefei Huang.Magnetic glycol-nanoparticles:a unique tool for rapid pathogen detection,decontamination,and strain differentiation[J].Journal of the American Chemistry Society,2007,129(44):13 392-13 393.
[34] Sandeep P Ravindranath,Lisa J Mauer,Joseph Irudayaraj,et al.Biofunctionalized magnetic nanoparticle integrated mid-infrared pathogen sensor for food matrices[J].Analytical Chemistry,2009,81(8):2 840-2 846.
[35] Xiao-Li Su and Yanbin Li.Quantum dot biolabeling coupled with immunomagnetic separation for detection of Escherichia coli O157:H7[J].Analytical Chemistry,2004,76(16):4 806-4 810.
[36] Tok J B H,Chuang F Y S,Kao M C,et al.Metallic striped nanowires as multiplexed immunoassay platforms for pathogen detection[J].Angewandte Chemie International Edition,2006,45(41):6 900-6 904.
[37] Wang Ronghui,Ruan Chuanmin,Li Yanbin,et al.TiO2nanowire bundle microelectrode based impedance immunosensor for rapid and sensitive detection of Listeria monocytogenes[J].Nano Letters,2008,8(9):2 625-2 631.
[38] Sudeshna Pal,Evangelyn C Alocija,Frances P Downes.Nanowire Labeled direct-charge transfer biosensor for detecting Bacillus species[J].Biosensors and Bioelectronics,2007,22(9/10):2 329-2 336.
[39] Raquel A Villamizar,Alicia Maroto,Xavier Rius F,et al.Fast detection of Salmonella Infantis with carbon nanotube field effect transistors[J].Biosensors and Bioelectronics,2008,24(2):279-283.
[40] Hye-Mi So,Dong-Won Park,Eun-Kyoung Jeon,et al.Detection and tier estimation of escherichia coli using aptamer-functionalized single-walled carbon-nanotube field-effect transistors[J].Small,2008,4(2):197-201.
