微波固相合成大豆分离蛋白-乳糖接枝物及其流变特性研究*
2014-12-16石燕陈智韡涂宗财黄小琴沙小梅李雪
石燕,陈智韡,涂宗财,,王 辉,黄小琴,沙小梅,张 璆,李雪
1(南昌大学食品科学与技术国家重点实验室,南昌大学食品科学与工程系,江西南昌,330047)
2(江西师范大学生命科学学院,江西南昌,330022)
流变学是研究物质的流动和变形的科学,它与物质的组织结构有密切关系。通过对食品流变特性的研究,可以了解食品的组成、内部结构和分子形态等,可为产品配方、加工工艺、设备选型及质量检测等提供理论依据[1-2]。
大豆分离蛋白(SPI)是一种蛋白含量90%以上的商用大豆蛋白产品,营养价值高,功能性良好,价格便宜,资源丰富,作为一种重要的原料广泛地应用于食品工业中[3]。大豆蛋白的流变性在调整食品的物性方面十分重要,在饮料、汤等流体食品中,蛋白质体系的黏弹性是重要功能性质;另一方面,研究蛋白质流变特性,通过分析样品粘弹性的改变,推测蛋白质结构的变化[2]。
微波加热(mircowave heating,MH)是一种安全、高效、节能的热处理方法,它能保持产品中更多营养成分,并广泛地应用在食品工业中[4]。微波加热对糖基化修饰的研究[5-7]已有报道,这些研究大多通过缓冲溶液或液体进行传导,微波固相加热糖基化的研究较少[8]。微波辐射用于加热的机理是微波辐照导致目标分子电偶极子发生旋转和振动。水分子属极性分子,介电常数较大,微波辐射优先被水分子吸收,而蛋白质、碳水化合物等的介电常数相对较小,其对微波的吸收能力比水小得多。因此,为了减少由于水分子优先被加热而导致目标分子间接加热的影响,本研究采用微波加热大豆分离蛋白-乳糖固体混合物的方法来合成蛋白质-糖接枝物,并且对接枝物流变特性的变化进行研究。
1 材料与方法
1.1 材料与仪器
大豆蛋白:粗蛋白含量65.0%,水分7.0%,谷神生物科技集团有限公司;乳糖,阿拉丁,邻苯二甲醛(OPA),Sigma公司;Mark(10~200kDa),Fermentas公司;十二烷基磺酸钠(SDS),β-巯基乙醇,硼砂,甲醇,硅油,30%聚丙烯酰胺,Tri-HCl(pH 6.8)缓冲溶液,Tri-HCl(pH 8.8)缓冲溶液,4×蛋白质上样缓冲溶液,NaOH,HCl等均为分析纯。
LGJ-1型冷冻干燥机,北京亚泰科隆仪器技术有限公司;电泳仪,美国伯乐BIO-RAD公司;UV-3200型分光光度计,上海美谱达仪器有限分司;Discovery DHR-2型流变仪,美国TA仪器;TGL-10C型高速台式离心机,上海安亭科学仪器厂;G80F20CN2L-B8(RO)型微波炉,格兰仕微波炉电器制造有限分司。
1.2 实验方法
1.2.1 SPI的制备
大豆蛋白与蒸馏水按质量比1∶10混合,室温下低速搅拌2h,搅拌过程用1 mol/L NaOH保持pH 8.5。混合液经8 000×g离心30 min除去不溶物,上清液用2 mol/L HCl调节pH值至4.5,溶液经5 000×g离心15 min,去除上清液,收集蛋白质凝乳,凝乳经蒸馏水冲洗2~3次后,加入蒸馏水,用1 mol/L NaOH调节溶液pH至7.0,搅拌,待沉淀充分溶解后经8 000×g离心30 min除去不溶物,上清液冷冻干燥[9]。
1.2.2 样品的制备
称取等质量的SPI与乳糖置于研钵中研磨,混合均匀后过150目筛,收集筛出物。SPI-乳糖混合物(水分含量为7.2%)在800W微波功率下加热不同时间(30、60、90、120、150、180 s),冰水浴结束反应。不同样品配成50 mL溶液,4℃透析2 d,再将溶液稀释至100 mL,离心(3 000×g)除去不溶物,取10 mL混合物样品置于冰箱保存,其余样品冻干制成干粉。
1.2.3 聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
采用SDS-PAGE测定大豆分离蛋白和不同微波条件处理 SPI-乳糖接枝物的亚基组成和分子质量[10]。SDS-PAGE采用12%的分离胶和5%的浓缩胶制备而成,电泳前,所有样品均煮沸6~8 min,进样量10 μL,恒压,浓缩胶电压 50V/板,分离胶 110V/板,考马斯亮蓝R-250染色,7%醋酸脱色。
1.2.4 自由氨基的测定
采用OPA法对蛋白质中自由氨基进行测定,在文献[11-12]方法的基础上进行改进:准确称取40 mg OPA溶解于1 mL的甲醇中,依次加入0.2 g/mL SDS 2.5 mL,0.1 mol/L 的硼砂25 mL 及 100μL β-巯基乙醇,最后用蒸馏水定容至50 mL。空白液不加OPA。测定时,各取空白液、OPA试剂4 mL于试管中,分别注入200 μL样品溶液,混匀后于35℃反应2 min,340 nm下测其吸光值A340。以赖氨酸作出标准曲线,根据标准曲线计算样品中自由氨基的含量。
1.2.5 流变学分析
配制浓度为0.1 g/mL的样品溶液,利用Discovery DHR-2型流变仪测定溶液的流变特性。DHR-2型流变仪,40mm直径,2°的平行板,间隙为1mm,目标应变(target strain)保持0.5%(此应变在线性黏弹区域内)。所有流变学性质测定均重复2次。
1.2.5.1 频率扫描分析
取2 mL样品放置在平行板上,扫描频率在0.1~10Hz,记录储能模量(storage moduli,G')和损耗模量(loss moduli,G")的变化[13],并分析样品相对黏弹性tanδ(tanδ=G"/G')随频率的变化情况。加样前将平板的的温度调至25℃,实验时保持温度不变。
1.2.5.2 动态黏弹性分析
取2 mL样品放置在平行板上,为了防止水分蒸发,在样品裸露部位覆盖一层硅油。测量时,振荡频率1Hz。样品在25℃平衡1 min,随后温度以5℃/min的速率从25℃升到95℃,并在95℃保持10 min。再以5℃/min的速率从95℃下降到25℃[14]。记录此过程样品的G'随时间的变化。
2 结果与讨论
2.1 SDS-PAGE
图1为SPI和800W不同时间微波加热SPI-乳糖接枝物电泳图。由图1可知,微波加热时间较短(0、30 s)时,电泳条带变化不明显,随微波时间延长,SPI-乳糖接枝物的条带向上移动,这表明蛋白分子质量增加。蛋白质与糖反应时,蛋白中的自由氨基和糖的还原性末端共价结合和蛋白分子之间发生聚集[15-16],导致SPI-乳糖共聚物分子质量增加。当微波处理时间达到90 s后,随处理时间增加,大豆球蛋白(11S)中的碱性亚基B变得越来越模糊,这可能是碱性亚基B最不稳定,最易发生聚合过度加热会使蛋白质中小分子基团发生聚集;微波加热后,电泳图谱中分子质量在30~70kDa之间出现了新条带,这些亚基可能是由于蛋白-蛋白/蛋白-糖形成新的聚合物[13]。
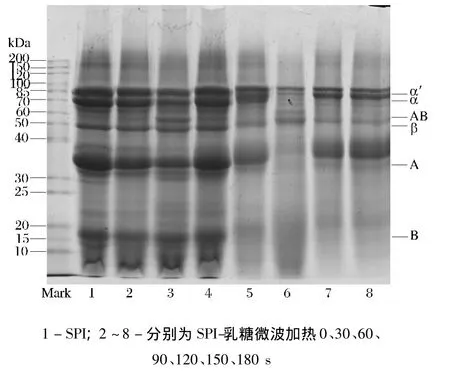
图1 SPI和MH不同时间SPI-乳糖接枝物电泳图谱Fig.1 SDS-PAGE profile of SPI and SPI-lactose graft under different MH time
2.2 自由氨基含量变化
糖基化过程中,蛋白中伯胺基基团呈现出高的活性,因此,糖化的自由氨基数量可以作为评价糖基化反应程度的标准[8]。图2为800W微波不同时间接枝物自由氨基含量的变化图,由图2可知,随微波时间的延长,SPI中自由氨基含量明显减少。因为在同功率下,微波时间越长,温度越高,高温导致大豆蛋白降解,变性,并重新发生聚集,变性的蛋白质与糖的还原性末端发生羰氨缩合反应,这与SDS-PAGE结论一致。同时,当处理时间超过150 s时,样品明显逐渐变黑,可能是高温导致样品发生炭化。
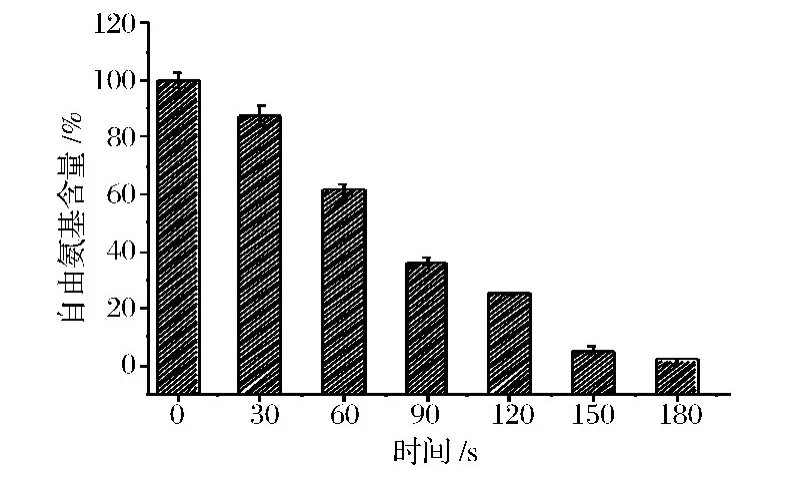
图2 MH不同时间SPI-乳糖接枝物自由氨基含量的变化Fig.2 Changes in free amino group content of SPI-lactose graft under different MH time
2.3 频率扫描分析
由图3可见,原样SPI和经微波糖基化处理后的SPI溶液的G'和G"均随频率的增大而升高,样品黏弹性均有所增强;图4可知,SPI-乳糖接枝物溶液tanδ比原样SPI小,这表明未处理的SPI更具有黏性,而经过微波糖基化后SPI样品呈现出更大的弹性。SPI经微波糖基化处理后,会增强SPI分子间/SPI和乳糖分子间相互作用,从而增强SPI分子间非共价键(氢键)和 SPI-糖分子间的共价结合[3],因而 SPI-乳糖接枝物弹性增强。

图3 SPI和MH 120 s SPI-乳糖接枝物G'和G"随频率变化图Fig.3 G'and G"as a function of oscillation frequency of SPI and SPI-Lactose graft after after MH 120 s
2.4 动态黏弹性分析
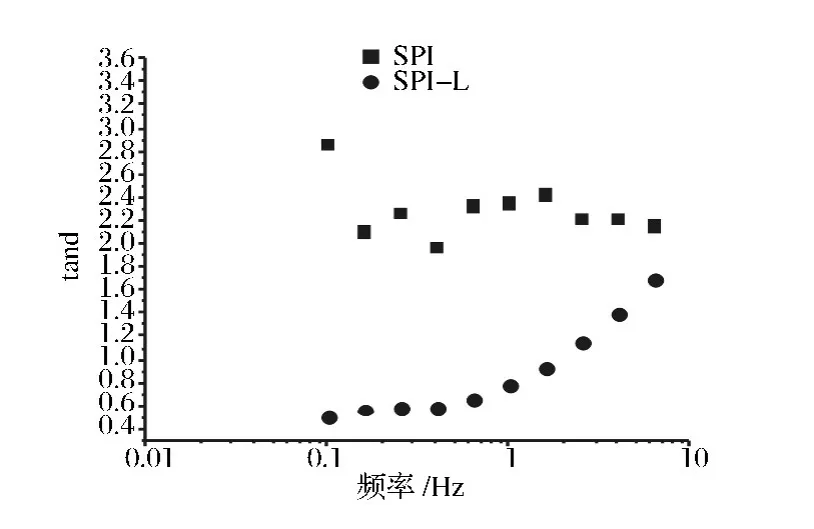
图4 SPI和MH 120 s SPI-乳糖接枝物相对黏弹性(tanδ)随频度变化图Fig.4 tanδ as a function of oscillation frequency of SPI and SPI-Lactose graft MH 120 s
由图5可知,热循环处理过程中,原样SPI溶液G'在升温和恒温无明显变化,在降温阶段显著增加;而经微波糖化处理后的样品G'随温度变化不明显。图5局部放大图所示,在升温阶段原样和微波糖化后的样品G'均略有下降;恒温阶段原样G'略有升高,微波糖化后G'略有下降;降温阶段两者G'均增加,并且原样增加更显著。原因可能是,在升温阶段,随温度的升高,样品中的氢键稳定性降低[17],氢键的断裂将会导致G'减少。在此阶段,经微波处理后的接枝物样品G'较原样SPI大,可能是因为经过微波糖化处理后存在多肽链间或/和多肽与糖分子间的相互作用,因而SPI-乳糖接枝物弹性增大;在95℃恒温阶段,原样SPI溶液G'随时间的延长有所提高,而SPI-乳糖接枝物溶液G'略有下降,且SPI溶液G'较大。可能是由于温度升高时,蛋白溶液疏水作用更稳定,蛋白溶液G'增强。而SPI经微波糖基化作用后可能会减弱疏水作用或减少疏水基团,改性后的蛋白质在热变性时将会抑制较远的区域形成疏水作用。SPI经微波糖化减弱疏水作用与溶液温度升高稳定疏水作用共同影响导致改性后溶液G'略有下降;在降温阶段,G'均增加,原样SPI溶液增加更显著,在热循环结束阶段,原样SPI溶液G'最大。可能是因为温度降低,氢键的稳定性增强,SPI经微波糖基化修饰后,蛋白质发生变性,导致热循环过程中降低了形成氢键的能力[13]。
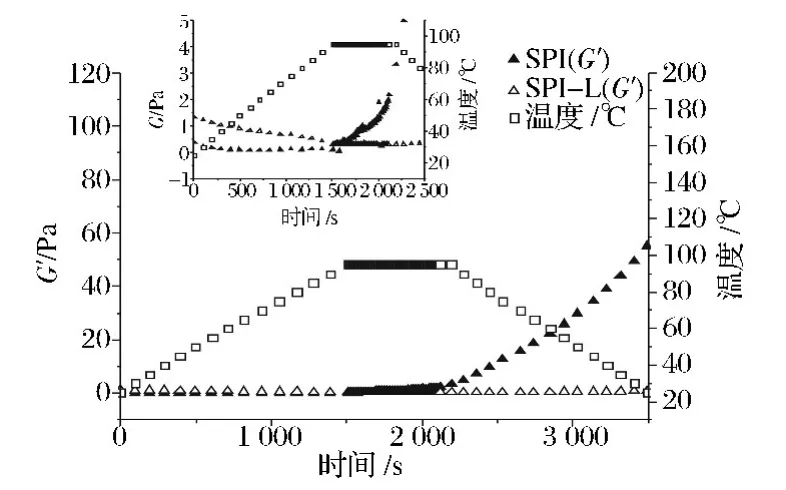
图5 SPI和MH 120 s SPI-乳糖接枝物随时间动态模量的变化Fig.5 Dynamic moduli as a function of time of SPI and SPI-Lactose graft after MH 120 s
3 结论
综上分析,800W微波处理条件下,SPI与乳糖发生糖基化反应,并随微波时间的延长,蛋白质的分子质量逐渐增加,且在30~70 kDa出现了新条带,在加热处理90 s后,11 s中的B条带变淡甚至消失;随着微波处理时间的延长,SPI中自由氨基含量减少;同时,样品的流变性质也发生了变化,SPI-乳糖接枝物相对黏弹性(tanδ)降低 ,呈现出更大的弹性,表明蛋白质分子间及蛋白-糖分子间相互作用增强。热循环处理时,糖基化SPI溶液G'随温度变化不明显,而原样SPI溶液G'在降温阶段明显增大,可为具有热加工稳定性的新型大豆分离蛋白的研发提供新途径。
[1] 周宇英,唐伟强.食品流变特性研究的进展[J].粮油加工与食品机械,2001(8):7-9.
[2] 田少君,雷继鹏,孙阿鑫.大豆蛋白的流变特性及其粘度的数学模型研究[J].中国粮油学报,2005,20(2):53-56.
[3] HU H,WU J,LI-CHAN E C,et al.Effects of ultrasound on structural and physical properties of soy protein isolate(spi)dispersions[J].Food Hydrocolloids,2013,30(2):647-655.
[4] LIU H H,KUO M I.Effect of microwave heating on the viscoelastic property and microstructure of soy protein isolate gel[J].Journal of Texture Studies,2011,42(1):1-9.
[5] GUAN J-J,QIU A-Y,LIU X-Y,et al.Microwave improvement of soy protein isolate-saccharide graft reactions[J].Food Chemistry,2006,97(4):577-585.
[6] GUAN J-J,ZHANG T-B,HUI M,et al.Mechanism of microwave-accelerated soy protein isolate-saccharide graft reactions[J].Food Research International,2011,44(9):2 647-2 654.
[7] Mei ner K,Erbersdobler H F.Maillard reaction in microwave cooking:Comparison of early maillard products in conventionally and microwave-heated milk[J].Journal of the Science of Food and Agriculture,1996,70(3):307-310.
[8] Tsubokuba Y,Fukuzaki S,Noma S,et al.Glycation of ovalbumin in solid-state by conductive and microwave heating[J].Food Science and Technology Research,2009,15(4):377-380.
[9] HUA Y,CUI S W,WANG Q,et al.Heat induced gelling properties of soy protein isolates prepared from different defatted soybean flours[J].Food Research International,2005,38(4):377-385.
[10] Petruccelli S A N M.Relationship between the method of obtention and the structural and functional properties of soy proteins isolates.1.Structural and hydration properties[J].Journal of Agricultural and Food Chemistry,1994,42(10):2 161-2 169.
[11] Chevalier F,Chobert J-M,Popineau Y,et al.Improvement of functional properties of β-lactoglobulin glycated through the maillard reaction is related to the nature of the sugar[J].International Dairy Journal,2001,11(3):145-152.
[12] Brands C M,V B M A.Kinetic modelling of reactions in heated disaccharide-casein systems[J].Food Chemistry,2003,83(1):13-26.
[13] Speroni F,Beaumal V,De Lamballerie M,et al.Gelation of soybean proteins induced by sequential high-pressure and thermal treatments[J].Food Hydrocolloids,2009,23(5):1433-1442.
[14] Ikeda S.Heat-induced gelation of whey proteins observed by rheology,atomic force microscopy,and raman scattering spectroscopy[J].Food Hydrocolloids,2003,17(4):399-406.
[15] TU Z C,HU Y M,WANG H,et al.Microwave heating enhances antioxidant and emulsifying activities of ovalbumin glycated with glucose in solid-state[J].Journal of Food Science and Technology,2013:1-9.
[16] Sun Y,Hayakawa S,Izumori K.Modification of ovalbumin with a rare ketohexose through the maillard reaction:Effect on protein structure and gel properties[J].Journal of Agricultural and Food Chemistry,2004,52(5):1 293-1 299.
[17] Boonyaratanakornkit B B,Park C B,Clark D S.Pressure effects on intra-and intermolecular interactions within proteins[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,2002,1 595(1):235-249.
