1株具有抑制乙酰胆碱酯酶活性的牡蛎共生真菌的鉴定及发酵条件的优化*
2014-12-16王凤舞孟丽媛
王凤舞,孟丽媛
(青岛农业大学食品科学与工程学院,山东青岛,266109)
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的老年性脑神经退行性病变,发病率较高,已成为现代社会严重威胁老年人生命的疾病之一[1]。关于AD病理较为接受的为“胆碱能缺失学说”,认为大脑内神经递质——乙酰胆碱的缺失是导致 AD的关键原因[2-3],目前AD的治疗临床上主要是采用乙酰胆碱酯酶抑制剂,如他克林、加兰他敏、石杉碱甲等,这些药物可以提高患者体内的乙酰胆碱的水平,具有一定的疗效,但是化学药物副作用比较明显,不利于患者长期服用。
目前如何从天然产物中寻找并开发抗AD药物成为研究人员关注的新焦点[4]。其中特境微生物——共(内)生菌作为新的药物来源已经显示出巨大的开发潜力。共(内)生菌是指寄生于宿主体内并且不引起宿主致病症状的一类微生物,在与宿主长期共进化的过程中进行了“基因重组”,因而能产生丰富的活性次生代谢产物[5]。
牡蛎,又名蚝,营养丰富,含有大量的蛋白质、维生素、牛磺酸等营养成分及多种功能活性成分,具有很好的强肝解毒、抗癌、滋容养颜,延缓衰老的功效,长期食用可以预防老年痴呆[6]。基于内共生理论,牡蛎共生菌产生抗老年痴呆活性成分的可能性极大。在前期的试验中,本课题组已从牡蛎中分离筛选获得1株共生真菌WFW mL4,其液态发酵产物具有较好的抑制乙酰胆碱酯酶(AChE)的活性。本论文拟对该菌株进行菌种的鉴定,并对其进行发酵条件的优化,促进有益成分大量产生,为天然抗老年痴呆先导化合物的研究提供依据。
1 材料与方法
1.1 试验材料
菌株:牡蛎(青岛海域)中分离得到的共生真菌WFW mL4。
斜面培养基:葡萄糖2%,马铃薯20%,琼脂2.0%,海水加热溶解。
种子液培养基:2.0%蔗糖,马铃薯浸汁加热溶解,分装灭菌。
察氏培养基:3.0% 蔗糖,0.3%NaNO3,0.05%KCl,0.05%MgSO4·7H2O,0.001%FeSO4,0.01%K2HPO4,0.1% 酵母膏,海水加热溶解。
PD培养基:2.0%葡萄糖,马铃薯浸汁加热溶解,分装灭菌。
PS培养基:2.0%蔗糖,马铃薯浸汁加热溶解,分装灭菌。
SP 培养基:蔗糖2.0 g,KH2PO40.3g,MgSO4·7H2O 0.15 g,VB11 mg,马铃薯浸汁100 mL 加热溶解,分装灭菌。
SP’培养基:蔗糖 2.0 g,KH2PO40.3g,MgSO4·7H2O 0.15 g,VB11 mg,pH 6.0,马铃薯蒸馏水浸汁 100 mL加热溶解,分装灭菌。
试剂:十二烷基磺酸钠SDS,乙酰胆碱酯酶,乙酰胆碱碘代物AchI,3,5-二硫二硝基苯甲酸DTNB,他克林,sigma;乙酸乙酯,天津富宇精细化工;SK8229真菌基因组DNA快速抽提试剂盒,上海生工生物工程有限公司;琼脂糖凝胶回收试剂盒;Omega公司。
1.2 仪器与设备
全自动电热压力蒸汽灭菌锅YXQ-LS-SⅡ,上海博讯实业有限公司;恒温振荡器IS-RDH1,苏州麦可旺志生物技术有限公司;DHP-9032电热恒温培养箱,中国龙口市先科仪器有限公司;IS-RDV3立式恒温振荡器,美国精骐有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;冷冻干燥机FD-1D-80,北京博医康实验仪器有限公司;DU-800紫外/可见分光光度计,美国贝克曼公司;PCR反应扩增仪,加拿大BBI公司;3730测序列分析仪,美国 ABI公司;TGL-16M型高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;超净工作台SW-CJ-1F,苏州安泰空气技术有限公司;电子分析天平,美国奥豪斯电子天平公司。
1.3 实验方法
1.3.1 WFW mL4 菌株鉴定
1.3.1.1 WFW mL4 菌株形态鉴定
将保藏的菌种于PDA平板中培养,观察菌落形态特征及子囊孢子特征。菌落特征主要包括菌落的形状、大小、颜色、表面状况、质地、光泽等。在显微镜下观察菌丝体的形态及子囊果和子囊孢子的形态等[7-9]。
1.3.1.2 WFW mL4 菌株分子生物学鉴定
菌株分子生物学鉴定通过测定该真菌的18S rDNA序列进行种属鉴定[10]。
(1)基因组提取及电泳检测
①基因组提取:按照生工SK1375真菌基因组DNA抽提试剂盒说明书提取。
②PCR反应:
引物序列:
NS15’ GTAGTCATATGCTTGTCTC 3’
NS65’ GCATCACAGACCTGTTATTGCCTC 3’
PCR扩增程序:
模版,1 μL;引物 NS1,NS6,各 1 μL;Taq 酶,1 μL;Buffer,5 μL;dNTP,4 μL;无菌水,37 μL;共计50 μL。
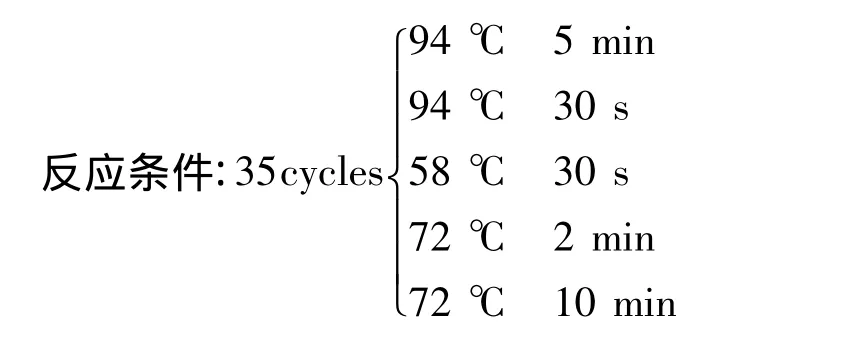
③PCR产物电泳:1.2%琼脂糖电泳检测。
(2)DNA琼脂糖切胶回收纯化:采用Omega回收试剂盒。
(3)目的片段TA连接
在微量离心管中加入 1 μL PEASY-T1溶液,4 μL DNA溶液。30℃反应5 min。取出Top10感受态细胞在冰上融化。将反应液加入到感受态细胞中。冰浴30 min。42℃热激30 s,冰浴3 min以上。加入灭菌的LB液体培养基300 μL,在37℃摇床200 r/min,40 min。取出离心管,8 000 r/min离心数秒,吸取200 μL,上清液弃掉。余下的重悬涂 LB平板(Amp)。选用蓝白斑筛选,37℃恒温过夜培养。次日挑取白色单菌落在加Amp的液体LB培养基摇床7h,送测序公司测序。
(4)DNA测序
由上海生工生物工程技术服务有限公司测序。
(5)系统进化树的构建及分析
将测定的该菌株的18S rDNA基因序列通过BLAST软件将该序列与基因库中相关序列进行比对并进行同源性比较,进而确定菌株的分类。利用MEGA4.0软件中的邻接法(neighbour-joining method,NJ)[11],将相关性最高的菌株同 WFW mL4 菌株一同构建系统进化树。
1.3.2 菌株WFW mL4液体发酵条件的优化
1.3.2.1 不同培养基对菌株WFW mL4次生代谢产物AChE抑制率的影响
分别选取察氏培养基、PD培养基、PS培养基、SP培养基、SP’培养基作为该菌发酵培养基,固定接种量10%,500 mL三角瓶装液量150 mL,在28℃发酵10 d。所得发酵液经乙酸乙酯萃取后,配制成5 mg/mL浓度,测定其AChE抑制率。选取最适合该菌的发酵培养基,每种处理3个重复。
1.3.2.2 装液量对菌株 WFW mL4次生代谢产物AChE抑制率的影响
固定其他条件不变,500 mL三角瓶装液量分别为 50、100、150、200 和250 mL,测定 5 mg/mL 发酵液提取物抑制AChE活性,选择最适发酵装液量。每种处理3个重复。
1.3.2.3 发酵温度对菌株WFW mL4次生代谢产物AChE抑制率的影响
以SP培养基为发酵培养基,培养温度分别选取19、22、25、28 和31 ℃,固定其他条件不变,测定代谢产物的AChE抑制率。选取最适合该菌的发酵温度,每种处理3个重复。
1.3.2.4 发酵时间对菌株WFW mL4次生代谢产物AChE抑制率的影响
固定其他条件不变,发酵时间分别为6、8、10、12和14 d。制备发酵液乙酸乙酯相浸膏,配制成5 mg/mL浓度,测定其 AChE抑制率。选取适合该菌产生AChE抑制物的最佳发酵条件。每种处理3个重复。
1.3.2.5 培养基初始pH值对菌株WFW mL4次生代谢产物AChE抑制率的影响
固定其他条件不变,将培养基的初始pH分别调到 4.0、5.0、6.0、7.0、8.0,测定 5 mg/mL 发酵液提取物抑制AChE活性,选取最适合该菌产生AChE抑制物的发酵培养基pH。每种处理3个重复。
1.3.2.6 接种量对菌株 WFW mL4次生代谢产物AChE抑制率的影响
固定其他条件不变,接种量分别为1%、5%、10%、15%和20%,测定5 mg/mL发酵液提取物抑制AChE活性,选取最适接种量。每种处理3个重复。
1.3.2.7 光照时间对菌株WFW mL4次生代谢产物AChE抑制率的影响
固定其他条件不变,接种后先避光,后见光培养,见光培养时间分别选取 0、2、4、6、8 d,总发酵时间为10 d。测定5 mg/mL发酵液提取物抑制AChE活性,选取最适的光照时间。每种处理3个重复。
1.3.3 乙酰胆碱酯酶抑制活性的测定
抑制AChE活性测定参照改良Ellman法[12]。取4支10 mL的试管(1~4)分别标注为空白、对照、样品、本底放于37℃的恒温水浴中,向这4支试管中分别添加 pH=8.0 磷酸缓冲液(2 950 μL、2 880 μL、2 880 μL、2 950 μL)、乙酰胆碱碘代物20 μL、显色剂DTNB 100 μL;然后向1、2号试管中各加入 DMSO 100 μL,3、4 号试管中各加入待测样品溶液 100 μL,2、3号试管中再各加入70 μL的乙酰胆碱酯酶后混匀、在水浴中反应4 min 20 s后再向各试管中分别添加40%的SDS终止剂100 μL终止反应;最后在412 nm下测其OD值,通过计算公式计算出样品对乙酰胆碱酯酶的抑制率[13]:

2 结果与分析
2.1 菌株WFW mL4鉴定结果
2.1.1 菌株WFW mL4形态学特征
菌株WFW mL4的形态学特征如图1所示。该菌为丝状真菌,在PDA培养基平板上快速生长,形成白色疏松绒毛状菌落。菌丝为白色,有分枝和横隔。当该菌接种到PDA培养基上7 d后,在菌落中心逐渐出现黄色颗粒,该黄色颗粒为未成熟的子囊果;10 d后,子囊果成熟变成黑色。子囊果的外周被橄榄色或者黄绿色的附属丝包围着。子囊孢子是浅棕色,柠檬状。菌株WFW mL4的形态学特征和文献中报道的球毛壳菌的形态学特征相符合[8]。

图1 菌株WFW mL4的形态学特征Fig.1 Morphological features of strain WFW mL4
2.1.2 WFW mL4菌株分子生物学鉴定

图2 PCR产物电泳图谱Fig.2 The electrophoretogram of PCR product
图2为菌株WFW mL4的18S rDNA的PCR产物电泳图,可以看出,菌株WFW mL4的18S rDNA片段长度在1 000~2 000 bp之间。菌株WFW mL4的18S rDNA序列长度为1 691bp,与电泳结果一致。该核酸序列已被加载到 GenBank中,登陆号为JQ964323。利用BLAST软件将该序列与美国生物信息中心(NCBI)进行比对分析,结果表明:菌株WFW mL4的18S rDNA与球毛壳菌的相似度高达99%,参考菌株的 GenBank登录号 DQ234257,AY545725,JQ686920,JN639019 和 AB048285,同 时,利 用MEGA4.0软件构建该菌株的系统发育树(图3)。
通过菌株WFW mL4的形态学特征和18S rDNA序列,可以确定该菌株为球毛壳菌(Chaetomium globosum)。该菌种已被保存到中国普通微生物菌种保藏管理中心,菌种编号为CGMCC NO.6571。
2.2 菌株C.globosum WFW mL4液体发酵条件的优化
2.2.1 不同培养基对菌株 C.globosum WFW mL4发酵液提取物AChE抑制率的影响

图3 菌株WFW mL4的系统发育树Fig.3 Phylogenetic tree of strain WFW mL4
本实验研究了5种发酵培养基对菌株C.globosum WFW mL4次生代谢物AChE抑制率的影响。如图4所示,柱状图上不同字母表示差异显著,由此可以看出:5种培养基对于该菌发酵液粗浸膏的AChE抑制率影响显著(P<0.05)。采用SP培养基发酵获得的粗浸膏对 AChE抑制率最大,为(47.19±0.76%)%。SP培养基是最适合该菌液体发酵的培养基。SP与SP’培养基的区别是前者采用海水配制,后者采用蒸馏水配制。从图中可以看出,用SP培养基发酵获得的粗浸膏的AChE抑制率明显高于SP’,这说明了海水环境对于C.globosum WFW mL4发酵产生抑制AChE活性的次生代谢产物是必需的。这可能是由于海水造成的高盐、高压环境对海洋真菌C.globosum WFW mL4次生代谢途径的影响,从而影响其次生代谢产物的产生[14]。
2.2.2 装液量对菌株 C.globosum WFW mL4次生代谢产物的影响
装液量是间接评价溶氧量对发酵代谢影响的指标。由图5可以看出,随着装液量的增加,发酵液提取物对AChE的抑制率呈现先增大后减小的趋势。当500 mL三角瓶装液量为200 mL时,发酵液提取物对AChE的抑制率达到最大值,为(68.07±3.23)%,这说明C.globosum WFW mL4菌株在液体发酵的过程中是需要氧气的。因此,确定C.globosum WFW mL4菌株液体发酵500 mL三角瓶的最佳装液量为200 mL。
2.2.3 发酵温度对菌株 C.globosum WFW mL4次生代谢产物的影响

图4 不同培养基对粗浸膏的AChE抑制率的影响Fig.4 Effect of medium on the AChE inhibition rate of crude residue

图5 装液量对发酵液提取物AChE抑制率的影响Fig.5 Effect of culture volume on inhibition ratio of AChE

图6 发酵温度对粗浸膏质量和AChE抑制率的影响Fig.6 Impact of fermentation temperature on the AChE inhibition rate and weight of crude residue
由图6可以看出,温度对发酵液粗浸膏AChE抑制率的影响较小,说明菌株C.globosum WFW mL4的适应温度范围较宽。菌株的适应发酵温度可能与其宿主有关,有研究表明牡蛎生长的最佳水温为22℃,其摄食和代谢的水温在18~28℃处于较适宜水平[15]。当发酵温度低于22℃时,随着发酵温度的升高,该菌株发酵液粗浸膏的质量以及其对AChE的抑制率均随之增大,当达到22~28℃时,发酵液粗浸膏质量变化趋势不明显,在25℃时达到最大值,其粗浸膏质量为(166.25 ± 8.71)mg,AChE 抑制率为(65.69 ±1.69)%。当发酵温度继续升高时,发酵液粗浸膏质量及其AChE抑制率均下降,说明温度过高会抑制菌株AChE活性代谢产物的合成和分泌。因此,确定该菌株液体发酵的最佳温度为25℃。
2.2.4 发酵时间对菌株 C.globosum WFW mL4次生代谢产物的影响

图7 发酵时间对粗浸膏质量和AChE抑制率的影响Fig.7 Effect of fermentation time on the AChE inhibition rate and weight of crude residue
在真菌液体发酵过程中,其次级活性代谢产物的产生时间有所不同。由图7可以看出,在发酵初期,随着发酵时间的延长,发酵液粗浸膏质量及其对AChE活性抑制率逐渐升高,到第10天时,发酵液粗浸膏质量达到最大值(154.7 ± 19.8)mg,此时其AChE抑制率为(67.43±1.30)%。当发酵时间继续延长时,发酵液粗浸膏质量开始下降,其对AChE抑制率增长不明显。这是因为在发酵初期菌丝体初级代谢为主,次生代谢为辅,进行大量生长增殖,产生的少量次生代谢产物并未及时排出细胞外;到发酵中后期以次级代谢为主,开始产生大量次生代谢产物并排出细胞外;到发酵后期,培养基的营养物质已被消耗尽,部分菌丝体自溶,培养基粘度增大影响氧气传递速率,影响次生代谢产物的产生或者影响次生代谢途径[16]。因此,确定 C.globosum WFW mL4菌株最佳液体发酵时间为10 d。
2.2.5 培养基初始 pH对菌株 C.globosum WFW mL4次生代谢产物的影响
培养基的初始pH值对菌株的生长和代谢有直接影响,初始pH值应使菌株快速生长并且有利于代谢产物的产生[16]。在图8中,发酵液粗浸膏质量和AChE抑制率的变化趋势较明显,表明发酵液的初始pH对C.globosum WFW mL4菌株产抑制AChE活性代谢物的影响显著。该菌在pH=6.0时发酵液粗浸膏质量以及其对AChE抑制率达到最大值,即粗浸膏质量为(165.55 ± 8.15)mg,AChE 抑制率为(65.61±0.98)%。原因可能是该菌的生长环境pH对该菌的次生代谢产物产生具有激发作用。因此该菌的最适发酵培养基的pH为6.0。

图8 pH值对粗浸膏质量和AChE抑制率的影响Fig.8 Effect of incubation pH value on the AChE inhibition rate and weight of crude residue
2.2.6 接种量对菌株 C.globosum WFW mL4次生代谢产物的影响
接种量的多少可影响液体发酵过程中菌丝体的生长速度及其代谢产物的产量。由图9可以看出,接种量从1%到10%,随着接种量的增加,该菌株发酵液粗浸膏质量及其AChE抑制率均随之增强,当接种量达到10%时,发酵液粗浸膏质量及其AChE抑制率达到最大值,分别为(158.15 ±8.71)mg,(68.45 ±1.03)%。接种量继续增大时,发酵液粗浸膏质量及其对AChE的抑制率均出现下降趋势。原因可能为接种量过大,引入的抑制次生代谢的有害物质相应增多,对产物的合成不利,或者菌丝体在发酵前期生长过于旺盛,空间和资源相对匮乏,培养基中的营养成分被大量消耗,进而影响发酵后期代谢产物的形成和分泌[16]。因此,确定 C.globosum WFW mL4菌株液体发酵的最佳接种量为10%。

图9 接种量对粗浸膏质量和AChE抑制率的影响Fig.9 Effect of inoculum concentration on the AChE inhibition rate and weight of crude residue
2.2.7 光照时间对菌株 C.globosum WFW mL4次生代谢产物的影响
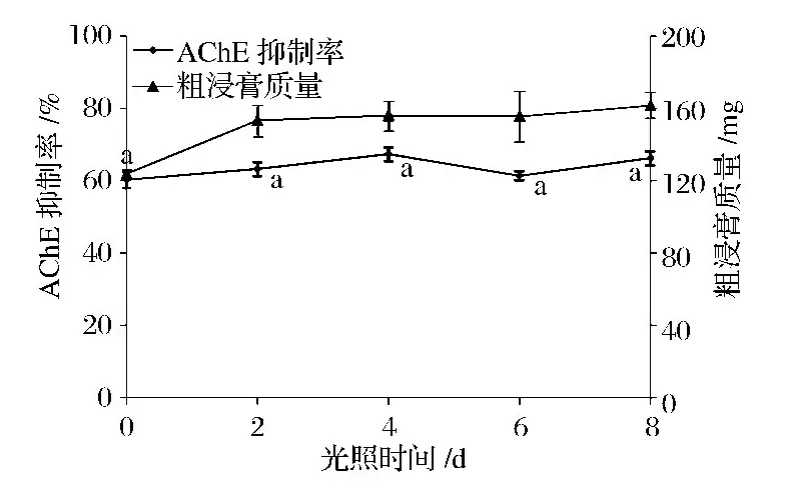
图10 光照时间对粗浸膏质量和AChE抑制率的影响Fig.1 0 Effect of light period on the AChE inhibition rate and weight of crude residue
由图10可知,随着光照时间的变化,发酵液粗浸膏质量和AChE抑制率并未呈现规律性趋势,说明光照时间对C.globosum WFW mL4菌株发酵液粗浸膏质量和AChE抑制率几乎无影响或者影响不大。
3 结论
(1)经形态学及分子生物学鉴定,可确定WFW mL4菌为球毛壳菌,命名为 Chaetomium globosum WFW mL4。
(2)从发酵优化实验结果可以看出:该菌最适发酵培养基为SP培养基,并且该菌株只在海水环境下代谢产生AChE抑制物;培养基的初始pH对该菌株产AChE代谢产物的影响显著,其最适培养基pH为6.0;发酵的最佳接种量为10%,500 mL三角瓶的最佳装液量为200 mL,最适的发酵温度和时间分别为25℃和10 d,光照时间对该菌株发酵几乎无影响。
[1] Snokusare S K,Kaul C L,Ramarao P.Demential of Alzheimer’s disease and other neurodegenerative disordersmemantine,a new hope pharmacological[J].Pharmacological Research,2005,51(1):1-17.
[2] DeKosky S T,Scheff S W.Synapse loss in frontal cortex biopsies in Alzheimer's disease:Correlation with cognitive severity[J].Annals of Neurology,1990,27(5):457-464.
[3] Terry R D,Masliah E,Salmon D P,et al.Physical basis of cognitive alterations in alzheimer's disease:Synapse loss is the major correlate of cognitive impairment[J].Annals of Neurology,1991,30(4):572-580.
[4] Lleo A,Greenberg S M,Growdon J H.Current pharmacotherapy for alzheimer’s disease[J].Annual Review of Medicine,2006,57:513-533.
[5] 黎万奎,胡之璧.内生菌和天然药物[J].中国天然药物,2005,3(4):193-199.
[6] 李超柱,潘珍凤,陈艳辉,等.牡蛎软体活性物质的研究进展[J].食品工业科技,2012,33(8):412-415.
[7] 于丽波.三株深海来源微生物的菌种鉴定及其生物活性的初步评价[D].厦门:国家海洋局第三海洋研究所,2011.
[8] WANG Y,XU L,REN W.Bioactive metabolites from Chaetomium globosum L18,an endophytic fungus in the medicinal plant Curcuma wenyujin[J].Phytomedicine,2012,19(3):364-368.
[9] 康曼.一株丝状真菌的分类鉴定[J].广东农业科学,2011,38(18):52-54.
[10] 江胜滔.虾青素产生菌的筛选鉴定及其转化子的研究[D].福州:福建师范大学,2005.
[11] Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution Tempe,2007,24(8):1 596-1 599.
[12] Ellman G L,Courtney K D,Featherstone R M,et al.A new and rapid colorimetric determination of acetylcholinesterase activity[J]. BiochemicalPharmacology,1961,7(2):88-95.
[13] 董玉洁,朴美子,王懋存,等.长岛海洋生物内生真菌的分离及抗老年痴呆活性筛选[J].中国食品学报,2012,12(4):43-47.
[14] 杨道茂,欧阳明安,刘建福,等.海洋真菌的分离研究[J].云南大学学报(自然科学版),2004,26(6A):79-81.
[15] 廖文崇,朱长波,张汉华,等.水温对香港巨牡蛎摄食和代谢的影响[J].广东农业科学,2011,38(1):7-11.
[16] 王广慧,戴明,魏雅冬.真菌液态发酵产漆酶的培养条件优化研究进展[J].食品工业,2012,33(4):130-134.
