不同烘焙温度下核桃壳挥发性成分分析*
2014-12-16吴恒吴雨松刘劲芸徐世涛张虹娟阴耕云
吴恒,吴雨松,刘劲芸,徐世涛,张虹娟,阴耕云
(云南中烟新材料科技有限公司,云南昆明,650106)
核桃壳是核桃取仁后的副产物,数据显示,2008年中国核桃年总产量为8.3×105t,按取仁率55%计算,中国每年产生核桃壳高达3.735×105t。核桃壳质地坚硬,在加工核桃仁的过程中作为废弃物弃掉或焚烧,不仅利用价值低还会造成资源浪费和环境污染[1-2]。为了加强对核桃壳资源的充分利用,生产高附加值的产品,在核桃壳的应用研究方面国内外学者也做了大量研究,主要集中于制造活性炭[3-4]、提取棕色素[5-6]、抗氧化剂[7]、抗聚剂[8],过滤器中的滤料[9-10]、堵漏材料[11],加工有机稀释肥等[12]。然而,目前仍没有核桃壳烘培处理后作为食品添加剂应用方面的研究。核桃壳经烘培处理后其提取物具有特殊的烘培香和坚果香香韵,这和烘焙过程中核桃壳内部的一些化学成分变化有着紧密的联系。在此,本研究结合气相色谱-质谱联用仪(GC-MS)对不同烘培温度下的核桃壳提取物挥发性成分进行分析和确定,以期了解核桃壳中的化学成分在不同烘焙温度下的变化情况,开拓核桃壳作为食品添加剂的新途径。
1 材料与方法
1.1 材料与试剂
材料:采用云南省漾濞县漾濞泡核桃(Juglans sigillata Dode)核桃壳,洗净、风干后粉碎成粉,过60目筛。
试剂:所用有机试剂都为分析纯,水为纯净水。
1.2 仪器
GC/Tof高分辨气质联用仪,美国Waters公司;R-210旋转蒸发仪,瑞士BUCHI公司;BP210S电子分析天平,德国赛多利斯有限公司;烘箱,德国Binder公司;高速中药粉碎机,兰溪市伟能达电器有限公司。
1.3 实验方法
1.3.1 仪器工作条件
气相色谱条件:PE-35MS色谱柱(30 m×0.32 mm ×0.25 μm),进样口温度为 250 ℃,载气为高纯He 气,流速为1.5 mL/min;进样量为1.0 μL,分流比为50∶1;升温程序:起始柱温为50℃,保持5 min,以10℃/min的速率升至200℃,保持10 min。
质谱条件:接口温度为220℃;离子源温度为220℃;电离方式为EI,电子能量为70 eV,质量扫描范围为40~400 u,溶剂延迟5 min。
1.3.2 样品制备
准确称取粉碎好的核桃壳100.0 g 5份。分别在100、120、140、160 ℃ 下烘烤 1 h。不烘烤的作为对照。用75%的乙醇于60℃热回流2次(2 h/次),料液比1∶5。回流完过滤、合并滤液,在120~130 kPa下真空浓缩至密度为0.9左右,得核桃壳提取物。经烘培后的提取物具有特殊的烘焙香和坚果香香韵,而对照不具有这些香韵特征。分别移取不同处理条件的提取物1 μL按1.3.1中的仪器工作条件进行进样分析。
2 结果与讨论
2.1 成分分析鉴定
在上述色谱条件下进样分析,获得不同烘焙温度下核桃壳提取物挥发性成分的总离子流色谱图(见图1~图5)。通过MassLynx V4.1化学工作站数据处理系统,在NIST2008、WILEY谱图库中检索,并结合相关文献确定其中的化学成分(见表1),定量分析按峰面积归一化法求得各化合物在挥发性成分中的相对百分含量。

图1 不烘焙核桃壳提取物挥发性成分总离子色谱图Fig.1 Total ions current chromatograms of walnut shell volatile components without baking

图2 100℃烘培1 h核桃壳提取物挥发性成分总离子色谱图Fig.2 Total ions current chromatograms of walnut shell volatile components with 100℃baking 1 h
图3 120℃烘培1 h核桃壳提取物挥发性成分总离子色谱图Fig.3 Total ions current chromatograms of walnut shell volatile components with 120℃baking 1 h

图4 140℃烘培1 h核桃壳提取物挥发性成分总离子色谱图Fig.4 Total ions current chromatograms of walnut shell volatile components with 140℃baking 1 h

图5 160℃烘培1 h核桃壳提取物挥发性成分总离子色谱图Fig.5 Total ions current chromatograms of walnut shell volatile components with 160℃baking 1 h

表1 不同烘培温度下核桃壳挥发性成分Table 1 Volatile compounds of walnut shell with different baking temperature

(续表1)
由表1可知,从总离子流色谱图中可以发现,不同烘焙温度下核桃壳提取物的挥发性成分有一定的差异性,随着烘焙温度的增加,检出的化合物也随之减少:从不烘焙、100、120、140和160℃烘焙1 h的核桃壳提取物中分别鉴定出了48、46、40、39和30个化合物,分别占其挥发成分总量的84.95%、82.75%、84.43%、88.50% 和 92.65%,且不同处理条件下的挥发性成分及含量差异性较大。分析表明在不同的烘焙温度下均含有愈创木酚、香兰素、香草酸、丁香醛、香草酸乙酯、4-羟基-2-甲氧基肉桂醇、4-羟基-2-甲氧基肉桂醛、3,5-二甲氧基-4-羟基肉桂醛等23个共有成分。在这23个共有成分中含有很多香料物质或合成香料物质的原料,其中一些主要香料成分的相对含量在烘焙后明显增加(图6所示),其中160℃烘焙后愈创木酚、香兰素、香草酸、丁香醛、4-羟基-2-甲氧基肉桂醛和3,5-二甲氧基-4-羟基肉桂醛的相对含量分别为1.97%、3.03%、5.08%、9.11%、31.42%和25.64%,而不烘焙时对应成分的相对含量分别为0.91%、1.66%、2.03%、0.62%、3.07% 和 1.59%。经160℃烘焙处理后这6个化合物总的相对含量占总挥发性成分的76.25%,而不烘焙只占9.88%,所以核桃壳经烘焙处理后其香味物质相对含量明显增加。另外,随着烘焙温度的升高一些成分在烘焙过程中挥发掉或发生其他化学反应没有被检出如戊醛、乙基麦芽酚等,有的成分相对含量逐渐降低直至不能被检出如顺13,16-二十二碳二烯酸、顺-7-十四烯醛、硬脂酸等。这是导致另外一些成分在烘焙后相对含量上升的主要原因;在烘焙过程中也有一些新的成分生成如3-糠醛、5-甲基糠醛和5-羟甲基糠醛等;有的化学成分发生转化如4-羟基-2-甲氧基肉桂醇在烘焙过程中发生氧化反应转化为4-羟基-2-甲氧基肉桂醛,并且随着温度的升高转化效率也增加,160℃烘焙1 h后转化完全。
2.2 核桃壳中主要挥发性成分作用
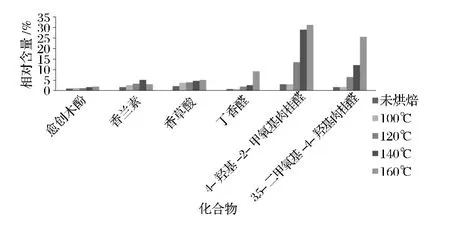
图6 烘焙过程中核桃壳主要香料物质变化情况Fig.6 The changes of main flavoring substances in walnut shell during baking process
核桃壳的挥发性成分中含有大量的天然香料或合成香料的原料,其中最主要的挥发性成分4-羟基-2-甲氧基肉桂醛是由4-羟基-2-甲氧基肉桂醇在烘焙过程中氧化所得,由肉桂醇类物质转化为肉桂醛类物质,研究表明肉桂醛类物质比肉桂醇类物质香气更加清强,同时,也有研究表明4-羟基-2-甲氧基肉桂醛也是香荚兰叶子和茎的主要芳香化学组分之一[13];愈创木酚又称愈创木酚甘油醚[14];香兰素又称香草醛,具有浓烈奶香气息,是一种广谱高档香料[15];丁香醛,具有浓郁的香气,是一种常用的食用香精[16];香草酸,是一种常用的食用香精也是合成香料的原料,已有研究表明,利用微生物发酵可将香草酸转化为香兰素[17];3,5-二甲氧基-4-羟基肉桂醛,俗称芥子醛,除可作为天然香料或合成香料原料外,它还是很多中草药如苏木、显苞芒毛苣苔、黄荆子等的主要化学成分之一[18-19]。核桃壳在烘焙后还生成5-甲基糠醛,5-甲基糠醛具有焦糖味、辛香、坚果香,在食品及烟草中应用广泛。
3 结论
结合GC-MS对不同烘焙温度下核桃壳提取物的挥发性成分进行分析鉴定,结果表明核桃壳挥发性成分中含有大量的香料物质,一些主要的香料物质在烘烤后其总挥发性成分的相对含量较对照明显升高,其附加值也随之提高。因此,可将核桃壳烘焙后用于香料工业生产,具有良好的开发应用前景。
[1] 尉芹,马希汉,郑滔.核桃壳木醋液的制取、成分分析及抑菌试验[J].农业工程学报,2008,24(7):276-279.
[2] 吴文彪,许妍,丘克强.不同添加剂预处理核桃壳真空热裂解[J].中南大学学报:自然科学版,2013,44(2):475-480.
[3] Zabihi M,Haghighi A A,Ahmadpour A.Studies on adsorption of mercury from aqueous solution on activated carbons prepared from walnut shell[J].Journal of Hazardous Materials,2010,174(1-3):251-256.
[4] WANG Gang,LI Aimin,LI Mingzhi.Sorption of nickel ions from aqueous solutions using activated carbon derived from walnut shell waste[J].Desalination and Water Treatment,2010,16(1/3):282-289.
[5] 陈志勇,薛灵芬.核桃壳棕色素的提取及性能研究[J].信阳师范学院学报,2001,14(1):99-101.
[6] 李维莉,马银海,刘增康,等.核桃壳棕色素的提取及性质研究[J].食品科学,2008,29(12):339-341.
[7] 胡博路,杭瑚.核桃壳抗氧化和清除活性氧自由基的研究[J].研究与探讨,2002,23(1):15-16.
[8] 孙忠玺.蒸馏法制取核桃壳焦油抗聚剂的工艺[J].林产化工通讯,1992,26(5):19-21.
[9] 赵军凯,李勇,张晓冬,等.核桃壳过滤器运行现状分析与改进[J].工业水处理,2008,28(2):75-78.
[10] 李相远,邵长新,万世清,等.核桃壳滤料粒径对油田污水过滤的影响研究[J].石油机械,2005,33(7):23-25.
[11] 徐华义,童朝平.三种常用物理堵漏材料的优选实验研究[J].西安石油学院学报,1998,11(1):26-29.
[12] 张小勇,张建安.天然木质素原料的氮化[J].化工冶金,2000,21(2):204-207.
[13] Sun Rongqi,Sacalis John N,Chin Chee-Kok,et al.Bioactive aromatic compounds from leaves and stems of vanilla fragrans[J].Agricultural and Food Chemistry,2001,49(11):5161-5164.
[14] 杨虹,苏国岁.烟用香精的GC-MS指纹图谱[J].分析测试学报,2004,23(5):278-279.
[15] 凌关庭.食品添加剂手册[M].北京:化学工业出版社,1997.
[16] 薛敦渊,李兆林,陈耀祖,等.华北紫丁香花香气成分的研究[J].兰州大学学报:自然科学版,1992,38(3):81-85.
[17] 王明君,郑璞,孙志浩,等.微生物转化香草酸生产香草醛[J].食品与发酵工业,2004,30(2):43-47.
[18] 王鑫,赵焕新,牟艳玲,等.苏木的化学成分[J].食品与药品,2013,15(2):86-88.
[19] 王强,徐芳辉.显苞芒毛苣苔乙酸乙酯部位的化学成分研究[J].中药材,2013,36(3):414-415.
