扩散加权成像鉴别诊断恶性胶质瘤与单发脑转移瘤的b值优化
2014-12-10WANGPing
王 萍 WANG Ping
翟昭华2 ZHAI Zhaohua
唐光才1 TANG Guangcai
韩福刚1 HAN Fugang
舒 健1 SHU Jian
2.川北医学院附属医院放射科 四川南充637000
恶性胶质瘤和脑转移瘤是脑内常见肿瘤,患病率和病死率均很高。当脑转移瘤为单发时,其临床及常规影像学表现与恶性胶质瘤相似,难以鉴别[1-3]。然而由于恶性胶质瘤与脑转移瘤的治疗方案及预后不同,影像学鉴别诊断有助于为患者制订合理的治疗方案。扩散加权成像(DWI)高b值能够敏感、准确地反映更加微小的水分子运动,对恶性肿瘤的敏感性增加[4]。本研究拟探讨不同b值对恶性胶质瘤与单发脑转移瘤的鉴别诊断价值,以寻找鉴别两者的最佳b值。
1 资料与方法
1.1 研究对象 收集2011-10~2013-03川北医学院附属医院经手术病理证实的25例恶性胶质瘤和经手术病理、随访证实的15例单发脑转移瘤。25例恶性胶质瘤患者中,男13例,女12例;年龄13~70岁,平均(51.80±16.89)岁;WHO分级:II~III级3例,III级5例,III~IV级 9例,IV级8例。15例单发脑转移瘤患者中,男7例,女8例;年龄40~79岁,平均(61.1±11.2)岁;原发灶:5例病理证实为肺低分化腺癌,1例病理证实为肺小细胞内分泌癌,1例病理证实的脑转移性乳头状腺瘤原发病灶不明,6例随访证实为肺癌,2例随访证实为胃肠道肿瘤。
1.2 仪器与方法 采用GE Discovery MR750 3.0T超导MRI仪,32通道头部线圈。扫描范围:自听眶线至颅顶,眉间线位于线圈横轴中心。扫描参数:平扫:T1WI液体衰减反转恢复序列(FLAIR)横断面及矢状面成像:TR 1955.7 ms,TE 21.1 ms,视野(FOV)22 cm×22 cm,矩阵384×256,层厚6 mm,层间距1 mm;T2WI快速自旋回波(FSE):TR 4911.0 ms,TE 108.9 ms,FOV 22 cm×22 cm,矩阵384×256,层厚6 mm,层间距1 mm;T2WI FLAIR:TR 8000.0 ms,TE 147.4 ms,FOV 22 cm×22 cm,矩阵320×224,层厚6 mm,层间距1 mm;DWI:TR 6000 ms,TE 114 ms,b值取1000、3000、5000 s/mm²时,激励次数分别为2、4、4,FOV 22 cm×22 cm,矩阵128×128,层厚6 mm,层间距1 mm;MR增强行T1WI FLAIR横断面、矢状面及冠状面成像,对比剂采用钆喷酸葡胺注射液(469 mg/ml)10 ml,注射速度为2.5 ml/s,造影剂注入5 s后开始扫描。
1.3 图像分析 由2名放射学诊断医师对瘤体及瘤周区域表观扩散系数(ADC)值进行测定。瘤体区域定义为T2WI及T2WI FLAIR高信号,增强扫描明显强化区域,避开囊变、坏死、出血、颅骨及伪影区域;瘤周区域定义为T2WI及T2WI FLAIR高信号,增强扫描未见强化,且距离瘤体1 cm以内的区域;选择瘤体最大层面,每个层面瘤体及瘤周区域分别选择3个感兴趣区进行测量,并取平均值。
1.4 统计学方法 采用SPSS 13.0软件,对恶性胶质瘤和单发脑转移瘤瘤体及瘤周区域ADC值行方差齐性检验和成组t检验,并绘制不同b值瘤周ADC值的ROC曲线,选取鉴别恶性胶质瘤和单发脑转移瘤的最佳截点,计算其敏感度、特异度、阳性预测值和阴性预测值,P<0.05表示差异有统计学意义。
2 结果
2.1 瘤体及瘤周区域ADC值比较 b值取1000、3000、5000 s/mm²时,恶性胶质瘤瘤周ADC值均显著小于单发脑转移瘤,差异均有统计学意义(t=-6.355、-2.972、-2.392, P<0.05),瘤体ADC值差异无统计学意义(t=0.484、1.025、0.948, P>0.05),见表1及图1、2。

表1 不同b值DWI恶性胶质瘤与单发脑转移瘤瘤体及瘤周区域ADC值比较(×10-3 mm2/s)
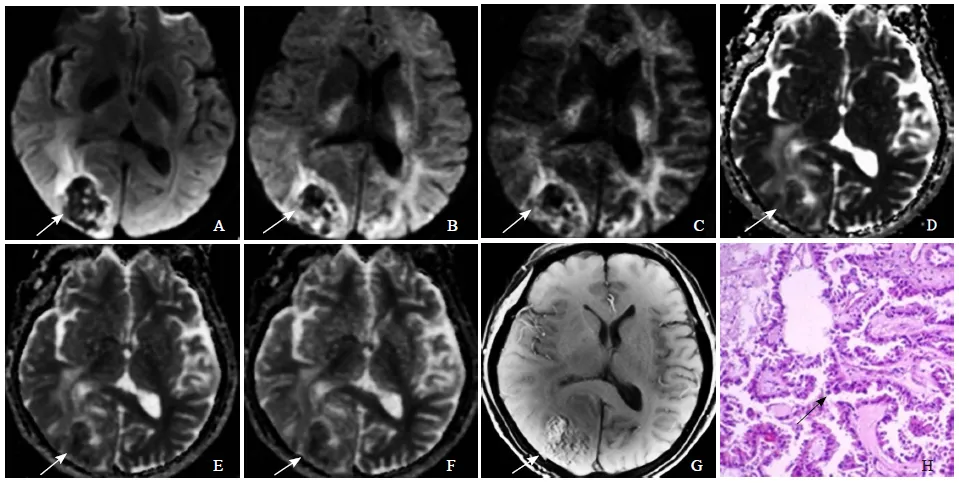
图1 男,63岁,原发灶不明的右枕叶脑转移性乳头状腺瘤。A~C分别为b值取1000、3000、5000 s/mm²时的DWI信号图,D~F分别为对应的ADC图,随b值升高,肿瘤瘤体区域(箭)显示更加明显,瘤周区域显示减弱;T1WI FLAIR增强扫描示病灶明显不均匀强化(箭,G);病理镜下见形似腺样结构生长的肿瘤细胞(箭),肿瘤细胞(箭)小,胞质少,有乳头形成(HE, ×100, H)
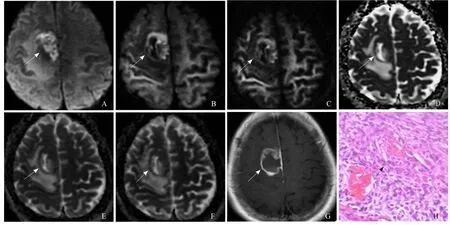
图2 女,67岁,右顶叶胶质母细胞瘤,WHO IV级。A~C分别为b值取1000、3000、5000 s/mm²的DWI信号图,D~F分别为对应的ADC图,随b值升高,肿瘤瘤体(箭)显示更加明显,对瘤周区域的显示能力减弱;T1WI FLAIR增强扫描图像可见病灶实性部分明显强化,中心见囊变坏死区,肿瘤明显不均匀强化(箭,G);病理镜下见肿瘤细胞(箭)分化较差,细胞呈多形性,并见血管增生(HE, ×200, H)
2.2 b值的选择 根据瘤周ADC值绘制ROC曲线,取敏感度、特异度均最高的点作为对恶性胶质瘤及单发脑转移瘤的鉴别点,当b值取1000 s/mm²时曲线下面积最大,为0.98,敏感度、特异度、阳性预测值、阴性预测值分别为100.0%、88.0%、79.0%、100.0%,见表2及图3。
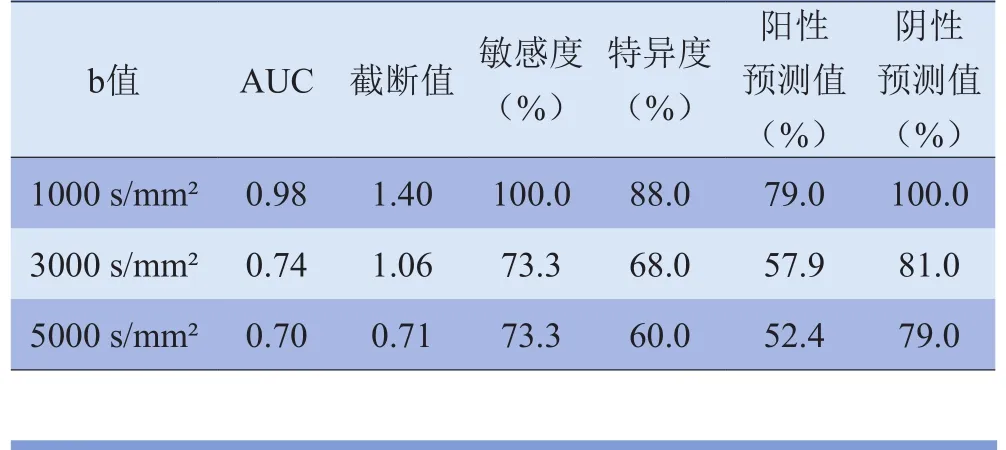
表2 不同b值DWI恶性胶质瘤与单发脑转移瘤瘤周ADC值ROC曲线分析
3 讨论
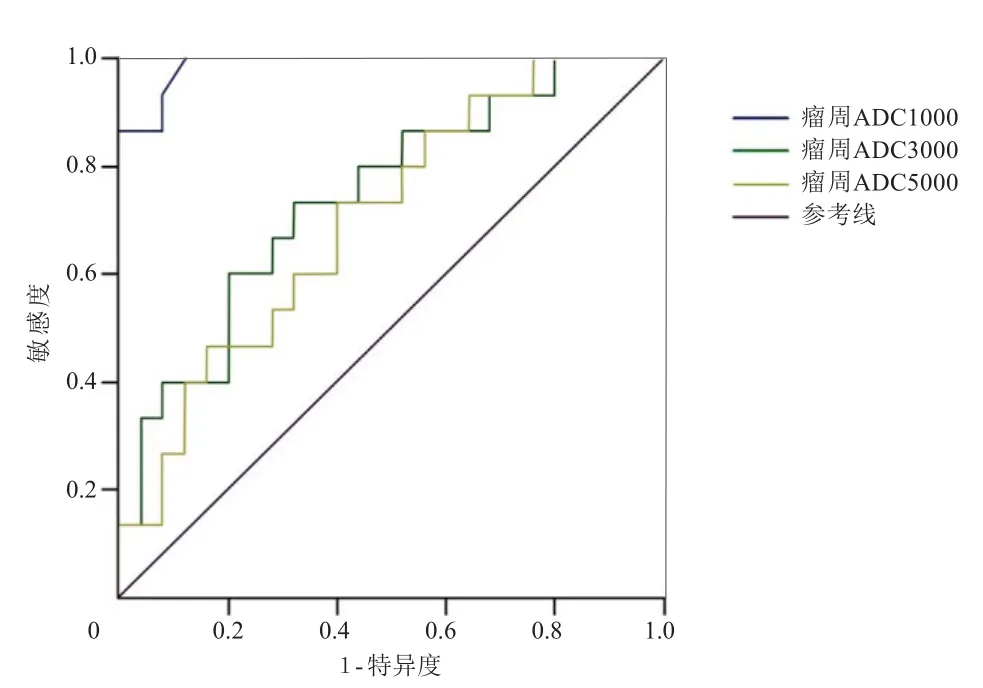
图3 不同b值DWI恶性胶质瘤与单发脑转移瘤瘤周ADC值ROC曲线
3.1 不同b值DWI ADC值对恶性胶质瘤和单发脑转移瘤的鉴别诊断 本研究中b值取1000 s/mm²时恶性胶质瘤瘤周ADC值均低于脑转移瘤,与Pavlisa等[5]和Server等[6]的研究结果相似。本研究同时运用高b值DWI时亦得出恶性胶质瘤瘤周ADC值均低于单发脑转移瘤,其原因可能为:①转移瘤瘤周区域水肿较恶性胶质瘤更明显,水分子扩散增加,ADC值增高。孤立的脑转移瘤肿瘤组织血管内皮与其脑外起源组织相似,无血-脑屏障,通透性高,且为窗孔型厚薄不均的血管内皮基膜,易导致液体渗出;脑转移瘤由于常发生于皮髓交界区,无静脉瓣的大脑引流静脉易受压迫发生引流受阻,从而产生广泛的继发性水肿[7,8]。②恶性胶质瘤瘤周区域细胞增多,导致ADC值降低。恶性胶质瘤和脑转移瘤瘤周区域组织病理成分不同,脑转移瘤肿瘤细胞通常不向瘤周区域呈侵袭性生长,而恶性胶质瘤肿瘤细胞则会沿着瘤周的白质纤维束或血管间隙浸润,导致瘤周区域细胞密度较转移瘤大,水分子扩散运动较转移瘤受限,引起ADC值降低[7,9]。这种恶性胶质瘤的侵袭作用随着与瘤体距离的增加而减弱[8],故本研究中选择距瘤体1 cm以内的近瘤区域作为瘤周区域,以更好地鉴别恶性胶质瘤和单发脑转移瘤。瘤体区域ADC值在不同b值时相近,不能对这两种肿瘤进行鉴别,与Muccio等[10]及Hayashida等[11]的研究结果一致,推测可能与脑转移瘤原发病灶的病理和组织学类型多种多样有关。当原发灶不同时,细胞密度差异大,导致同组间ADC值分布区间广,与其他类型的肿瘤鉴别困难。本组15例单发脑转移瘤中,原发灶类型较多,是导致本研究中瘤体ADC值无显著差异的主要原因。对特定原发灶的单发脑转移瘤的收集尚需进一步研究。
3.2 对恶性胶质瘤和单发脑转移瘤鉴别诊断的b值优化本研究得出随着b值升高,ADC值对这两种肿瘤瘤周区域的鉴别诊断作用减弱,而并非随b值的升高鉴别能力增强,最佳的鉴别b值为1000 s/mm²,其鉴别诊断恶性胶质瘤和单发脑转移瘤的ROC曲线下面积最大为0.98,高于b值为3000、5000 s/mm²时对恶性胶质瘤和单发脑转移瘤鉴别的ROC曲线下面积0.74及0.70,敏感度、特异度、阳性预测值、阴性预测值分别为100.0%、88.0%、79.0%、100.0%,其原因可能为生物组织内的水分有快速扩散成分和慢速扩散成分,但其意义目前尚无定论[12,13]。Maier等[13]用双指数模型研究生物组织内的水衰减情况,快速扩散成分所占比例在瘤周较瘤体区域升高明显;慢速扩散成分所占比例在瘤周水肿区域下降,而瘤体区域明显增高。李玉华等[14]认为快速扩散成分和慢速扩散成分分别与细胞外水和细胞内水密切相关:当b值较小时,DWI图像上主要反映了快速扩散成分,代表细胞外成分;而随着b值升高,快速扩散成分信号被过滤掉,DWI图像上主要反映了慢速扩散的细胞内水分。瘤周区域的血浆自新生异常毛细血管壁渗出增加,细胞外水分增多,主要为快速扩散的水分,在较低b值时对瘤周水肿显示更好,即对瘤周水肿病理差异的鉴别能力更强。本研究得出恶性胶质瘤和单发脑转移瘤瘤周区域ADC值鉴别的最佳截点为1.40×10-3mm2/s,当瘤周区域ADC值≥1.40×10-3mm2/s时脑转移瘤可能性大。
总之,随着b值升高,ADC值在恶性胶质瘤和单发脑转移瘤瘤周区域的鉴别能力逐渐降低,当b值取1000 s/mm²时,ADC值对瘤周区域的鉴别能力最强。
[1] Stupp R, Tonn JC, Brada M, et al. High-grade malignant glioma: ESMO clinical practice guidelines for diagnosis,treatment and follow-up. Ann Oncol, 2010, 21(5): v190-v193.
[2] Upadhyay N, Waldman AD. Conventional MRI evaluation of gliomas. Br J Radiol, 2011, 84(2): S107-S111.
[3] Wang QJ, Wang Y, Xu X, et al. Efficacy of gadobenate dimeglumine vs gadopentetate dimeglumine in contrastenhanced magnetic resonance imaging for diagnosis of solitary brain metastases. Nan Fang Yi Ke Da Xue Xue Bao, 2011,31(12): 1968-1973.
[4] 李世杰, 王鑫坤, 王佳, 等. 高b值DWI对前列腺癌和前列腺炎的鉴别诊断价值. 中国医学影像学杂志, 2012,20(12): 887-889.
[5] Pavlisa G, Rados M, Pavlisa G, et al. The differences of water diffusion between brain tissue inf i ltrated by tumor and peritumoral vasogenic edema. Clin Imaging, 2009, 33(2): 96-101.
[6] Server A, Kulle B, Maehlen J, et al. Quantitative apparent diffusion coefficients in the characterization of brain tumors and associated peritumoral edema. Acta Radiol, 2009, 50(6):682-689.
[7] 范光明, 沈金丹, 沈桂权, 等. 瘤周水肿区扩散加权成像在胶质瘤分级中的应用价值. 中国医学影像技术, 2009, 25(1):58-61.
[8] Pàez-Ribes M, Allen E, Hudock J, et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis. Cancer Cell, 2009, 15(3):220-231.
[9] Hygino da Cruz LC Jr, Vieira IG, Domingues RC. Diffusion MR imaging: an important tool in the assessment of brain tumors.Neuroimaging Clin N Am, 2011, 21(1): 27-49.
[10] Muccio CF, Esposito G, Bartolini A, et al. Cerebral abscesses and necrotic cerebral tumours: differential diagnosis by perfusion-weighted magnetic resonance imaging. Radiol Med,2008, 113(5): 747-757.
[11] Hayashida Y, Hirai T, Morishita S, et al. Diffusion-weighted imaging of metastatic brain tumors: comparison with histologic type and tumor cellularity. Am J Neuroradiol, 2006, 27(7):1419-1425.
[12] Shinmoto H, Oshio K, Tanimoto A, et al. Biexponential apparent diffusion coeff i cients in prostate cancer. Magn Reson Imaging, 2009, 27(3): 355-359.
[13] Maier SE, Bogner P, Bajzik G, et al. Normal brain and brain tumor multicomponent apparent diffusion coeff i cient line scan imaging. Radiology, 2001, 219(3): 842-849.
[14] 李玉华, 陆建平, 段秀杰, 等. 多b值DWI在儿童脑肿瘤中的初步研究. 放射学实践, 2012, 27(2): 159-163.
