中国磁共振波谱诊断胶质瘤术后复发与放射性脑损伤
2014-12-10WANGLi
王 莉 WANG Li
孙立新 SUN Lixin
于学文 YU Xuewen
王 芳 WANG Fang
胡 军 HU Jun
田 静 TIAN Jing
胶质瘤是颅内最常见的肿瘤[1],具有发病率高、复发率高、死亡率高及治愈率低的特点,临床主要采用手术及术后放射的治疗方案[2,3]。由于胶质瘤具有侵袭性且易复发的生物学特性,手术难以完全切除,放射性治疗已经成为治疗残余肿瘤的主要辅助措施,然而胶质瘤患者进行放射性治疗后需要对胶质瘤复发与放射性脑损伤进行鉴别诊断,将对制订进一步的治疗方案具有重要的参考价值[4-6]。
氢质子磁共振波谱(magnetic resonance spectroscopy,MRS)是一种无创性地测定人体内组织代谢、生化改变以及化合物定量分析的方法[7,8],近年来,中国已开展关于MRS鉴别诊断胶质瘤复发与放射性脑损伤的研究,本文基于中国相关研究进行荟萃分析,为中国MRS鉴别诊断胶质瘤复发与放射性脑损伤及后续研究提供依据。
1 资料与方法
1.1 文献检索与筛选 检索数据库包括中国知网数据库、万方数据库,检索词为胶质瘤、胶质瘤复发、放射性脑损伤、磁共振波谱、MRS,文献发表时间范围限制为2000~2013年。对于所有检索到的文献从筛检、纳入由2名评价者独立进行检索和评价,意见不一致时协商达成一致。
文献筛选根据Cochrane协作网筛选与诊断试验方法组中关于诊断试验性研究的纳入标准进行:①文献研究目的为探讨MRS诊断胶质瘤复发与放射性脑损伤的价值;②相同时间段的同一组病例资料,只纳入一次;不同时间段的病例资料在不同文献中发表时,均纳入研究;③所有研究对象术后病理均证实为胶质瘤,且均进行术后放射性治疗;④诊断为术后复发的标准为术后病理证实或临床随访过程中占位效应强化并逐渐扩大;⑤诊断为放射性脑损伤的标准为术后病理证实或临床随访过程中强化病灶不变或逐渐减小;⑥所有研究纳入研究对象均为5例以上。
排除标准:①关于动物实验的文献;②文献中无法推断出准确的相关数据;③研究对象未进行放射性治疗;④文献发表类型为综述、信件、评论、社论和病例报告等。
1.2 数据提取 每篇纳入文献分别提取研究者、发表时间及胶质瘤复发与放射性脑损伤的病例数量、NAA/Cr波峰比值、Cho/Cr波峰比值、Cho/NAA波峰比值。
1.3 统计学方法 采用Stata 10.0软件(www.stata.com),对所有纳入文献进行同质性检验,若同质性较差,采用随机效应模型,否则采用固定效应模型。计算汇总NAA/Cr波峰比值、Cho/Cr波峰比值、Cho/NAA波峰比值及相应的95% CI,并绘制森林图。对于差异无统计学意义的数据绘制受试者工作特征(ROC)曲线,计算ROC曲线下面积,并得出相应的诊断阈值、灵敏度及特异度。
2 结果
2.1 文献检索与筛选 按照制订的检索策略及纳入标准、排除标准,最终纳入12篇文献,关于MRS诊断胶质瘤复发与放射性脑损伤各11篇,其中关于胶质瘤复发患者229例,放射性脑损伤患者153例。所有纳入研究的基本信息见表1。

表1 纳入研究的基本特征
2.2 统计学分析 所有纳入研究异质性分析结果均I2>50%且P<0.05,说明纳入研究具有异质性,采用随机效应模型进行汇总分析。经荟萃分析得出放射性脑损伤的NAA/Cr波峰比值、Cho/Cr波峰比值、Cho/NAA波峰比值及相应的95% CI分别为 1.115(0.904~1.325)、1.428(1.118~1.738)、1.412(1.260~1.564);胶质瘤复发的 NAA/Cr波峰比值、Cho/Cr波峰比值、Cho/NAA波峰比值及相应 的 95% CI分 别 为 1.028(0.880~1.176)、2.286(1.903~2.668)、3.043(2.562~3.524),见图 1~3。其中胶质瘤复发的汇总Cho/NAA波峰比值高于放射性脑损伤(P<0.05)。

图1 NAA/Cr汇总结果

图2 Cho/Cr汇总结果

图3 Cho/NAA汇总结果

图4 NAA/Cr ROC曲线
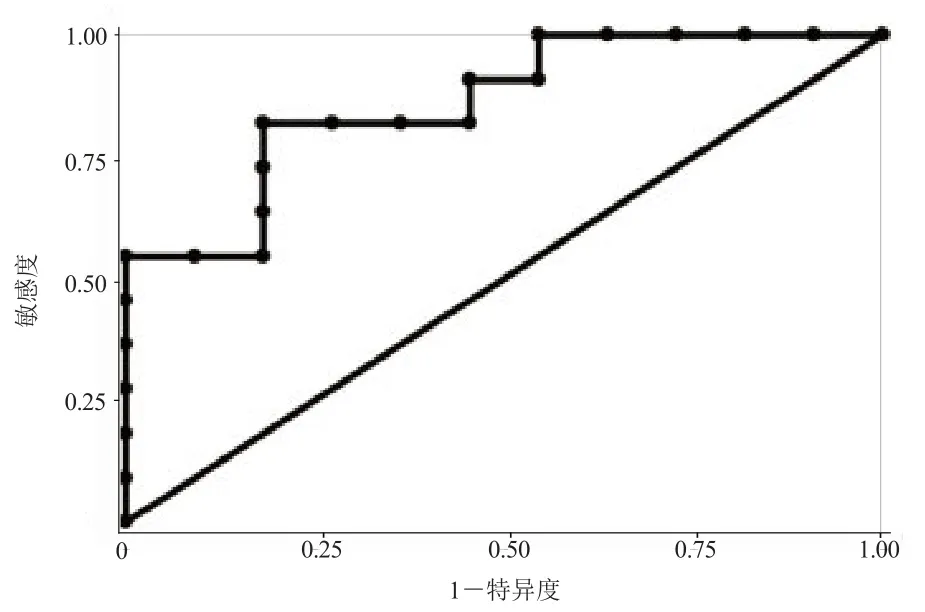
图5 Cho/Cr ROC曲线
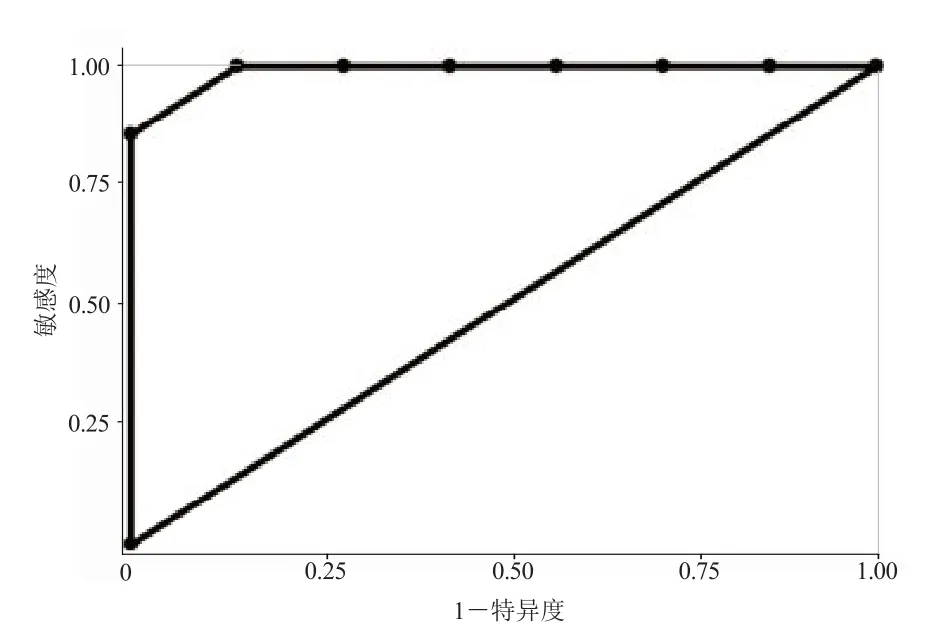
图6 Cho/NAA ROC曲线
NAA/Cr诊断阈值为1.01时诊断放射性脑损伤的灵敏度和特异度分别为77.8%和55.6%,ROC曲线下面积为0.605(图4)。Cho/Cr诊断阈值为1.67时诊断胶质瘤复发的灵敏度、特异度和ROC曲线下面积分别为81.8%、81.8%和0.859(图5)。Cho/NAA诊断阈值为2.27时诊断胶质瘤复发的灵敏度和特异度分别为85.7%和100.00%;诊断阈值为2.14时的灵敏度和特异度分别为100.00%和85.7%,ROC曲线下面积为0.989(图6)。
3 讨论
胶质瘤患者术后及放射治疗后对患者病灶进行检测,准确地鉴别诊断胶质瘤复发与放射性脑损伤,及时改变其治疗方案,对提高患者的生存率及生存质量具有重要帮助。胶质瘤复发与放射性脑损伤临床征象无特异性,常规MRI检查表现为病灶强化,根据其临床表现及常规MRI均难以鉴别。MRS是一项无创性地检测人体内组织代谢信息和生化改变的定量分析技术,可以反映人体内的病理生理变化[21,22]。在许多疾病的发生过程中,其代谢变化较病理改变更早出现,而MRS检测代谢较为敏感,能早期检测出代谢变化,目前已经广泛应用于评估脑肿瘤预后及放射治疗后的改变[23-25]。
Rock等[26]认为 Cho/NAA、NAA/Cr和NAA/Cho的峰值在胶质瘤复发与放射性脑损伤的鉴别诊断结果与组织病理学具有相关性。经过全面检索,中国未见大样本相关临床研究,鉴于此,基于循证医学理念,笔者汇总分析中国关于MRS鉴别诊断胶质瘤复发与放射性脑损伤的研究,探讨中国MRS鉴别诊断胶质瘤复发与放射性脑损伤的价值,并为后续研究提供依据。经荟萃分析得出胶质瘤复发的Cho/NAA波峰比值明显高于放射性脑损伤。根据NAA/Cr波峰比值、Cho/Cr波峰比值、Cho/NAA波峰比值的诊断阈值、灵敏度、特异度及ROC曲线下面积可以发现,Cho/Cr、Cho/NAA在胶质瘤复发病灶中明显升高且具有较高的准确率。目前多数研究认为Cho/Cr、Cho/NAA在肿瘤复发中明显升高[7,27-29],而且Cho/NAA、NAA/Cr具有鉴别诊断肿瘤与损伤的能力[30,31],Ando等[32]认为Cho/Cr可以为鉴别诊断肿瘤复发提供重要信息,本研究结果与其基本一致。
本研究通过对多个同类研究进行汇总分析,进而增加样本量,以提高其检验效能,但各个研究本身存在的偏倚无法消除,不足之处主要有:①为了探讨中国应用MRS鉴别诊断胶质瘤复发与放射性脑损伤的诊断价值,本研究只局限于中国研究,下一步将开展评价并比较国内外状况的研究;②所有纳入研究的患者所患胶质瘤级别有所差异,而不同级别肿瘤的各种代谢物的含量亦有所不同;③MRS结果与体素位置的选取有关,同一病灶的不同感兴趣区所测得结果也不同;④胶质瘤复发与放射性脑损伤并存时,会影响MRS检测结果的准确性;⑤不同波谱体素面积及采样数量所测得的MRS数值也会存在差异。本研究针对局限性采取了相应的积极措施予以补救,而且也得到了比较乐观的结果。
总之,MRS可以作为一种无创性地鉴别诊断胶质瘤复发与放射性脑损伤可靠的检查方法,尤其是Cho/Cr波峰比值及Cho/NAA波峰比值。结合各种代谢产物的变化,MRS将成为有效的临床决策工具,以减少患者不必要的有创性损伤。由于原始研究在设计上的缺陷,需要更多设计完善的研究来进一步探讨MRS在鉴别诊断胶质瘤复发与放射性脑损伤的价值。
[1] 汤钊猷. 现代肿瘤学. 上海: 上海医科大学出版社, 2000: 1410.
[2] Laws JE. Radical resection for the treatment of glioma. Clin Neurosurg, 1994, 42: 480-487.
[3] Hentschel SJ, Sawaya R. Optimizing outcomes with maximal surgical resection of malignant gliomas. Cancer Control, 2003,10(2): 109-114.
[4] Mehta MP, Tsao MN, Whelan TJ, et al. The American society for therapeutic radiology and oncology (ASTRO) evidencebased review of the role of radiosurgery for brain metastases.Int J Radiat Oncol Biol Phys, 2005, 63(1): 37-46.
[5] 步星耀, 郭晓鹤, 丁玉超, 等. 脑恶性胶质瘤术后放化疗肿瘤复发再手术治疗的临床研究. 中华临床医师杂志(电子版),2012, 6(5): 1135-1139.
[6] 王玉林, 马林. 胶质瘤复发与放射性脑损伤的影像研究现状. 中国医学影像学杂志, 2013, 21(5): 395-397.
[7] Plotkin M, Eisenacher J, Bruhn H, et al. 123I-IMT SPECT and 1H MR-spectroscopy at 3.0 T in the differential diagnosis of recurrent or residual gliomas: a comparative study. J Neurooncol, 2004, 70(1): 49-58.
[8] Di Costanzo A, Trojsi F, Tosetti M, et al. High-field proton MRS of human brain. Eur J Radiol, 2003, 48(2): 146-153.
[9] 姜梅, 朱丽娜, 贾文霄, 等.1H-MRS在胶质瘤复发和放射性脑病鉴别诊断中的应用. 中国现代医学杂志, 2011,21(1): 104-108.
[10] 张灵艳. 3.0TMR灌注成像及1H磁共振波谱在鉴别脑胶质瘤复发与放射性脑损伤中的应用研究.广州:南方医科大学硕士学位论文, 2009.
[11] 钱李娟. 3T HR-SWI定量评估胶质瘤术后复发与术后改变.武汉:华中科技大学硕士学位论文, 2012.
[12] 金晓, 朱君明, 陈书达, 等. 3T多体素MRS在放射性脑损伤和胶质瘤复发鉴别诊断中的应用. 温州: 2008年浙江省神经外科学学术年会, 2008.
[13] 林丽萍. 磁共振新技术在识别胶质瘤术后复发中的应用价值研究.上海: 复旦大学硕士学位论文, 2008.
[14] 刘克, 陈德基, 黄勇, 等. 3D1HMRS在脑肿瘤中的应用.北京: 首届国际医学影像暨介入医学学术会议, 2005.
[15] 孟名柱. 磁共振多参数评分鉴别脑胶质瘤复发与放射性脑损伤. 徐州: 徐州医学院硕士学位论文, 2011 .
[16] 曾庆师. MR波谱及弥散加权成像鉴别胶质瘤复发和放射性脑损伤.济南: 山东大学硕士学位论文, 2007 .
[17] 周立霞, 张颖, 李英, 等. MRS和ASL技术在脑胶质瘤复发和放射性损伤鉴别诊断中的应用. 实用放射学杂志,2010, 26(12): 1701-1703, 1708.
[18] 张秀明, 戴峰, 乔伟, 等. 磁共振功能成像在鉴别脑胶质瘤术后复发与放射性损伤中的应用. 中国医学影像学杂志,2013, 21(3): 161-165.
[19] 徐俊玲, 李永丽, 连建敏, 等. 二维氢质子磁共振波谱分析鉴别胶质瘤术后复发和放射性脑损伤. 中国医学影像技术,2010, 26(4): 639-642.
[20] 杨丹, 岳晓琳, 张晶, 等. 脑胶质瘤复发与放射性脑损伤的鉴别诊断. 实用肿瘤学杂志, 2010, 24(2): 120-122.
[21] Adamson AJ, Rand SD, Prost RW, et al. Focal brain lesions:effect of single-voxel proton MR spectroscopic findings on treatment decisions. Radiology, 1998, 209(1): 73-78.
[22] Zhou G, Wang X, Gong C, et al. Value of proton magnetic resonance spectroscopy with two-dimensional chemical-shift imaging in evaluating brain gliomas. Nan Fang Yi Ke Da Xue Xue Bao, 2008, 28(8): 1342-1344.
[23] Estève F, Rubin C, Grand S, et al. Transient metabolic changes observed with proton MR spectroscopy in normal human brain after radiation therapy. Int J Radiat Oncol Biol Phys, 1998,40(2): 279-286.
[24] Wald LL, Nelson SJ, Day MR, et al. Serial proton magnetic resonance spectroscopy imaging of glioblastoma multiforme after brachytherapy. J Neurosurg, 1997, 87(4): 525-534.
[25] Taylor JS, Langston JW, Reddick WE, et al. Clinical value of proton magnetic resonance spectroscopy for differentiating recurrent or residual brain tumor from delayed cerebral necrosis.Int J Radiat Oncol Biol Phys, 1996, 36(5): 1251-1261.
[26] Rock JP, Scarpace L, Hearshen D, et al. Associations among magnetic resonance spectroscopy, apparent diffusion coefficients, and image-guided histopathology with special attention to radiation necrosis. Neurosurgery, 2004, 54(5):1111-1117.
[27] Weybright P, Sundgren PC, Maly P, et al. Differentiation between brain tumor recurrence and radiation injury using MR spectroscopy. Am J Roentgenol, 2005, 185(6): 1471-1476.
[28] Zeng Q, Li C, Zhang K, et al. Multivoxel 3D proton MR spectroscopy in the distinction of recurrent glioma from radiation injury. J Neurooncol, 2007, 84(1): 63-69.
[29] Yoshino E, Ohmori Y, Imahori Y, et al. Irradiation effects on the metabolism of metastatic brain tumors: analysis by positron emission tomography and 1H-magnetic resonance spectroscopy. Stereotact Funct Neurosurg, 1996, 66(Suppl 1):240-259.
[30] Matsusue E, Fink JR, Rockhill JK, et al. Distinction between glioma progression and post-radiation change by combined physiologic MR imaging. Neuroradiology, 2010, 52(4): 297-306.
[31] Elias AE, Carlos RC, Smith EA, et al. MR spectroscopy using normalized and non-normalized metabolite ratios for differentiating recurrent brain tumor from radiation injury.Acad Radiol, 2011, 18(9): 1101-1108.
[32] Ando K, Ishikura R, Nagami Y, et al. Usefulness of Cho/Cr ratio in proton MR spectroscopy for differentiating residual/recurrent glioma from non-neoplastic lesions. Nihon Igaku Hoshasen Gakkai Zasshi, 2004, 64(3): 121-126.
