PET/CT诊断非小细胞肺癌纵隔淋巴结分期的准确性研究——Meta分析
2014-12-10李晓翠LIXiaocui
李晓翠 LI Xiaocui
苗丽琼 MIAO Liqiong
钱 靖 QIAN Jing
吴云坤 WU Yunkun
杨 青 YANG Qing
据WHO统计,每年肺癌的新增病例及死亡病例数在26种常见恶性肿瘤中居首位,且患者5年生存率低于15%[1]。在一些欧美国家,非小细胞肺癌(NSCLC)的患病人数在所有癌症死亡人数中最多[2]。各类型肺癌中,NSCLC所占比例高达70%~80%[3],NSCLC的精确分期特别是纵隔淋巴结分期的准确度对制订肺癌治疗方案及评价患者预后具有重要意义。
目前,CT较常用于诊断NSCLC患者纵隔淋巴结分期,但仅凭纵隔淋巴结的大小对良性与恶性病变进行区分有较大的局限性。近年来,许多研究指出相对于单独运用CT诊断,增加正电子发射断层扫描(PET)诊断的准确度更高[4-9]。本研究收集2000~2011年国内外公开发表的PET/CT诊断NSCLC纵隔淋巴结分期的相关文献做Meta分析,旨在从循证医学的角度获得更多有益启示,为NSCLC纵隔淋巴结的诊断、分期、多学科综合治疗和预后判断寻求更先进、更科学的方法和工具。
1 资料与方法
1.1 文献检索 检索Cochrane Library、PubMed、中国生物医学光盘数据库(CBMdisc)、中国期刊全文数据库(CNKI)、万方数据库知识平台和维普中文科技期刊全文数据库中收录的有关PET/CT诊断NSCLC纵隔淋巴结分期的文献,检索时间均为2000~2011年,本研究不包括尚未公开发表的文献。英文检索词包括:positron emission tomography/computed tomography、PET/CT、mediastinal lymph-nodes、lymph nodes、staging、non-small cell lung cancer、NSCLC。中文检索词包括:PET/CT、纵隔淋巴结、淋巴结、分期、非小细胞肺癌、NSCLC。
1.2 文献筛选 文献纳入标准:①2000~2011年公开发表的国内外文献;②研究对象为NSCLC患者;③评价PET/CT诊断NSCLC纵隔淋巴结分期的作用;④前瞻性或回顾性研究;⑤研究对象不具有相同特征(性别、年龄等);⑥所有纳入研究的病例均行PET/CT(不含单纯PET)和“金标准”检查,采用的显像剂均为18F-FDG;⑦以病理检查作为“金标准”;⑧文献能直接或间接提供原始数据(灵敏度、特异度、准确度、阳性预测值和阴性预测值)。排除标准:①重复发表的文献,或文献为某研究的阶段性报告,而另有其他文献已经报道该研究的完整结果;②病例报告、综述性文献、摘要、会议论文;③评价所有的引流淋巴结,但无法取得纵隔淋巴结的原始数据;④同一研究早期样本量小的文献(样本量≤10);⑤信息不完整、不清晰或出现错误。
1.3 文献质量评价 本研究采用文献诊断性研究质量评价工具(QUADAS工具)评价文献质量,QUADAS工具由14个问题组成,每个问题的评价分级为“是”、“否”或“不清楚”[10]。
1.4 纳入研究信息提取 用Excel建立信息摘录表,从符合要求的文献中提取所需数据,由2名研究人员分别进行,出现疑问或意见不一致时,集中讨论或咨询第三方专家解决。
1.5 统计学方法 采用Meta-Disc 1.4软件[11],异质性分析采用χ2检验,若研究间不具有异质性(P<0.05),则选用固定效应模型;若研究间存在异质性(P>0.05),则选用随机效应模型。将灵敏度对数值与(1-特异度)对数值行Spearman相关分析,检查有无阈值效应引起的异质性,然后进一步运用Meta-Disc软件计算各研究的汇总加权灵敏度、特异度、阳性似然比、阴性似然比及其95% CI,计算汇总受试者工作特征曲线(SROC)和曲线下面积(AUC)、诊断试验的Q*指数[ ,表示诊断试验的准确度,反映SROC曲线与左上角接近的程度,数值越大表示诊断试验的准确度越高],结果用森林图表示,同时采用Stata 12.0软件绘制漏斗图判断是否存在发表偏倚,计算失安全系数(fail-safe number, Nfs),定量估计发表偏倚对数据合并结果的影响。
2 结果
2.1 纳入文献的基本情况 共检索到462篇文献,根据纳入和排除标准,排除文献435篇,其中43篇样本量小于10,25篇未经“金标准”确诊,79篇未采用18F-FDG作为显像剂,119篇不能完整获得真阳性、假阳性、假阴性和真阴性值,86篇不是评价PET/CT诊断NSCLC纵隔淋巴结分期的作用,83篇属于综述性文献、摘要、会议论文;最终有27篇文献纳入分析。纳入文献基本信息:第一作者、发表年份、国家、年龄、性别、人数、研究对象、设计方法、SUV、PET/CT仪器型号及药物剂量等,见表1。
本研究在QUADAS工具中,19篇文献(15、17~22、24~34、36)有 12个问题回答为“是”,3篇文献(13、14、16)有11个问题回答为“是”,5篇文献(12、23、35、37、38)有13个问题回答“是”。27 篇文献中,有 18 篇文献(12~18、20~21、23~24、27~29、35~38)为前瞻性研究。
2.2 Meta分析结果
2.2.1 异质性检验 采用Meta-Disc 1.4软件对纳入研究进行分析,以患者和淋巴结为研究对象的ROC平面散点图不是典型的“肩臂形”外观,Spearman相关系数分别为0.361和0.401,P<0.05,提示不存在阈值效应。异质性检验结果显示,以患者为研究对象,χ2=44.01,自由度(df)=20,P<0.05,在α=0.05水准拒绝同质性假设,采用随机效应模型加权合并;以淋巴结为研究对象,χ2=34.71,df=16,P<0.05,在 α=0.05水准拒绝同质性假设,采用随机效应模型加权合并。
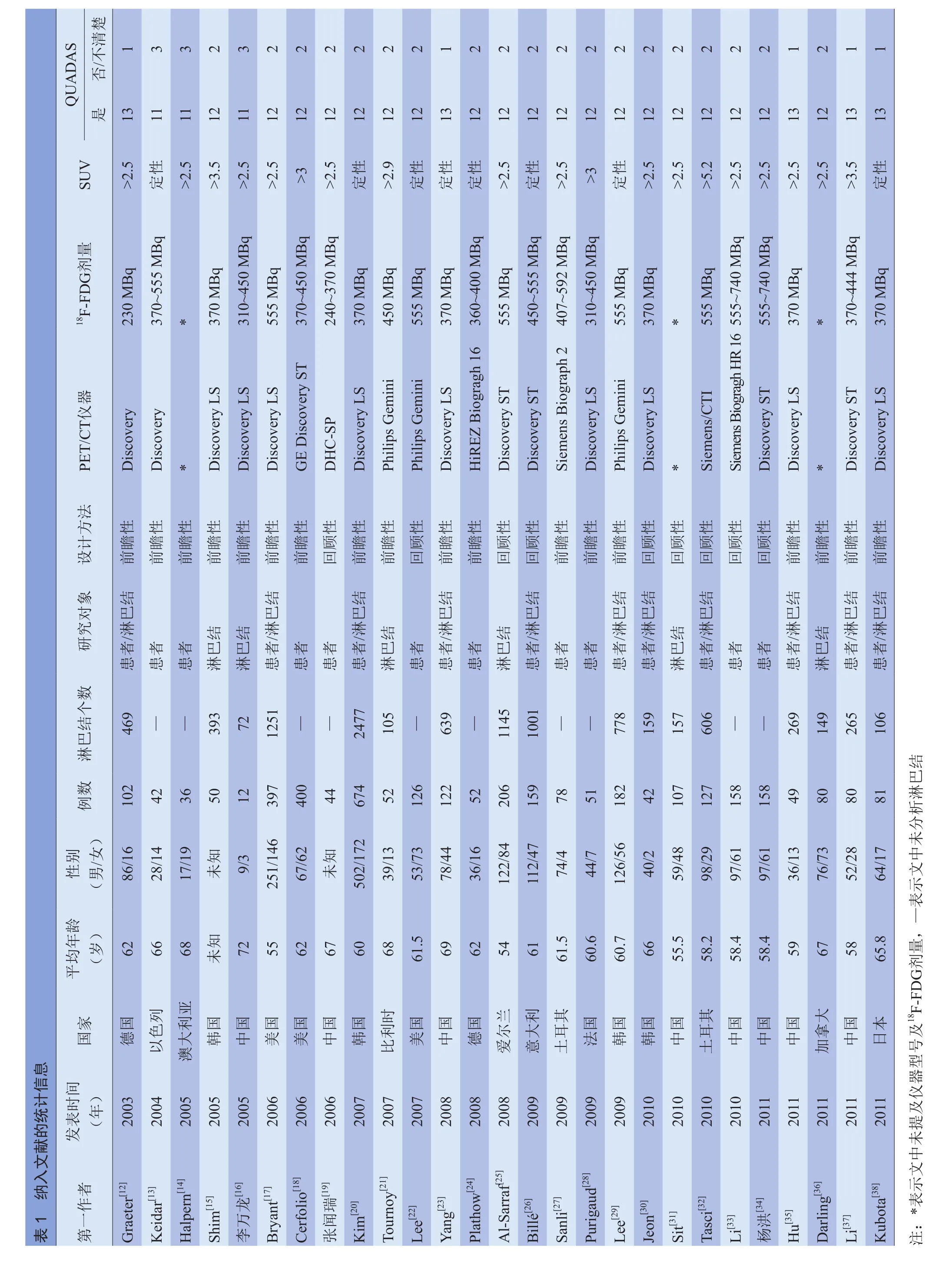
2.2.2 汇总加权灵敏度、特异度、阳性似然比、阴性似然比及其95% CI 以患者为研究对象,综合21篇文献3160例患者,汇总加权灵敏度、特异度、阳性似然比和阴性似然比及其95% CI分别为0.78(0.76~0.81)、0.87(0.85~0.88)、4.44(3.19~6.18)、0.27(0.20~0.36)(χ2=124.78、161.76、150.76、86.59, P<0.05),见图 1。
以淋巴结为研究对象,综合17篇文献,汇总加权灵敏度、特异度、阳性似然比和阴性似然比及其95%CI分别为 0.66(0.64~0.69)、0.94(0.94~0.95)、10.24(7.17~14.61)、0.31(0.24~0.40)(χ2=198.32、425.17、226.13、150.39, P<0.05),见图 2。
?
2.2.3 SROC曲线和Q*指数 绘制SROC曲线,以患者为研究对象,SROC曲线的AUC和Q*指数分别为0.8869、0.8175;以淋巴结为研究对象,SROC曲线的AUC和Q*指数分别为0.9197、0.8530,见图3。
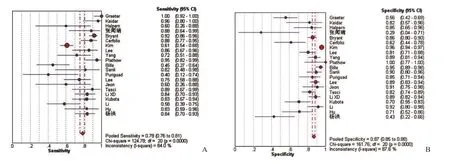
图1 以患者为研究对象,PET/CT诊断NSCLC纵隔淋巴结分期的灵敏度(A)及特异度(B)森林图
2.2.4 发表偏倚 采用Stata 12.0软件绘制漏斗图,以患者为研究对象的倒漏斗图(图4A)基本对称,Begg's、Egger's检验结果P>0.05,提示不存在发表偏倚;以淋巴结为研究对象的倒漏斗图(图4B)基本对称,Begg's、Egger's检验结果P>0.05,提示不存在发表偏倚。Nfs0.05分别为 545.386、679.925。

图2 以淋巴结为研究对象,PET/CT诊断NSCLC纵隔淋巴结分期的灵敏度(A)及特异度(B)森林图
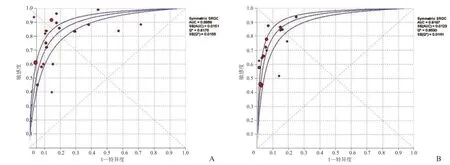
图3 A、B分别为以患者和淋巴结为研究对象的SROC曲线
图4 A、B分别为以患者和淋巴结为研究对象的倒漏斗图。
3 讨论
本研究收集2000~2011年国内外公开发表的关于PET/CT诊断NSCLC纵隔淋巴结分期的文献,运用Meta析方法,对PET/CT诊断NSCLC纵隔淋巴结分期的准确度进行评价。PET/CT的原始研究在病例来源、研究设计、统计学方法等方面有较大差异,且样本量一般都偏小,而通过Meta分析可以扩大样本量,增强统计功效,评估各研究之间结果不一致时的异质性来源。
本次Meta分析结果中,以患者为研究对象,PET/CT的汇总灵敏度和特异度分别为0.78和0.87;以淋巴结为研究对象,PET/CT的汇总灵敏度和特异度分别为0.66和0.94,表明PET/CT在诊断NSCLC纵隔淋巴结转移方面有着更高的特异度[15,33,39,40],但灵敏度有待进一步提高。
SROC曲线分析中Q*值考虑了灵敏度和特异度之间的非线性关系,可以综合反映诊断实验准确率的两个效应量,是灵敏度和特异度的合并指标[41]。本研究中以患者为研究对象,PET/CT诊断NSCLC纵隔淋巴结分期的Q*指数为0.8175;以淋巴结为研究对象的Q*指数为0.8530,表明在NSCLC纵隔淋巴结分期的诊断中,PET/CT有着较高的诊断效能。
AUC值是SROC的另一个统计量,SROC曲线越靠近左上角,曲线下面积越大,其诊断准确性越高、越接近于100%,说明诊断的确诊或排除价值越高。本研究中PET/CT诊断的SROC曲线均较靠近左上角,显示PET/CT检测有较大的AUC值(分别为0.8869、0.9197),即诊断准确性较好[42]。
Lv等[43]采用Meta分析对PET/CT诊断NSCLC患者纵隔淋巴结转移的精度进行评价,以患者为研究对象,汇总灵敏度和特异度分别为0.76和0.88;以淋巴结为研究对象,汇总灵敏度和特异度分别为0.68和0.95。Zhao等[44]研究了PET/CT诊断NSCLC患者纵隔淋巴结转移的精度,以患者为研究对象,汇总灵敏度和特异度分别为0.72和0.90,以淋巴结为研究对象,汇总灵敏度和特异度分别为0.61和0.92。本研究中,以患者为研究对象,汇总灵敏度和特异度分别为0.78和0.87;以淋巴结为研究对象汇总灵敏度和特异度分别为0.66和0.94,结果与其他研究接近。
探讨异质性来源是Meta分析的一个重要部分,本研究中异质性检验表明存在异质性,考虑以下因素可能导致存在异质性:①研究中的病例来源多样化,本研究中病例来自欧美及亚洲的14个国家,而不同的群体难免存在一定的个体差异;②研究中所采用的设计方法不统一,既有回顾性研究也有前瞻性研究;③影像学诊断标准中PET/CT的SUV值不同, SUV值取值有2.5、2.9、3.0、3.5、5.2等;④PET/CT仪器的机型及型号不同,18F-FDG的剂量不同;⑤样本量不同,本研究中符合纳入标准的文献共27篇(3667例患者),其中文献[17]为397例,文献[18]为400例,文献[20]为674例,总和为1471例,占总人数的40%,样本含量权重较大,在一定程度上影响了整体结果;⑥影像评估员的操作水平难以统一;⑦“金标准”的统一程度,所纳入文献中虽然最终都以纵隔淋巴结的病理结果作为“金标准”,但是取得纵隔淋巴结的手段各不相同,是纵隔镜活检术,还是纵隔镜切开活检术、剖胸术,文献中并未具体说明。鉴于以上影响因素,本研究在统计方法上选用了随机效应模型,考虑了研究间方差不齐的影响,以提高汇总结果的可信度。
发表偏倚也是影响Meta分析结果的另一个重要因素,因为阳性或有显著性的结果往往更易发表,而无显著性或阴性结果通常会被拒绝。本研究中,倒漏斗图、Begg's、Egger's检验结果及失安全系数显示不存在发表偏倚,进一步说明本研究的结果可信度较高。
本研究还存在一些缺陷。首先,本研究纳入的文献均为已在国内外公开发表的,并未收集尚未发表的相关文献,以及会议摘要,因此有可能产生一定的偏倚;其次,受条件所限,本研究只选择了容易查到原始全文的文献,易造成选择偏倚;此外,本研究只选择了英文和中文文献,也属于一种选择偏倚。这些不足也可能会对结果造成一定的影响。虽然本研究存在一定的局限性,但通过Meta分析结果表明,PET/CT是一种相对准确的无创成像技术,在诊断NSCLC纵隔淋巴结分期中有着较高的准确度,与其他研究的结论一致[43,44]。
总之,PET/CT为NSCLC纵隔淋巴结分期的诊断提供了重要依据,为治疗方案的选择提供依据,具有较高的临床应用价值。
[1] 李亚伦. F-18 FDG PET/CT在肺癌诊断中的应用价值. 中华肺部疾病杂志(电子版), 2011(6): 507-509.
[2] Schreyögg J, Weller J, Stargardt T, et al. Cost-effectiveness of hybrid PET/CT for staging of non-small cell lung cancer. J Nucl Med, 2010, 51(11): 1668-1675.
[3] 解朋, 赵卫威, 邓候富.18F-FDG PET/CT在非小细胞肺癌TNM分期中的价值. 中国肺癌杂志, 2009, 12(2): 162-164.
[4] Pieterman RM, van Putten JW, Meuzelaar JJ, et al. Preoperative staging of non-small-cell lung cancer with positron-emission tomography. N Engl J Med, 2000, 343(4): 254-261.
[5] Dietlein M, Weber K, Gandjour A, et al. Cost-effectiveness of FDG-PET for the management of potentially operable nonsmall cell lung cancer: priority for a PET-based strategy after nodal-negative CT results. Eur J Nucl Med, 2000, 27(11):1598-1609.
[6] van Tinteren H, Hoekstra OS, Smit EF, et al. Effectiveness of positron emission tomography in the preoperative assessment of patients with suspected non-small-cell lung cancer: the PLUS multicentre randomised trial. Lancet, 2002, 359(9315):1388-1393.
[7] Verboom P, van Tinteren H, Hoekstra OS, et al. Costeffectiveness of FDG-PET in staging non-small cell lung cancer: the PLUS study. Eur J Nucl Med Mol Imaging, 2003,30(11): 1444-1449.
[8] Maziak DE, Darling GE, Inculet RI, et al. Positron emission tomography in staging early lung cancer: a randomized trial.Ann Intern Med, 2009, 151(4): 221-228.
[9] Søgaard R, Fischer BM, Mortensen J, et al. Preoperative staging of lung cancer with PET/CT: cost-effectiveness evaluation alongside a randomized controlled trial. Eur J Nucl Med Mol Imaging, 2011, 38(5): 802-809.
[10] Whiting P, Rutjes AW, Reitsma JB, et al. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol, 2003, 3: 25.
[11] Zamora J, Abraira V, Muriel A, et al. Meta-disc: a software for meta-analysis of test accuracy data. BMC Med Res Methodol,2006, 6: 31.
[12] Graeter TP, Hellwig D, Hoffmann K, et al. Mediastinal lymph node staging in suspected lung cancer: comparison of positron emission tomography with F-18-fluorodeoxyglucose and mediastinoscopy. Ann Thorac Surg, 2003, 75(1): 231-235.
[13] Keidar Z, Haim N, Guralnik L, et al. PET/CT using 18F-FDG in suspected lung cancer recurrence: diagnostic value and impact on patient management. J Nucl Med, 2004, 45(10):1640-1646.
[14] Halpern BS, Schiepers C, Weber WA, et al. Presurgical staging of non-small cell lung cancer: positron emission tomography,integrated positron emission tomography/CT, and software image fusion. Chest, 2005, 128(4): 2289-2297.
[15] Shim SS, Lee KS, Kim BT, et al. Non-small cell lung cancer:prospective comparison of integrated FDG PET/CT and CT alone for preoperative staging. Radiology, 2005, 236(3): 1011-1019.
[16] 李万龙, 于金明, 范廷勇, 等. 氟脱氧葡萄糖PET-CT对非小细胞肺癌纵隔淋巴结转移的诊断价值. 中华放射肿瘤学杂志, 2005, 14(3): 166-169.
[17] Bryant AS, Cerfolio RJ, Klemm KM, et al. Maximum standard uptake value of mediastinal lymph nodes on integrated FDGPET-CT predicts pathology in patients with non-small cell lung cancer. Ann Thorac Surg, 2006, 82(2): 417-422.
[18] Cerfolio RJ, Bryant AS, Ojha B. Restaging patients with N2 (stage IIIa) non-small cell lung cancer after neoadjuvant chemoradiotherapy: a prospective study. J Thorac Cardiovasc Surg, 2006, 131(6): 1229-1235.
[19] 张闻瑞, 郑健, 赵晋华, 等. 双探头符合线路18氟-脱氧葡萄糖单光子计算机断层显像术诊断非小细胞肺癌淋巴结转移的初步研究. 上海医学, 2006, 29(6): 349-352.
[20] Kim YK, Lee KS, Kim BT, et al. Mediastinal nodal staging of nonsmall cell lung cancer using integrated 18F FDG PET/CT in a tuberculosis-endemic country. Cancer, 2007, 109(6): 1068-1077.
[21] Tournoy KG, Maddens S, Gosselin R, et al. Integrated FDGPET/CT does not make invasive staging of the intrathoracic lymph nodes in non-small cell lung cancer redundant: a prospective study. Thorax, 2007, 62(8): 696-701.
[22] Lee BE, von Haag D, Lown T, et al. Advances in positron emission tomography technology have increased the need for surgical staging in non-small cell lung cancer. J Thorac Cardiovasc Surg, 2007, 133(3): 746-752.
[23] Yang W, Fu Z, Yu J, et al. Value of PET/CT versus enhanced CT for locoregional lymph nodes in non-small cell lung cancer.Lung cancer, 2008, 61(1): 35-43.
[24] Plathow C, Aschoff P, Lichy MP, et al. Positron emission tomography/computed tomography and whole-body magnetic resonance imaging in staging of advanced nonsmall cell lung cancer--initial results. Invest Radiol, 2008, 43(5): 290-297.
[25] Al-Sarraf N, Gately K, Lucey J, et al. Lymph node staging by means of positron emission tomography is less accurate in non-small cell lung cancer patients with enlarged lymph nodes:analysis of 1,145 lymph nodes. Lung Cancer, 2008, 60(1): 62-68.
[26] Billé A, Pelosi E, Skanjeti A, et al. Preoperative intrathoracic lymph node staging in patients with non-small-cell lung cancer:accuracy of integrated positron emission tomography and computed tomography. Eur J Cardiothorac Surg, 2009, 36(3):440-445.
[27] Sanli M, Isik AF, Zincirkeser S, et al. Reliability of positron emission tomography-computed tomography in identif i cation of mediastinal lymph node status in patients with non-small cell lung cancer. J Thorac Cardiovasc Surg, 2009, 138(5):1200-1205.
[28] Perigaud C, Bridji B, Roussel JC, et al. Prospective preoperative mediastinal lymph node staging by integrated positron emission tomography-computerised tomography in patients with non-small-cell lung cancer. Eur J Cardiothorac Surg, 2009, 36(4): 731-736.
[29] Lee JW, Kim BS, Lee DS, et al. 18F-FDG PET/CT in mediastinal lymph node staging of non-small-cell lung cancer in a tuberculosis-endemic country: consideration of lymph node calcif i cation and distribution pattern to improve specif i city. Eur J Nucl Med Mol Imaging, 2009, 36(11): 1794-1802.
[30] Jeon TY, Lee KS, Yi CA, et al. Incremental value of PET/CT over CT for mediastinal nodal staging of non-small cell lung cancer: Comparison between patients with and without idiopathic pulmonary f i brosis. Am J Roentgenol, 2010, 195(2):370-376.
[31] Sit AK, Sihoe AD, Suen WS, et al. Positron-emission tomography for lung cancer in a tuberculosis-endemic region.Asian Cardiovasc Thorac Ann, 2010, 18(1): 33-38.
[32] Tasci E, Tezel C, Orki A, et al. The role of integrated positron emission tomography and computed tomography in the assessment of nodal spread in cases with non-small cell lung cancer. Interact Cardiovasc Thorac Surg, 2010, 10(2): 200-203.
[33] Li XD, Yin JL, Liu WK, et al. Value of positron emission tomography-computed tomography in the diagnosis of mediastinal lymph node metastasis of non-small cell lung cancer. Nan Fang Yi Ke Da Xue Xue Bao, 2010, 30(3): 506-508.
[34] 杨洪. PET/CT对非小细胞肺癌纵隔淋巴结转移的临床研究. 中国医药指南, 2011, 9(24): 27-29.
[35] Hu M, Han A, Xing L, et al. Value of dual-time-point FDG PET/CT for mediastinal nodal staging in non-small-cell lung cancer patients with lung comorbidity. Clin Nucl Med, 2011,36(6): 429-433.
[36] Darling GE, Maziak DE, Inculet RI, et al. Positron emission tomography-computed tomography compared with invasive mediastinal staging in non-small cell lung cancer: results of mediastinal staging in the early lung positron emission tomography trial. J Thorac Oncol, 2011, 6(8): 1367-1372.
[37] Li M, Wu N, Liu Y, et al. Regional nodal staging with 18F-FDG PET-CT in non-small cell lung cancer: additional diagnostic value of CT attenuation and dual-time-point imaging. Eur J Radiol, 2012, 81(8): 1886-1890.
[38] Kubota K, Murakami K, Inoue T, et al. Additional value of FDG-PET to contrast enhanced-computed tomography (CT)for the diagnosis of mediastinal lymph node metastasis in nonsmall cell lung cancer: a Japanese multicenter clinical study.Ann Nucl Med, 2011, 25(10): 777-786.
[39] 谢和宾, 童瑶, 彭翔, 等. PET/CT诊断肺癌的准确度及其证实偏倚校正的研究. 中国医学影像学杂志, 2010, 18(6):529-531.
[40] Yi CA, Lee KS, Kim BT, et al. Eff i cacy of helical dynamic CT versus integrated PET/CT for detection of mediastinal nodal metastasis in non-small cell lung cancer. Am J Roentgenol,2007, 188(2): 318-325.
[41] Zamora J, Abraira V, Muriel A, et al. Meta-Disc: a software for meta-analysis of test accuracy data. BMC Med Res Methodol,2006, 6(1): 31.
[42] 杨克虎. 系统评价指导手册. 北京: 人民卫生出版社, 2010:179-213.
[43] Lv YL, Yuan DM, Wang K, et al. Diagnostic performance of integrated positron emission tomography/computed tomography for mediastinal lymph node staging in non-small cell lung cancer: a bivariate systematic review and metaanalysis. J Thorac Oncol, 2011, 6(8): 1350-1358.
[44] Zhao L, He ZY, Zhong XN, et al. 18FDG-PET/CT for detection of mediastinal nodal metastasis in non-small cell lung cancer: a meta-analysis. Surg Oncol, 2012, 21(3): 230-236.
