二烯丙基二硫活化NADPH氧化酶诱导人白血病K562细胞凋亡
2014-12-07伍尤华李林蔚
易 岚,伍尤华,谭 晖,何 洁,李林蔚,单 健,苏 琦
(南华大学1.肿瘤研究所、2.药学与生物科学学院、3.附属第一医院肿瘤科,湖南 衡阳 421001)
诱导肿瘤细胞凋亡已经成为治疗肿瘤的新方法之一[1]。研究表明[2],众多的细胞因子和药物具有诱导肿瘤细胞凋亡的能力。其中,大蒜及其烯丙基硫化物的抗癌作用正日益受到关注。研究显示,二烯丙基二硫(diallyl disulfide,DADS),大蒜主要有效成分之一,可诱导胃癌、肺癌、结肠癌等多种肿瘤细胞凋亡[3]。我们前期工作已经证实,DADS不仅可诱导人结肠癌等细胞分化与凋亡,而且可诱导人白血病细胞分化与凋亡[4]。DADS对人白血病细胞具有双效作用,小剂量DADS(<1.25 mg·L-1)诱导人白血病细胞分化,其机制与抑制JAK1/STAT3的酪氨酸激酶活性、下调STAT3与Myc核内表达水平,提高组蛋白乙酰化水平及p21WAF1表达上调有关[5]。而中等剂量 DADS(>1.25 mg·L-1)可诱导人白血病细胞凋亡,其机制与G2/M期阻滞,活性氧,抑制 ERK 和激活 p38,下调 Bag-1、Bcl-2,上调Fas-L、Bax 等有关[6-7]。但具体机制尚不清楚。
在前期工作的基础上,我们应用蛋白质组学技术筛选出7个与DADS诱导人白血病细胞凋亡的相关的差异蛋白,其中Ras-related C3 botulinum toxin substrate 2(Rac2)表达明显上调[8],Rac2 是 NADPH氧化酶的6个亚基之一,是NADPH氧化酶活化必不可少的。NADPH氧化酶的激活受高度调控,在此过程中,Rac2与 p67phox相互作用起着关键作用[9]。NADPH氧化酶是诱导产生ROS的主要来源之一,而ROS可触发多种信号转导途径,引起细胞凋亡。本研究在前期工作的基础上,研究DADS活化NADPH氧化酶,通过活性氧途径诱导人白血病K562细胞凋亡,进一步阐明白血病的发病机制,为白血病的诱导凋亡治疗提供新思路。
1 材料与方法
1.1 药品及试剂 DADS为Fluka公司产品,小牛血清是杭州四季青生物工程公司产品。BCA蛋白定量试剂盒为Pierce公司产品。RNA抽提试剂盒Ⅱ为Omega公司产品,TRIzol试剂为Invitrogen Life Technologies产品。免疫共沉淀试剂盒为Santa Cruz公司产品。2',7'-二氯氢化荧光素二脂(DCFHDA)、phorbol myristate acetate(PMA)、diphenyleneiodonium(DPI)、Rac2、p67phox等试剂为 Santa Cruz公司产品。二抗为Abcam Biotechnology公司产品。
1.2 方法
1.2.1 细胞培养 细胞培养采用常规培养,培养液为含10%小牛血清的RPMI 1640,在37℃,饱和湿度,5%CO2孵箱中培养,每3~4 d换液传代。取对数生长期细胞用于实验,DADS用培养基稀释到所需浓度。
1.2.2 MTT检测 用含10%胎小牛血清的培养液配成单个细胞悬液,以每孔103~104个细胞接种到96孔板,每孔体积100 μl,设3个复孔。加入处理因素并设0对照、空白对照、溶酶对照和不同浓度DADS处理组。在37℃,饱和湿度,5%CO2孵箱中常规培养,继续培养72 h。于结束前4 h除对照组外,每孔加 MTT溶液(5 g·L-1用 PBS配制,pH=7.4)20 μl,继续孵育 4 h,终止培养。离心后再吸弃孔内培养上清液。每孔加150 μl DMSO,振荡10 min,充分融解结晶物。酶联免疫检测仪上测各孔吸光度,检测波长570 nm,按下列公式计算抑制率(IR%)。

1.2.3 Real-time PCR引物合成 利用 Primer Premier 5.0软件进行引物设计,送交宝生物工程大连有限公司合成。实时定量PCR使用的管家基金(β-actin)以及NADPH氧化酶的6个亚基引物分别为如下所示。β-actin正义引物序列为5'-CCTGTACGCCAACACAGTGC-3',反义引物序列为:5'-ATACTCCTGCTTGCTGATCC-3',产物长度为211bp;NCF2正义引物序列为:5'-GAAGAAGGGCAATGATAACTGG-3',反义引物序列为:5'-TAGGAGGAGCTGGGATGTCG-3',产物长度为155bp;RAC2正义引物序列为:5'-TCATCTGCTTCTCCCTCGT-3',反义引物序列为:5'-GATGGTGTCCTTGTCGTCC-3',产物长度为143bp;CYBB正义引物序列为:5'-CAAGATGCGTGGAAACTACCT-3',反义引物序列为:5'-TGACTTGAGAATGGATGCGAA-3',产物长度为138bp;CYBA正义引物序列为:5'-ATTGTGGCGGGCGTGTTT-3',反义引物序列为:5'-CACGGCGGTCATGTACTTCTGT-3',产物长度为 102bp;NCF1正义序列为:5'-ACCCTGAGCCCAACTATGC-3',反义序列为:5'-GGACGGGAAGTAGCCTGTG-3',产物长度为170bp;NCF4正义引物序列为:5'-CAGCCTGATGCCTCCTTACTC-3',反义引物序列为:5'-TCTGGAACTCCCGCCTTGT-3',产物长度为120bp。按照Total RNA KitⅡ说明书提取细胞总RNA,用紫外分光光度计测定RNA的纯度和浓度。cDNA合成:将2 μg的总RNA 72℃ 10 min预变性,冰上冷却3 min后,按RT试剂盒说明书依次加入各试剂,建立一个总反应体积20 μl的体系,42℃90 min,冰上冷却2 min,-20℃保存备用。Realtime PCR扩增:将标准曲线样品和待测样品分别加入到Real-time PCR反应液中,进行Real-time PCR扩增和检测。几个梯度稀释的DNA模板以及所有cDNA样品分别配置总体积为25 μl反应体系,置于Real-time PCR仪上进行PCR反应。每个样品的目的基因浓度除以其管家基因的浓度,即为此样品此基因的校正后的相对含量。
1.2.4 细胞内活性氧检测 收集细胞,用Hanks液洗涤细胞 2 次,加入终浓度为 10 μmol·L-1的DCFH-DA 400 μl,充分混匀,在37℃条件下避光反应50 min,用Hanks液洗涤细胞3次以去除细胞外荧光剂,用500 μl Hank's液重悬细胞,37℃条件下水浴10 min,流式细胞仪分析荧光强度,激发波长488 nm,发射波长530 nm。
1.2.5 Western blot检测 细胞裂解:分别收集各组细胞,冰PBS洗两次,每1×107个细胞浓度加入100 ~150 μl裂解液(100 mmol·L-1NaCl,10 mmol·L-1Tris-HCl pH 7.6,1 mmol·L-1EDTA pH 8.0,1 mg·L-1Aprotinin,100 mg·L-1PMSF),冰上裂解1 h,4℃,12 000 r·min-1离心 10 min,上清液即为细胞总蛋白。根据Bradford法进行蛋白含量的测定。蛋白变性后经10%SDS-聚丙烯酰胺凝胶电泳后转移至PVDF膜上,用含5%牛血清白蛋白的TBST(Tris-HCL 20 mmol·L-1,NaCl 137 mmol·L-1含0.1%Tween-20)封闭1 h,用特异性一抗4℃孵育过夜,TBST洗3次,每次5 min,相应的二抗孵育1 h,TBST洗3次,每次5 min,化学发光剂检测蛋白质印迹,薄层扫描仪测定印迹区带的光密度值。
1.2.6 免疫共沉淀 按照Seize Classic Mammalian Immunoprecipitation试剂盒说明书进行,将得到抗体复合物进行SDS-PAGE电泳,再进行Western blot检测。
1.3 统计学处理 采用SPSS 12.0统计分析软件,Student't-test法进行差异显著性检验,数值用±s表示,用Sigma Plot10.0软件进行绘图。
2 结果
2.1 MTT检测DADS对K562细胞的增殖抑制作用 如 Tab 1 所示,2.5、5.0、10.0、20.0、40.0 mg·L-1DADS处理人白血病K562细胞,抑制率分别为32.48%、59.34%、66.42%、81.05%、87.09%,抑制率呈浓度依赖性增加(P<0.05)。Tween80对照组对细胞增殖无明显抑制作用(P>0.05)。这些结果表明,DADS以剂量依赖性抑制K562细胞的生长。IC50值在 5.0 mg·L-1左右。

Tab 1 OD570value of different concentrations of DADS treated K562 cells for 48 hours
2.2 DADS诱导K562细胞凋亡过程中 NADPH氧化酶各亚基mRNA表达水平 Real-time PCR结果如Fig 1所示,6 mg·L-1DADS作用K562细胞6 h后,NADPH氧化酶复合物的6个亚基(包括CYBA、CYBB、NCF1、NCF2、NCF4 和 RAC2)相对定量的值分别为1.31×10-3±1.1×10-4、9.85 ×10-4±2.3 ×10-5、1.01 ×10-3±1.1 ×10-4、3.94 ×10-5±3.3 ×10-6、1.65 ×10-3±2.1 ×10-4、1.48 ×10-3±1.8×10-4,较处理前的 1.08 ×10-3±1.3×10-4、4.03×10-4±1.1×10-5、2.57 ×10-4±2.0 ×10-5、1.67×10-5±2.5 ×10-6、1.22 ×10-3±1.2 ×10-4、1.04×10-3±1.4 ×10-4,NADPH 氧化酶各亚基mRNA水平都明显上调(P<0.05)。

Fig 1 Real-time PCR analysis of mRNA levels of components of the NADPH oxidase in K562 cells treatedby 6 mg·L -1DADS for 6 hours
2.3 Rac2在DADS诱导K562细胞凋亡过程中表达上调 Rac2对NADPH氧化酶(NADPH oxidase)的6个亚基之一,Rac2是NADPH氧化酶活化是必不可少的。Western blot分析结果如Fig 2所示,与对照组相比,5.0、10.0 mg·L-1DADS 作用 K562 细胞24 h后,蛋白 Rac2的表达水平明显上调(P<0.05)。
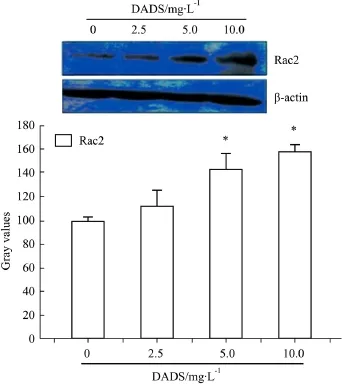
Fig 2 Western blot analysis of expression of Rac2 in K562 cellsinduced by different concentrations of DADS
2.4 免疫共沉淀检测NADPH氧化酶亚基Rac2与p67phox结合 免疫共沉淀结果如Fig 3所示,通过用Anti-Rac2沉淀K562细胞的裂解蛋白,Western blot检测到 p67phox存在。实验结果表明在DADS诱导的 K562细胞凋亡过程中,有 Rac2和p67phox的结合,即存在NADPH氧化酶的活化。

Fig 3 Western blot analysis p67phox in K562 cells after subsided by Anti-Rac2
2.5 NADPH氧化酶激活剂和抑制剂对DADS诱导K562细胞凋亡的影响 我们采用NADPH氧化酶的激活剂PMA和NADPH氧化酶的黄素蛋白抑制剂DPI来进一步研究NADPH氧化酶对DADS诱导K562细胞凋亡的影响。
流式细胞术检测凋亡细胞百分率结果如Fig 4所示,PMA单独作用K562细胞24 h,其凋亡细胞百分率为(10.2±1.04)%,PMA与6 mg·L-1DADS联合处理K562细胞24 h,凋亡细胞百分率为(40.5±2.03)%,与 DADS单独处理组(30.9% ±1.34)%相比,PMA能明显提高DADS诱导K562细胞凋亡的作用 (P<0.05),DPI单独作用K562细胞24 h,凋亡细胞百分率为(3.35±0.76)%,可见,DPI并未能诱导K562细胞凋亡。DPI与6 mg·L-1DADS联合处理K562细胞24 h,凋亡细胞百分率为(17.3±1.03)%,实验结果表明DPI能抑制DADS诱导K562细胞凋亡(P<0.05)。
2.6 NADPH氧化酶的活化是DADS诱导K562细胞活性氧主要来源 流式细胞术检测DCF的荧光强度结果如Fig 5所示,对照组、6 mg·L-1DADS处理K562细胞8 h组、PMA单独处理组、DADS和PMA联合处理组、DPI单独处理组、DADS和DPI联合处理组,流式细胞术检测DCF的荧光强度分别为10.2±0.98、33.0±1.65、30.5±1.73、43.7±1.76、10.0±0.98、11.8 ±0.95,可见,PMA 能提高DADS诱导K562细胞活性氧的水平(P<0.05),而DPI明显抑制了DADS作用的K562细胞活性氧的产生(P<0.05)。
3 讨论
诱导肿瘤细胞凋亡已经成为治疗肿瘤的一种新的可能性[10]。众多的细胞因子和药物都能诱导肿瘤细胞凋亡,其中,大蒜及其烯丙基硫化物的抗肿瘤作用已日益引起人们的关注。DADS作为大蒜提取物中最有效的成分,可以诱导多种肿瘤细胞包括人慢性髓细胞性白血病K562细胞系凋亡,但是其具体机制还有待于进一步研究。我们前期工作已经表明,低剂量(<1.25 mg·L-1)的DADS具有抗增殖作用,能诱导K562细胞分化[11]。本研究用中等浓度(2.5~20 mg·L-1)DADS来诱导K562细胞凋亡。在我们前期工作的基础上,本研究进一步证实了DADS对K562细胞的生长抑制作用。MTT实验结果表明,DADS以剂量依赖方式抑制K562细胞的活性。
本研究 Real-time PCR结果显示,6 mg·L-1DADS作用K562细胞6h后,NADPH氧化酶复合物的6 个亚基(包括 CYBA、CYBB、NCF1、NCF2、NCF4和RAC2)的mRNA水平都明显上调(P<0.05)。Rac2是NADPH氧化酶(NADPH oxidase)的6个亚基之一,Rac2的活化是NADPH氧化酶活化是必不可少的。Western blot分析结果表明,与对照组相比,5.0、10.0 mg·L-1DADS 作用人白血病 K562 细胞24 h后蛋白 Rac2的表达水平明显上调(P<0.05)。这些研究结果表明DADS诱导K562细胞凋亡的过程中有NADPH氧化酶的活化。
有研究表明,NADPH氧化酶有6个亚基,在NADPH氧化酶活化过程中,Rac2与p67phox结合是NADPH氧化酶的活化非常关键的环节[12]。因此我们应用免疫共沉淀方法来检测DADS诱导K562细胞凋亡的过程中Rac2与p67phox是否结合,进一步研究在DADS诱导人白血病K562细胞凋亡过程中,是否有NADPH氧化酶的活化。免疫共沉淀结果显示,通过用Anti-Rac2沉淀K562细胞的裂解蛋白,Westernblot检测到p67phox存在。实验结果表明在DADS诱导的K562细胞凋亡过程中,有Rac2和p67phox的结合,也进一步说明有NADPH氧化酶的活化。

Fig 4 Flow cytometry analysis of percentage of apoptosis cells in K562 cells
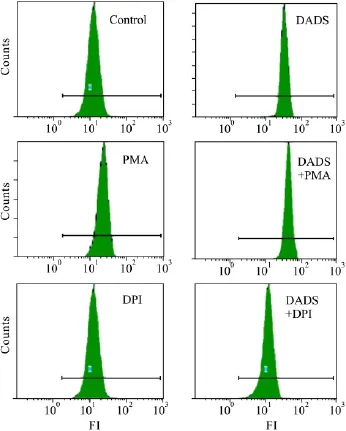
Fig 5 Flow cytometry analysis DCF fluorescence intensities of K562 cells
为进一步研究NADPH氧化酶与DADS诱导K562细胞凋亡的关系,我们采用NADPH氧化酶的激活剂PMA和NADPH氧化酶的黄素蛋白抑制剂DPI来研究NADPH氧化酶对DADS诱导K562细胞凋亡的影响。流式细胞术检测凋亡细胞百分率结果显示,PMA与DADS联合处理组凋亡细胞百分率明显高于与DADS单独处理组,而DPI与DADS联合处理组凋亡细胞百分率为明显低于DADS单独处理组。实验结果表明,PMA能明显提高DADS诱导K562细胞凋亡的作用,而DPI能抑制DADS诱导K562细胞凋亡。可见,NADPH氧化酶与DADS诱导K562细胞凋亡密切相关。
研究表明,DADS能诱导肿瘤细胞产生活性氧,产生的活性氧和肿瘤细胞的进一步的命运包括凋亡密切相关[13-14]。我们的前期研究结果显示,DADS诱导K562细胞凋亡过程中活性氧水平明显提高[7]。但是活性氧有多种来源,这些活性氧的来源并不确定,NADPH氧化酶的活化是活性氧的一个重要来源之一[15]。尽管我们的研究已经表明,在DADS诱导人白血病细胞凋亡的过程既有NADPH氧化酶的活化,又有活性氧的产生,但是NADPH氧化酶的活化是不是活性氧的主要来源还有待于进一步研究。因此我们用PMA及DPI预处理细胞,以便检测DADS诱导K562细胞凋亡过程中活性氧的水平,以确定NADPH氧化酶的活化是否DADS诱导K562细胞凋亡过程中活性氧主要来源。流式细胞术检测DCF的荧光强度结果显示,PMA明显提高了DADS诱导K562细胞活性氧的水平,而DPI预处理的细胞却没有活性氧的产生。这些结果表明,NADPH氧化酶是DADS诱导K562细胞凋亡过程中活性氧的主要来源。
NADPH氧化酶在多种肿瘤组织中的表达异于组织来源相同的正常组织,其催化产生的活性氧,可以诱导一系列细胞因子,调节细胞周期,调节肿瘤发生、发展和血管生成等等,这些为研究肿瘤发生和治疗提供了新的思路。本研究结果不仅表明DADS诱导K562细胞凋亡的过程中有NADPH氧化酶的活化,而且证实了NADPH氧化酶的活化是DADS诱导K562细胞凋亡过程中活性氧产生的主要来源。因此,NADPH氧化酶的活化在DADS诱导人白血病K562细胞凋亡中起着重要作用。当然,DADS诱导人白血病细胞凋亡的确切机制还有待于进一步研究。
[1]Schulze-Bergkamen H,Krammer P H.Apoptosis in cancer-implications for therapy[J].Semin Oncol,2004,31(1):90 -119.
[2]Ferreira I C,Vaz J A,Vasconcelos M H,Martins A.Compounds from wild mushrooms with antitumor potential[J].Anticancer A-gents Med Chem,2010,10(5):424-36.
[3]Yi L,Su Q.Molecular mechanisms for the anti-cancer effects of diallyl disulfide[J].Food Chem Toxicol,2013,57:262 -70.
[4]Huang Y S,Xie N,Su Q,et al.Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J].Mol Med Report,2011,4(3):553 -9.
[5]黄卫国,谭 晖,易 岚,等.二烯丙基二硫上调p21、STAT1和CAMTA1诱导人白血病K562细胞分化[J].中国药理学通报,2010,26(4):513-6.
[5]Huang W G,Tan H,Yi L,et al.Diallyl disulfide up-regulate p21,STAT1 and CAMTA1 induce differentiation of human leukemia HL-60 cells[J].Chin Pharmacol Bull,2010,26(4):513 -6.
[6]Tan H,Ling H,He J,et al.Inhibition of ERK and activation of p38 are involved in diallyl disulfide induced apoptosis of leukemia K562 cells[J].Arch Pharm Res,2008,31(6):786 -93.
[7]易 岚,谭 晖,吉晓霞,等.DADS通过活性氧介导的JNK信号通路诱导人白血病K562细胞凋亡[J].中国药理学通报,2013,29(4):473-7.
[7]Yi L,Tan H,Ji X X,et al.Diallyl disulfide induces apoptosis in human leukemia K562 cells through activation of JNK mediated by reactive oxygen[J].Chin Pharmacol Bull,2013,29(4):473 -7.
[8]Yi L,Zeng X,Tang H,et al.Proteomics analysis of apoptosis initiation induced by diallyl disulfide in human leukemia K562 cells[J].Chin J Cancer,2009,28(1):43 -8.
[9]Wen S,Zhu D,Huang P.Targeting cancer cell mitochondria as a therapeutic approach[J].Future Med Chem,2013,5(1):53-67.
[10]László K,István P.Selected aspects of cancer progression:metastasis,apoptosis and immune response[J].Apopt Cancer,2008,11:103-13.
[11]武明花,唐 黎,李利平,等.二烯丙基二硫对K562细胞的生长抑制和诱导分化作用[J].中华血液学杂志,2004,25(5):300-2.
[11]Wu M H,Tang L,Li L P,et al.The effect of Diallyl disulfide on cell growth inhibition and differentiationof K562[J].Chin J Hematol,2004,25(5):300 -2.
[12]Elnakish M T,Hassanain H H,Janssen P M,et al.Emerging role of oxidative stress in metabolic syndrome and cardiovascular diseases:important role of Rac/NADPH oxidase[J].J Pathol,2013,231(3):290-300.
[13]Wu W S.The signaling mechanism of ROS in tumor progression[J].Cancer Metastasis Rev,2006,25(4):695 -705.
[14]Kadara H,Tahara E,Kim H J,et al.Involvement of Rac in Fenretinide-Induced Apoptosis[J].Cancer Res,2008,68(11):4416-23.
[15]El-Benna J,Dang P M,Gougerot-Pocidalo M A.Priming of the neutrophil NADPH oxidase activation:role of p47phox phosphorylation and NOX2 mobilization to the plasma membrane[J].Semin Immunopathol,2008,30(3):279 -89.
