蛇床子素对髓核致神经根炎性痛大鼠ERK/MAPK信号通路及COX-2 mRNA表达的影响
2014-12-07吴海璇冯璐璐贺秋兰李梅娜孙来保邹学农
吴海璇,冯璐璐,徐 辉,贺秋兰,李梅娜,魏 明,孙来保,邹学农
(中山大学附属第一医院1.麻醉科、2.骨科,广东广州 510080;3.中山大学附属第二医院麻醉科,广东广州 510120)
椎间盘突出导致的腰腿痛是一种常见病,造成了巨大的社会负担和经济负担。传统的非手术治疗方法,如硬膜外腔注射糖皮质激素和局麻药虽可在短期内一定程度上缓解疼痛,但其长期疗效遭到质疑[1]。蛇床子素又名甲氧基欧芹酚(osthol,Ost),是从伞形科植物蛇床成熟果实蛇床子(Fructus Cnidii)中提取的香豆素类化合物。现代药理研究发现,蛇床子素具有多种生物学活性,如抗心律失常、抗氧化、抗炎、抗过敏、抗骨质疏松、抗肿瘤及抗细胞凋亡等[2-3]。其中,抗炎镇痛作用尤为突出[4]。当前研究表明炎症因素在盘源性腰腿痛(discogenic low back pain,DLBP)的发病中扮演着不容忽视的重要作用[5]。蛇床子素抗炎作用明显,能从多个环节作用于DLBP的形成和发展过程,研究并阐明其在治疗DLBP中的价值和具体作用机制对于开发新的治疗药物具有重要意义。本课题组在前期研究中已发现硬膜外腔注射蛇床子素的镇痛作用与抑制L4-6背根神经节中环氧合酶-2(cyclooxygenase-2,COX-2)[6]、一氧化氮合酶(nitricoxide synthase,NOS)[7]、酸敏感性离子通道3(acid-sensing ion channel 3,ASIC3)[8]和降钙素基因相关肽受体1(calcitonin gene-related peptide receptor 1,CGRPR1)的表达有关,但蛇床子素在脊髓水平的镇痛机制尚待进一步阐明。脊髓背角细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路是细胞内信号转导的主要通路之一,在接受伤害性信号刺激后静息态的ERK可被激活为磷酸化ERK(pERK),从而启动下游一系列的适应性反应,将伤害性信号传入胞内。因此,本研究通过探讨硬膜外注射蛇床子素对大鼠腰段脊髓背角ERK通路及对该通路所调控的基因表达的影响,初步阐明蛇床子素在脊髓水平的镇痛机制,为蛇床子素的临床应用奠定理论基础。
1 材料与方法
1.1 实验动物 SPF级成年♂ SD大鼠125只,体质量250~300 g,由中山大学实验动物中心提供,许可证号:SCXK(粤)2008-0002。分笼饲养,室温(23±2)℃,维持大鼠12/12昼夜节律(每日8∶00~20∶00光照)。本实验严格遵守中山大学动物保护和使用规定。
1.2 主要试剂及仪器 蛇床子素(110822-200407,广州市药品检验所)用二甲亚砜(DMSO,Sigma,USA)溶解;兔抗鼠 pERK一抗(4370S,Cell Signaling,USA);兔抗鼠 ERK 一抗(BS1112,Bioworld technology,USA);羊抗兔生物素化二抗(BA1003,武汉博士德生物工程有限公司);DAB显色试剂盒(AR1022,武汉博士德生物工程有限公司);TRlzol Reagent(15596-026,Invitrogen公司);Taq DNA 聚合酶(DR001A,TaKaRa公司);逆转录试剂盒和dNTPs购自 Qiagen公司;Frey纤毛仪(Stoelting公司,USA);CFX96荧光定量 PCR仪(美国 Bio-Rad公司)。
1.3 动物模型建立、分组及处理
1.3.1 动物模型建立 参照文献[7]建立动物模型,10%水合氯醛麻醉大鼠(3.5 ml·kg-1,ip.),以髂嵴最高点连线为中心做3 cm左右正中切口,切除左侧L5下关节突、L6上关节突和L5半椎板,暴露左侧L5背根神经节。取鼠尾近段根部自体髓核(约0.4 mg),置于L5背根神经节上。将PE-10导管向头侧硬膜外腔轻柔置入约4 mm,另一端从颈后引出封管。术后大鼠单笼饲养,用2%利多卡因10 μl判断导管位置(注射30 s内出现双后肢麻痹说明导管位置正确)。Sham组取尾部自体髓核组织,但不将其置于暴露部位,余操作同上。
1.3.2 动物分组及处理 成年♂ SD大鼠125只,随机分为5组,每组25只,分别为 Blank组、Sham组、NP组、Ost组、Vehicle组,其中Ost组于术后d 6于硬膜外腔给予 82 mmol·L-1蛇床子素 50 μl,即 1 mg·rat-1蛇床子素,Vehicle组给予 10%DMSO 50 μl。各组大鼠分别于术前 1 d,术后 3、6、7、10、14、21 d测定50%机械痛缩足阈值(50%mechanical withdrawal threshold,50%MWT),在术后 14 d 测定机械痛阈后,每组随机取15只大鼠,取术侧腰段脊髓背角,Western blot法检测ERK、pERK蛋白的表达,荧光定量PCR法检测COX-2 mRNA的表达。
1.4 50%机械痛缩足阈值 (50%mechanical withdrawal threshold,50%MWT)在制模前,将 SD大鼠每日9∶00~16∶00放于有机玻璃箱中适应环境,并测定术前1 d的基础值。术后的行为学测试时间定于9∶00~16∶00进行,测试前所有大鼠均在玻璃箱中适应30 min,待安静后进行测试。根据Chaplan等[9]报道的方法稍加改进,检测50%MWT:大鼠置于透明有机玻璃箱内自由活动,安静后以不同折力的von Frey纤毛刺激大鼠足底,避开肉垫使之稍成S形,持续6~8 s。大鼠后肢迅速畏缩、撤回,认为是阳性反应。从2 g开始,当该力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则给予相邻小一级力度的刺激,如此连续进行,每个强度反复刺激5次,将出现3次以上阳性反应的最小von Frey纤维强度定为大鼠的50%MWT。两次刺激之间至少间隔约15 s。
1.5 Western blot检测脊髓背角神经元中ERK1/2和pERK1/2蛋白表达水平 大鼠深麻醉后,在冰面上迅速取出术侧腰段脊髓背角,加入含蛋白酶抑制剂的细胞裂解液中(50 mmol·L-1Tris HCl(pH 7.5),5 mmol·L-1EDTA,150 mmol·L-1NaCl,10 ml·L-1Triton X-100),超声匀浆、水浴、高速离心后取上清。每次电泳前各组样品随机取一管上样测蛋白浓度,以SDS-PAGE凝胶电泳,转膜后用脱脂牛奶封闭2 h后,在4℃条件下与ERK或pERK一抗(1∶1 000)或抗GAPDH(1∶1 000)共孵育48 h,再与二抗(1∶2 500)室温下孵育2 h。将膜与ECL试剂反应后依次压片、显影、定影,用Image J 6.0软件采集胶片条带灰度值。实验重复3次,将每次实验中各样品灰度值与内参GAPDH灰度值相除作为ERK或pERK蛋白相对含量。
1.6 荧光定量RT-PCR法检测COX-2表达水平取脊髓背角组织,按TRIzol抽提法提取总RNA,紫外吸收测定法检测RNA浓度和纯度。取适量RNA为模板逆转录得cDNA,-20℃保存待用。采用Primer5.0设计基因特异性引物。COX-2引物序列:5'-CTGAGGGGTTACCACTTCCA-3'(上游),5'-TGAGCAAGTCCGTGTTCAAG-3'(下游);内参 β-actin引物序列:5'-AGCCATGTACGTAGCCATCC-3'(上游),5'-CTCTCAGCTGTGGTGGTGAA-3'(下游),上述引物均由上海生物工程公司合成。PCR反应体系:SYBR Green 1 染料 10 μl,上游引物1 μl,下游引物 1 μl,dNTP 1 μl,Taq 聚合酶 2 μl,待测样品 cDNA 5 μl,双蒸水 30 μl。PCR 体系反应条件:预变性94℃4 min,变性94℃30 s,退火60℃30 s,延伸72℃ 30 s,共30个循环,终延伸72℃ 7 min。实时分析软件计算每个标本的循环阈值(Ct值),运用Bio-Rad CFX96荧光定量PCR仪配套的Bio-Rad CFX Manager Software1.6数据分析软件进行分析,且采用 2-ΔΔCt法来计算。
1.7 数据统计方法 应用SPSS 13.0软件进行统计分析。计量资料以±s表示。用Levene法检测各组样本方差是否齐性。方差齐性时,术后同组间不同时间点的50%MWT比较采用重复测量设计的Friedman ANOVA方差分析,术后同一时间点不同组间的50%MWT、ERK及pERK相对蛋白浓度和COX-2 mRNA含量比较采用One-way ANOVA方差分析,差异有统计学意义时用LSD法行两两比较;方差不齐时,同组间50%MWT比较采用多因素方差分析,组间比较采用Kruskal-Walllis秩和检验,两两比较采用Dunnett T3检验,P<0.05时认为差异有统计学意义。pERK和COX-2 mRNA的相关性分析采用Speraman秩相关分析法,P<0.05时认为差异有统计学意义。
2 结果
2.1 各组大鼠硬膜外腔给药前后50%MWT的变化 各组大鼠术前的50%MWT比较,差异无统计学意义(P>0.05)。与Blank组相比,Sham组仅在术后d 1 50%MWT降低有统计学意义,后逐渐恢复至术前水平,而NP组、Vehicle组和Ost组大鼠术后均出现术侧后肢50%MWT值明显降低(P<0.05),其中NP组和Vehicle组的痛阈降低一直持续至术后21 d。术后d 6,Vehicle组和Ost组分别于硬膜外腔给予相应药物,在给药后各时间点,与Vehicle组相比,Ost组50%MWT明显升高,差异有统计学意义(P<0.05)。
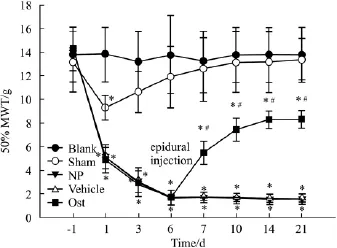
Fig 1 Comparison of 50%MWT before and after epidural application of drug in different groups of rats
2.2 术后d 13各组大鼠脊髓背角ERK表达的变化 硬膜外腔给药后8 d,即术后d 14,各组大鼠脊髓背角ERK的表达差异无统计学意义(P>0.05)。见Fig 2。
2.3 术后d 14各组大鼠脊髓背角pERK1/2蛋白表达的变化 术后d 14,Blank组和Sham组大鼠脊髓背角pERK1/2表达差异无统计学意义(P>0.05),NP、Ost和Vehicle组较Blank组表达增高(P<0.05)。与 Vehicle组相比,Ost组的 pERK1和pERK2表达均明显降低(P<0.05),NP组的pERK1和pERK2表达水平均较Vehicle组高(P<0.05)。见Fig 3。

Fig 2 Expression and relative concentration of ERK1/2 in different groups of rats on postoperative d14 after surgery

Fig 3 Expression and relative concentration of pERK1/2 in different groups of rats on postoperative day 14
2.4 术后d 14各组大鼠脊髓背角COX-2 mRNA表达的变化 硬膜外腔给药后8 d,即术后d 14,Sham组和Blank组脊髓背角细胞中COX-2 mRNA表达差异无统计学意义(P>0.05)。与Blank组相比,NP组和Vehicle组COX-2 mRNA表达均明显增高(P<0.01),Ost组 COX-2 mRNA表达略增加(P<0.05)。与 Vehicle组相比,Ost组 COX-2 mRNA表达明显降低(P<0.05)。见Fig 4。
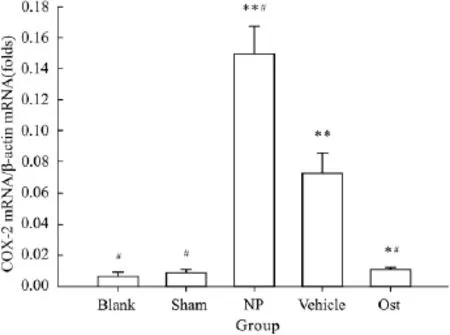
Fig 4 Relative expression of COX-2 mRNA in spinal dorsal horn of different groups of rats on postoperative day 13
2.5 各组大鼠脊髓背角pERK1/2与COX-2mRNA的相关性分析 对各组大鼠脊髓背角pERK与COX-2 mRNA行Spearman秩相关分析,pERK1和COX-2 mRNA秩相关系数r=0.878(P<0.01),pERK2和COX-2 mRNA秩相关系数r=0.910(P<0.01),表明各组大鼠脊髓背角pERK1/2与COX-2 mRNA表达呈正相关。
3 讨论
3.1 蛇床子素对ERK通路的影响 炎症导致的周围和中枢神经系统敏感性改变是引起痛觉过敏的主要原因。在脊髓水平,痛觉过敏的神经生理学改变主要表现为异位电活动增多、痛觉传递信号通路的持续激活以及突触传递效能的增强,这些神经元的可塑性变化构成神经根炎症时产生的痛觉过敏、触诱发痛以及痛辐射等疼痛症候群行为表现的基础[10]。丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)级联反应是细胞内最主要的共同信号转导系统之一,其中细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是 MAPK家族的重要成员。近年来研究发现,ERK信号通路作为一条将细胞外信息向细胞核传递的通路,在炎症反应、细胞的增殖和凋亡中均起着重要的调节作用。既往关于蛇床子素对于ERK通路的作用主要集中在神经保护[11]、细胞分化和抗骨质疏松等方面。本课题组在前期试验中已证实DRG暴露于髓核后,术后d 1脊髓背角浅层pERK蛋白的表达即明显上调,至少持续至术后21 d,与疼痛行为学改变相一致。且该炎性痛敏能被ERK通路拮抗剂所缓解,并伴有背角pERK表达减少,说明ERK信号通路参与髓核导致的神经根炎性痛。本实验在此基础上,于术后d 6硬膜外腔单次注射蛇床子素治疗髓核致炎大鼠的已形成了的神经根炎性痛,获得了确切、长期(21 d)有效的疼痛缓解效果,并伴有腰段脊髓背角pERK蛋白表达明显减少。我们的研究结果表明抑制脊髓背角pERK通路很可能是蛇床子素镇痛作用的重要机制之一。
3.2 ERK信号通路通过调控COX-2基因表达介导痛敏 伤害性刺激会使脊髓背角神经元的ERK发生磷酸化,磷酸化的ERK能从胞质转位至核内,激活相应的转录因子,进而启动基因转录,因此ERK通路可通过调节关键基因产物的转录导致痛觉过敏。研究表明[12],pERK调控的下游靶基因主要有 COX-2、CGRP、NK-1、强啡肽、内啡肽等。其中,COX-2是以花生四烯酸(AA)为底物生成前列腺素(PGs)过程中的限速酶。而前列腺素,尤其是前列腺素E2(PGE2),作为重要的炎症和促伤害介质,在外周和中枢敏感化方面起着十分重要的作用。研究发现,在局部注射完全弗氏佐剂、角叉菜胶及酵母多糖等引起的机械性痛觉过敏的过程中,脊髓背角中COX-2 mRNA和蛋白表达明显增高[13]。可见脊髓中COX-2在外周炎症诱发中枢机械性痛觉过敏的进程中起着重要作用。在本研究中,笔者发现在形成稳定的神经根炎性痛后pERK和COX-2 mRNA表达明显上调,且两者呈较强的正相关,由此可推测ERK信号通路激活后可通过调控COX-2基因的表达介导机械性痛觉过敏。
3.3 蛇床子素与盘源性腰腿痛的关系 随着近年来对盘源性腰腿痛机制研究的不断深入,大量研究结果表明,腰椎间盘突出物引起的临床疼痛症状和神经根体征与突出物的病理形态和对神经根的机械压迫无明确关系 ,而与局部炎症的联系极为紧密[14]。因此,我们推测蛇床子素主要是通过其强大的免疫调节和抗炎效应达到缓解DLBP的作用。目前,蛇床子素治疗DLBP的机制主要可概括为以下几个方面:(1)通过抑制关键信号通路,减少炎性介质的表达[6,15],本研究证实了蛇床子素可通过抑制脊髓背角ERK信号转导通路,减少COX-2基因的表达,从而达到缓解机械通敏的作用;(2)通过对细胞膜上的某些离子通道,如Na+通道[16]、电压依赖性 L-钙通道[17]和 3 型酸敏感离子通道 ASIC3[8]等的直接调控作用,降低神经元兴奋性,防止中枢敏化的形成;(3)长期大量兴奋性递质的释放会导致中枢抑制性中间神经元对伤害性信息传递的抑制作用减弱,甚至引起抑制性神经元的凋亡,从而导致痛觉过敏。这种中枢去抑制作用是DLBP的重要发生机制之一。而蛇床子素能降低中枢兴奋性神经递质的释放,并具有神经保护作用,可通过减少中枢抑制性神经元的凋亡防治痛敏;(4)通过抗凝作用,减少毛细血管血栓形成以及增加背根神经节血供等途径产生协同作用。
综上所述,ERK/MAPK信号通路在髓核导致的神经根炎性疼痛中扮演着重要角色,本研究证实蛇床子素可通过抑制ERK信号通路的激活下调COX-2的表达而缓解痛觉过敏。因此,本研究为蛇床子素治疗椎间盘突出导致的神经根炎性痛提供了一个新的理论依据,为临床上开发新的抗炎镇痛药物提供了新的科学指导。
[1]Chou R,Atlas S J,Stanos S P,et al.Nonsurgical interventional therapies for low back pain:a review of the evidence for an American Pain Society clinical practice guideline[J].Spine(Phila Pa1976),2009,34(10):1078 -93
[2]陈 艳,张国刚,余仲平.蛇床子的化学成分及药理作用的研究进展[J].沈阳药科大学学报,2006,23(4):256-60.
[2]Chen Y,Zhang G Z,Yu Z P.The advancement in the chemical and parmacological study of the fruits of Cnidium monnieri[J].Shenyang Pharm Univ,2006,23(4):256 -60.
[3]姚 丽,冯红玄,霍 红,等.独活活性成分蛇床子素的药理学研究进展[J].中华中医药学刊,2012,30(10):2221-5.
[3]Yao L,Feng H X,Huo H,et al.Pharmacological research review of Osthole from Duhuo[J].Chin Arch Tradit Chin Med,2012,30(10):2221-5.
[4]于鹏霞,喻婉莹,阚伟娟,等.蛇床子素的抗炎作用及其机制[J].时珍国医国药,2012,23(4):866 -8.
[4]Yu P X,Yu W Y,Kan W J,et al.The mechanism of Osthole’s anti-inflammation effect[J].Lishizhen Med Res,2012,23(4):866-8.
[5]Mulleman D,Mammou S,Griffoul I,et al.Pathophysiology of disk-related sciatica.I.- -Evidence supporting a chemical component[J].Joint Bone Spine,2006,73(2):151 -8.
[6]贺秋兰,魏 明,张劲军,等.硬膜外腔注射蛇床子素对髓核致痛大鼠DRG环氧合酶2表达的影响[J].中国疼痛医学杂志,2010,16(4):224 -7.
[6]He Q L,Wei M,Zhang J J,et al.Effect of epidural osthole in cyclooxygenase-2 expression in dorsal root ganglion cells of rats with radicular pain following application of nucleus pulposus[J].Chin J Pain Med,2010,16(4):224 -7.
[7]魏 明,张劲军,贺秋兰.新型腰椎间盘突出致坐骨神经痛大鼠模型及硬膜外腔置管方法的建立[J].中国疼痛医学杂志,2011,17(12):744 -8.
[7]Wei M,Zhang J J,He Q L.Establishment of new rat model for sciatica induced by lumbar disc herniation and new method for epidural catheterization[J].Chin J Pain Med,2011,17(12):744 -8.
[8]贺秋兰,魏 明,张劲军.髓核致炎性神经痛大鼠背根神经节ASIC3表达相关性研究[J].中山大学学报(医学科学版),2010,31(6):776 -80.
[8]He Q L,Wei M,Zhang J J.Expression of acid-sensing ion channel 3 in dorsal root ganglion cells in rats with inflammatory radicular pain following application of nucleus pulposus[J].J Sun Yatsen Univ(Med Sci),2010,31(6):776 -80.
[9]Chaplan S R,Bach F W,Pogrel J W,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods,1994,53(1):55 -63.
[10]Latremoliere A,Woolf C J.Central sensitization:a generator of pain hypersensitivity by central neural plasticity[J].J Pain,2009,10(9):895 -926.
[11]Chen T,Liu W,Chao X,et al.Neuroprotective effect of osthole against oxygen and glucose deprivation in rat cortical neurons:involvement of mitogen-activated protein kinase pathway[J].Neuroscience,2011,183:203 -11.
[12]Ji R R,Gereau R W 4th,Malcangio M,Strichartz G R.MAP kinase and pain[J].Brain Res Rev,2009,60(1):135 - 48.
[13]Latremoliere A,Woolf C J.Central sensitization:a generator of pain hypersensitivity by central neural plasticity[J].J Pain,2009,10(9):895 -926.
[14]Peng B G.Pathophysiology,diagnosis,and treatment of discogenic low back pain[J].World J Orthop,2013,4(2):42 - 52.
[15]Liao P C,Chien S C,Ho C L,et al.Osthole regulates inflammatory mediator expression through modulating NF-kappaB,mitogenactivated protein kinases,protein kinase C,and reactive oxygen species[J].J Agric Food Chem,2010,58(19):10445 -51.
[16]李树基,孙丽荣,袁春华.蛇床子素对乳鼠心肌细胞钠通道的影响[J].数理医药学杂志,2011,24(3):286-9.
[16]Li S J,Sun L R,Yuan C H.Effect of osthole on sodium current in rat ventricular cardiomyocytes[J].J Math Med,2011,24(3):286-9.
[17]Wu S N,Lo Y K,Chen C C,et al.Inhibitory effect of the plantextract osthole on L-type calcium current in NG108-15 neuronal cells[J].Biochem Pharmacol,2002,63(2):199 -206.
