雷酚萜甲醚抑制人胃癌细胞AGS增殖及诱导凋亡作用研究
2014-12-07张丽静张蕾蕾黄文华霍小位刘冬羽李立勇
张丽静,张蕾蕾,黄文华,高 丽,霍小位,刘冬羽,李立勇,曹 丽
(中国医学科学院北京协和医学院药用植物研究所,北京 100193)
胃癌是消化系统常见的恶性肿瘤,据统计2003~2007年,中国胃癌发病率居恶性肿瘤第2位[1]。目前尚无特效药物,因此,有效药物的发现迫在眉睫。目前,临床抗肿瘤药物的60%来源于植物、海洋生物及微生物类的天然产物[2]。雷公藤(Triptergium wilfordiiHook.f)是卫矛科一年生藤本植物,是我国传统医学中的常用中草药。有研究表明其具有抗炎以及抗肿瘤等活性[3]。雷酚萜甲醚(triptonoterpene methyl ether,TME)是从雷公藤的根皮提取物中分离得到的二萜类化合物。有研究发现,TME对人宫颈癌HeLa细胞和小鼠成纤维细胞L929具有抑制作用,表明TME具有潜在抗肿瘤活性,但其抗肿瘤机制没有进一步的研究报道[4]。
本课题使用多种肿瘤细胞筛选TME抑制细胞增殖的活性,结果显示TME对人胃癌AGS细胞的抑制作用明显,并且对正常人胃上皮细胞GES-1的增殖抑制作用较弱,因此,对TME抑制人胃癌AGS细胞的增殖作用及机制进行了进一步的研究。
1 材料与方法
1.1 材料
1.1.1 实验药物 雷酚萜甲醚(C12H30O3)由中国医学科学院北京协和医学院药用植物研究所黄文华老师提供。用二甲基亚砜(DMSO)溶解,配成浓度为20 mmol·L-1的储备液,-20℃保存,使用前用培养基稀释成所需浓度,其中 DMSO终浓度 <0.1%。阳性药紫杉醇(辰欣药业公司,H20057404)使用前用培养基稀释成所需浓度。
1.1.2 细胞株 人胃癌细胞株AGS由中国农业大学封文海教授馈赠,正常人胃上皮细胞GES-1购自中国医学科学院肿瘤医院。
1.1.3 主要试剂 Ham's F12培养基、MTT、β-actin抗体购自美国Sigma公司;DMEM培养基、青霉素链霉素混合液、胰蛋白酶购自Gibco公司,胎牛血清购自四季青公司。Annexin-FITC/PI试剂盒购自北京宝赛生物技术有限公司。JC-1染料和活性氧DCFH-DA探针购自美国Invitrogen公司。Bax、Bcl-2、PARP抗体购自美国 Santa Cruz公司。Cleaved caspase-3、Cleaved caspase-8抗体购自美国 Cell Signaling Technology公司,山羊抗鼠 IgG-HRP和山羊抗兔IgG-HRP购自北京中杉金桥公司。AO/EB、DMSO、PI购自美国Amresco公司。
1.1.4 主要仪器 BCN-1360型生物洁净工作台(北京东联哈尔仪器制造有限公司);5410型二氧化碳培养箱(NAPCO,美国);MQX200型酶标仪(Bio-Tek,美国);CKX41倒置荧光显微镜(Olympus,日本);Labofuge 400R离心机(Heraeush,德国);流式细胞分析仪(Becton-Dickinson,CA)。
1.2 方法
1.2.1 细胞培养 AGS细胞和GES-1细胞分别用Ham's F12和DMEM培养基(添加10%的胎牛血清和1%的青、链霉素混合液)于37℃,在5%CO2条件下培养,细胞长至培养瓶80%时传代,取处于对数生长期的细胞进行实验。
1.2.2 MTT实验 将处于对数生长期的AGS细胞和GES-1细胞分别以每孔6 000个的浓度接种于96孔板,24 h后加入100 μl不同浓度的TME,浓度分别为 5.68、11.36、22.73、45.45、90.91 μmol·L-1。分别作用 24、48、72、96 h 后,每孔加 10 μl MTT(5 g·L-1),继续作用4 h后,弃掉上清液,并加入200 μl DMSO溶解反应产物,用酶标仪在570 nm波长处检测吸光值(absorbance,A),计算细胞存活率。存活率/%=100%-(A阴性对照-A药物组)/A药物组×100%。根据所得的TME 5个浓度梯度的细胞存活率绘制曲线,计算在4个不同作用时间点下TME诱导细胞凋亡50%时的浓度,即IC50值。
1.2.3 光学显微镜对细胞形态观察 取106个对数生长期细胞接种于6孔板,24 h后加入不同浓度(7.58、15.15、30.30 μmol·L-1)的 TME 作用 24 h后,吸出培养液,PBS洗2次。每孔加入1 ml PBS,光学显微镜下观察。
1.2.4 荧光显微镜下AO/EB双染法检测细胞凋亡 取105个对数生长期细胞接种于24孔板,培养24 h 后加不同浓度(7.58、15.15、30.30 μmol·L-1)的TME作用24 h后,吸出培养基,用PBS洗2次。每孔加入100 μl AO/EB混合染液,在荧光显微镜下观察拍照。可以看到活细胞核呈绿色荧光;凋亡细胞核呈橘红色荧光[5]。
1.2.5 平板克隆实验 将对数生长的细胞用胰酶消化吹打至单细胞悬液后,加入6孔板内,每孔100个细胞,轻摇培养板使细胞分散均匀,24 h后加不同浓度 (3.79、7.58、15.15、30.30、60.61 μmol·L-1)的TME静置培养1~2周。当培养板中出现肉眼可见的克隆时,终止培养。吸去上清液,用PBS洗2次。加纯甲醇固定15 min后,用蒸馏水洗2次。结晶紫染色20 min后,用蒸馏水缓慢洗去染色液,室温干燥后进行观察,拍照。
1.2.6 流式Annexin V-FITC/PI双染色法检测细胞凋亡率 取106个对数生长期细胞接种于6孔板,加不同浓度(7.58、15.15、30.30 μmol·L-1)的TME作用24 h后收集细胞,PBS洗细胞2次,将细胞重悬于 200 μl Binding Buffer中,加入 10 μl Annexin V-FITC,室温避光孵育 15 min,加入 300 μl Binding Buffer和 5 μl PI,使用 FACSort流式细胞仪检测细胞凋亡比率。
1.2.7 活性氧检测 取106个对数生长期细胞接种于 6 孔板,不同浓度(7.58、15.15、30.30 μmol·L-1)的 TME 作用24 h 后收集细胞,1 500 r·min-1离心5 min,用PBS洗3次后重悬,加入DCFH-DA荧光探针,室温下避光染色30 min,离心弃去上清,用PBS洗2遍,用FACSort流式细胞仪检测细胞内活性氧水平的变化。
1.2.8 线粒体膜电位的检测 取106个对数生长期细胞接种于6孔板,加不同浓度(7.58、15.15、30.30 μmol·L-1)的 TME 作用 24 h 后收集细胞,1 500 r·min-1离心 5 min,用无血清 Ham's F12 培养基洗3次,重悬细胞,加入JC-1原液,使其最终作用浓度为 2 μmol·L-1,37 ℃避光孵育 30 min 后离心,弃去上清液,用PBS洗2次,流式细胞仪检测细胞内线粒体膜电位的变化。
1.2.9 Western blot 取106个对数生长期细胞接种于 6 孔板,不同浓度(7.58、15.15、30.30 μmol·L-1)的TME作用24 h后,收集细胞,提取蛋白。取40 μg蛋白进行SDS-PAGE电泳1 h,电泳结束后电转55 min,将PVDF膜用5%的脱脂奶粉于室温封闭2 h,封闭一抗4℃过夜后,用TBST洗3次,每次10 min,封闭二抗在室温下孵育2 h,TBST洗3次,每次10 min,显色液进行显色后使用凝胶成像仪(BIO-RAD)进行成像。使用photoshop图像处理软件对蛋白条带的灰度值进行分析,将β-actin作为内参,用目的条带与β-actin条带灰度值的比值作为目的蛋白的相对表达量。
1.2.10 细胞周期检测 取106个对数生长期细胞接种于 6 孔板,不同浓度(7.58、15.15、30.30 μmol·L-1)TME 分别作用 24、48、72 h后,收集细胞,1 500 r·min-1离心 5 min,PBS 洗 3 次,加入 1 ml体积分数为0.75的乙醇(-20℃预冷),混匀,-20℃过夜固定。1 500 r·min-1离心5 min,PBS洗3次,加入500 μl PI(终浓度50 mg·L-1)避光染色10 min后,用流式细胞仪检测细胞周期。
2 结果
2.1 TME对细胞增殖抑制的时效、量效作用 如Fig 1所示,MTT结果显示,随着TME浓度增加和作用时间的延长,对AGS细胞的抑制作用增强,具有时间和剂量依赖性,TME作用24、48、72、96 h时的IC50分别为 43.03、23.85、22.55、18.33 μmol·L-1。根据细胞抑制率和细胞状态的变化,选择48 h作为与人正常胃上皮GES-1细胞作用相对照的时间点,此时 AGS 细胞的 IC50值为 23.85 μmol·L-1,TME 同样作用48 h 的 GES-1 细胞 IC50为 68.85 μmol·L-1。
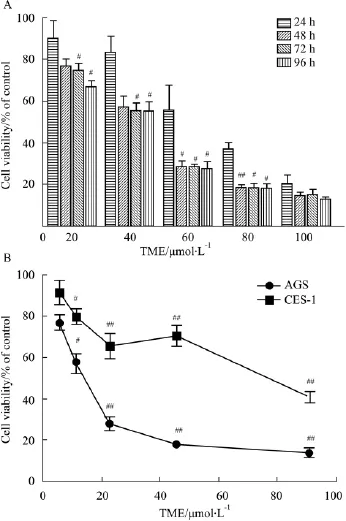
Fig 1 TME inhibits the proliferation of gastric cancer cells and normal gastric epithelial cells
2.2 TME对AGS细胞形态及克隆形成的影响普通光学显微镜下观察,在Fig 2A中,随着TME浓度的增加,AGS细胞出现明显的形态改变,染色质浓缩、核碎裂、细胞核边缘不整,同时细胞数量随之减少。AO/EB染色结果如Fig 2B所显示,未加药组大部分细胞呈绿色荧光。TME作用24 h后,随着剂量的增加,橘红色荧光细胞明显增加,同时细胞数量也有所减少。如Fig 3所示,随着TME浓度的增加,TME抑制AGS细胞的克隆形成的作用明显增强。

Fig 2 Morphological changes of AGS cells after TME tretment for 24 h
2.3 流式检测细胞凋亡 Annexin V-FITC/PI染色后,可检测出不同细胞群即:正常细胞群、早期凋亡细胞群、晚期凋亡和坏死细胞群。TME作用24 h后,诱导细胞发生凋亡,并随着TME浓度的增加,细胞凋亡率也有所增加,在 TME 30.30 μmol·L-1浓度时,凋亡率达到对照的4.18倍。见Fig 4A。

Fig 3 TME inhibits clone formation of AGS cells on flat plates for 10 d
2.4 TME对细胞活性氧的影响 DCFH-DA探针可穿过细胞膜被酯酶水解生成DCFH。细胞内的活性氧可以将无荧光的DCFH转化为有荧光的DCF[6]。因此,DCF的荧光强度可以反映细胞内活性氧的水平[7]。在检测结果中,随着TME浓度的增加,细胞内 ROS水平也升高,药物浓度在30.30 μmol·L-1时活性氧水平是空白对照组的1.71倍。见Fig 4B。
2.5 TME降低细胞线粒体膜电位 JC-1染料可反映线粒体膜电位,正常细胞线粒体膜电位高,JC-1聚集在线粒体基质中呈橘红色荧光。细胞受到损伤后膜电位下降,JC-1将出现绿色荧光的单体形式。Fig 5显示,对照组呈红色荧光,细胞线粒体膜电位较高,随TME浓度的增加绿色荧光逐渐增强,线粒体膜电位下降。与此相一致,流式细胞仪检测结果表明,随着TME浓度增加,对应绿色荧光强度的细胞比例从5.48%增加到34.99%,对应红色荧光强度的细胞群有所减少。

Fig 4 Cell apoptosis and reactive oxygen species production were detected by flow cytometry

Fig 5 TME reduces mitochondrial membrane potential in AGS cells for 24 h
2.6 TME对凋亡蛋白的影响 如Fig 6A所示,TME作用于AGS细胞24 h后,与对照组相比,活化的caspase-8和caspase-3表达增加,同时caspase-3的底物PARP蛋白被剪切活化。在Fig 6B中加入caspase广谱抑制剂z-VAD-fmk后,抑制了caspase-3和caspase-8的表达。在Fig 6C中可看到,促凋亡蛋白Bax的表达明显增加,而抑制凋亡蛋白Bcl-2的表达明显下降。
2.7 TME对AGS细胞周期的影响 实验结果显示,作用24 h后,TME对细胞周期无明显影响;作用48、72 h后,G0/G1期细胞所占的百分比增加,提示TME可使AGS胃癌细胞阻滞于G0/G1期。见Fig 7。
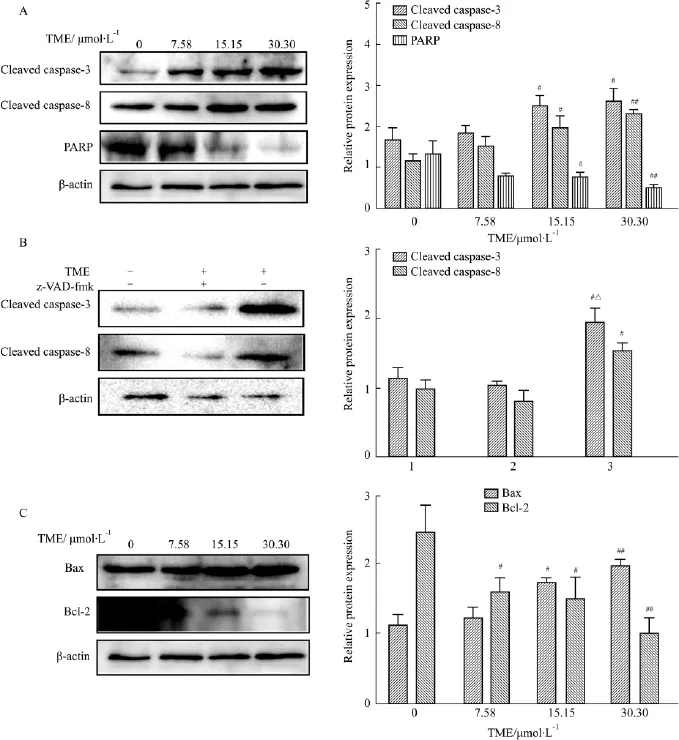
Fig 6 Effect of TME on the expression of apoptosis related proteins in AGS cells

Fig 7 Effects of TME on AGS cell cycle distribution for 24 h,48 h and 72 h
3 讨论
雷公藤是卫矛科植物雷公藤(T.Wilferdii)的根,至今已从中分离出多种有效成分,主要有生物碱类、二萜类、三萜类,其中二萜类如雷公藤甲素和三萜类成分如雷公藤红素均具有明显的抗肿瘤作用[8]。体内外的研究表明,雷公藤甲素为广谱肿瘤抑制剂,约可以抑制60种肿瘤细胞株,其中以直肠癌细胞株和乳腺癌细胞株最为敏感[9]。雷酚萜甲醚(TME)与雷公藤甲素同属松香烷型的二萜类单体[10],但对其抗肿瘤活性少有报道。
在本研究中,我们首先比较了TME对人胃癌细胞AGS和人正常胃上皮组织细胞GES-1的增殖抑制作用。结果显示,TME对肿瘤细胞的抑制作用明显高于对正常细胞,提示TME对胃癌细胞的增殖抑制作用较强。
通过细胞形态观察、AO/EB染色、克隆形成实验、AV/PI检测细胞凋亡率、线粒体膜电位以及活性氧的变化,可观察到TME能够明显诱导AGS细胞发生凋亡。
目前研究表明,凋亡对肿瘤的抑制起到重要的作用[11]。当细胞通过外源性途径发生凋亡作用时,死亡信号通过细胞表面的信号分子传递到caspase-8并将其激活,继而引起caspase-3的激活,从而引起凋亡。Western blot结果显示,TME作用后能活化caspase-8和 caspase-3,同时剪切 caspase-3底物PARP。预先加入caspase广谱抑制剂z-VAD-fmk作用后,caspase-3和caspase-8的表达均有所降低。
Bcl-2和Bax是Bcl-2家族中已知的重要凋亡调控蛋白。前者抑制细胞凋亡,后者促进细胞凋亡。近年研究显示,调节细胞凋亡不仅取决于Bcl-2和Bax自身表达的高低,还与二者的比值有关[12]。本研究显示,TME能降低抗凋亡蛋白Bcl-2的表达,增加促凋亡蛋白Bax的表达,从而促进细胞凋亡。
细胞增殖和凋亡水平的改变常与细胞周期调控的变化有关。细胞周期沿着G1、S、G2、M 期的顺序有序地运转[13]。G1期是启动细胞周期循环的关键,其运转状态是多种疾病的发病基础,也是药物发挥治疗作用的切入点[14]。本实验显示,TME可以使AGS细胞停滞于G1期,阻止其向S期及M期转化,从而使肿瘤细胞生长缓慢并降低其增殖活性。
因此,TME通过作用于Bcl-2家族蛋白而诱导胃癌AGS细胞发生了凋亡,并使细胞停滞于G1期,降低肿瘤细胞的增殖活性。TME可以作为一个潜在抗胃癌药物先导化合物,对其作用机制做进一步的研究。
[1]邹小农,孙喜斌,陈万青,等.2003-2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109 -14.
[1]Zou X N,Sun X B,Chen W Q,et al.The analysis of morbidity and mortality of gastric cancer between 2003 -2007 in China[J].Tumor,2012,32(2):109 -14.
[2]Balunas M J,Kinghorn A D.Drug discovery from medicinal plants[J].Life Sci,2005,78(5):431 - 41.
[3]刘为萍,刘素香,唐慧珠,等.雷公藤研究新进展[J].中草药,2010,41(7):1215 -8.
[3]Liu W P,Liu S X,Tang H Z,et al.New research in tripterygium[J].China Tradit Herb Drugs,2010,41(7):1215 -8.
[4]姚 智,高文远,高石喜久,等.雷公藤中具有抗癌活性的二萜类化合物[J].中草药,2007,38(11):1603 -6.
[4]Yao Z,Gao W Y,Yoshihisa T,et al.Study on anticancer activity of diterpenoids in tripterygium[J].China Tradit Herb Drugs,2007,38(11):1603-6.
[5]宋 慧,徐星新,李映新,等.广西眼镜蛇毒蛋白Natrin在体外诱导人肝癌细胞SMMC-7721凋亡作用的研究[J].中国药理学通报,2014,30(1):118-21.
[5]Song H,Xu X X,Li Y X,et al.Guangxi cobra venom protein Natrin induced apoptosis in human hepatoma SMMC-7721 cellsin vitro[J].Chin Pharmacol Bull,2014,30(1):118 -21.
[6]LeBel C P,Ischiropoulos H,Bondy S C.Evaluation of the probe 2c,7c-dichlorofluorecein as an indicator of reactive oxygen species formation and oxidative stress[J].Chem Res Toxicol,1992,5(2):227-31.
[7]Xiong Q,Kadota S,Tan T et al.Anti-oxidative effects of phenylethanoids from Cistanche deserticola[J].Biol Pharm Bull,1996,19(12):1580-5.
[8]陈铭祥,冯玉静,王定勇.雷公藤红素的研究进展[J].中成药,2010,32(3):473 -6.
[8]Chen M X,Feng Y J,Wang D Y.Advances in the effect of Celastrol[J].Chin Tradit Pat Med,2010,32(3):473 - 6.
[9]骆永伟,施 畅,廖明阳.雷公藤甲素抗肿瘤作用机制研究进展[J].中国中药杂志,2009,34(16):2024-6.
[9]Luo Y W,Shi C,Liao M Y.Advance in the anti-tumor mechanism of triptolide[J].Chin J Chin Mat Med,2009,34(16):2024-6.
[10]李建友,夏素霞,宋少江.雷公藤二萜类化学成分及在研新药的研究进展[J].沈阳药科大学学报,2012,29(11):901-8.
[10]Li J Y,Xia S X,Song S J.Research progress of diterpenoids from Tripterygium and the studying new drugs[J].J Shenyang Pharm Univ,2012,29(11):901 -8.
[11]Lowe S W,Lin A W.Apoptosis in cancer[J].Carcinogenesis,2000,21(3):485-95.
[12]Danial N N.Bcl-2 family proteins:critical checkpoints of apoptotic cell death[J].Clin Cancer Res,2007,13(24):7254 -63.
[13]Marcotte R,Wang E.Replicative senescence revisited[J].J Gerontol,2002,57(7):B257 -69.
[14]Narita M,Nunez S,Heard E,et al.Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence[J].Cell,2003,113(6):703 - 16.
