沉默EZH2表达逆转人非小细胞肺癌顺铂耐药性
2014-12-07饶进军何关生钟小懿王文雅
饶进军,何关生,毛 楠,钟小懿,吕 琳,王文雅
(1.南方医科大学药学院,广东广州 510515;2.广州医科大学附属第二医院药学部,广东广州 510260;3.广州市番禺中心医院药学部,广东广州 511400)
EZH2(enhancer of zeste homolog2)为多梳基因(polycomb group genes,PcG)蛋白家族的主要成员之一,是H3组蛋白第27位赖氨酸(H3K27)的特异性甲基化转移酶,调节组蛋白H3的甲基化,对基因沉默和转录抑制发挥重要作用[1],其突出的作用是致INK4a/ARF基因座启动子H3K27me3形成,从而抑制P14ARF、P16INK4a的表达,维护细胞的生长繁殖。近年来发现 EZH2在前列腺癌 、乳腺癌和膀胱癌[2-4]等多种恶性肿瘤中存在高表达,与肿瘤发生、发展及预后密切相关。靶向EZH2的研究发现,沉默该基因具有良好的抗肿瘤作用,并且能逆转肝癌对氟尿嘧啶的耐药性[5],被认为是一个很有前景的抗癌新靶点。
肺癌是当前发病率最高的肿瘤,且对化疗药物极易产生耐药性,是严重危害人类健康的一类恶性肿瘤[6]。基于顺铂的联合化疗是目前肺癌的一线治疗方案,对于EZH2是否可以作为逆转肺癌对顺铂的耐药性目前尚未明了。本研究以RNA干扰技术对此进行了研究,并进一步对其作用机制进行了探讨。
1 实验材料
1.1 细胞株 人非小细胞型肺癌A549细胞株购自中科院上海细胞库;人非小细胞型肺癌顺铂耐药株A549/DDP由第三军医大学新桥医院呼吸疾病研究所惠赠。
1.2 主要试剂 顺铂(质量分数≥99.9%,批号:1001620597)购自 Sigma公司;Lipofectamine RNA imax、TRIzol购自Invitrogen公司 ;细胞周期检测试剂盒、AnnexinV FITC-/PI双染细胞凋亡检测试剂盒、细胞衰老β-半乳糖苷酶染色试剂盒购自碧云天生物技术研究所;兔抗人EZH2(D2C9)、H3K27me3(C36B11)单克隆抗体、山羊抗兔IgG-二抗购自CST公司;兔抗人P14、E2F1多克隆抗体购自Santa Cruz公司;兔抗人 P16(EP435Y)、P53(E26)、Rb(C84F6)、CDK1(E53)、CDK2(Q265)、P21(EPR362)、β-actin(EPR6255)单克隆抗体购自Abcam公司;反转录试剂盒及SYBR Green Real-time PCR Master Mix购自日本 Toyobo;PCR引物由上海英骏生物技术有限公司合成;siRNA由广州锐博生物科技有限公司合成;其余试剂为国产分析纯。
2 实验方法
2.1 细胞培养与干预 肺癌A549细胞及其顺铂耐药株A549/DDP常规培养于含体积分数为0.10胎牛血清的F12K培养基中。取对数生长期细胞用于实验。实验设转染组(EZH2-siRNA)、无关序列对照组(Negative-siRNA)和空白组(lipofectamine)。转染前24 h将细胞按照每孔0.5×104细胞浓度接种96孔板,每孔1.0×105细胞接种6孔板,确保转染时细胞达到50%汇合度,按照lipofectamine RNA imax说明分别进行转染。
2.2 实时荧光定量PCR法检测EZH2 mRNA的表达 TRIzol法提取各组细胞总RNA,按试剂盒说明书将mRNA反转录为cDNA,以各组cDNA作为模板,在ABI 7500荧光定量PCR仪上进行PCR反应。EZH2上游引物 5'-GTTGGCGGAAGCGTGTAAAATC-3',下游引物 5'-TCCCTAGTCCCGCGCAATGAGC-3';以 GAPDH为内参,上游引物 5'-TGAACGGGAAGCTCACTGG-3',下 游 引 物 5'-TCCACCACCCTGTTGCTGTA-3'。 用 2-△△Ct法 计 算EZH2/GAPDH比值。
2.3 Western blot法检测蛋白表达 根据实验分组转染siRNA,各组转染48 h后,分别提取细胞总蛋白,以BCA法测其浓度。采用SDS-PAGE电泳分离总蛋白后,半干法转印至PVDF膜上,BSA溶液室温封闭1 h后,一抗4℃孵育过夜;PVDF膜以TBST溶液洗涤5 min×3次后,二抗室温孵育1 h;TBST溶液洗膜5 min×3次后,采用ECL发光试剂盒显色,X线片压片后曝光成像。
2.4 MTT法检测A549/DDP细胞的增殖能力检测细胞增殖能力的变化:实验前24 h按1 500/孔的细胞浓度将A549/DDP接种于96孔板,根据实验分组转染siRNA,每组设6个复孔,细胞转染48 h后,加 MTT(5 g·L-1)10 μl/孔,4 h 后吸出孔内液体,加入 DMSO 150 μl/孔,震荡10 min后,检测 570 nm处吸光度OD值。以时间为横坐标,OD值为纵坐标,绘制生长曲线。
检测细胞顺铂敏感性变化:种板及转染处理方法同上,24 h后更换含终浓度分别为 0、10、20、30、40、50、60、70、80、90、100 μmol·L-1顺铂的 F12K 完全培养基,继续培养48 h后,MTT法检测。细胞存活率/%=各浓度组吸光度值/空白组吸光度值×100%,并绘制曲线,计算半数抑制浓度(IC50)。
2.5 PI染色法检测细胞周期分布 根据实验分组转染siRNA,各组细胞转染48 h后,收集细胞,PBS洗涤,调整细胞浓度为2×105个·L-1后,用体积分数为0.7的乙醇固定,4℃保存过夜,PBS洗去固定液后,加入 500 μl PI染色液,37℃避光 30 min,流式细胞仪检测。
2.6 Annexin V-FITC/PI双染法检测细胞凋亡
根据实验分组转染siRNA,各组细胞转染48 h后,收集细胞,PBS洗涤2次,取2×105个细胞,加入195 μl结合液重悬细胞后,加入5 μl AnnexinV-FITC混匀,室温避光孵育10 min后,离心,弃上清。加入190 μl结合液轻轻重悬细胞,加入 10 μl PI,混匀,于1 h内用流式细胞仪检测。
2.7 β-半乳糖苷酶染色 根据实验分组,6孔板上转染siRNA,48 h后用PBS洗涤细胞1次,每孔加入1ml染色固定液,于室温固定15 min,用PBS洗涤细胞3 min×3次,每孔加入1 ml染色工作液,37℃孵育过夜。倒置显微镜下观察细胞衰老现象。
3 结果
3.1 A549/DDP细胞中EZH2表达明显高于A549细胞 结果如Fig 1所示,耐药细胞株A549/DDP中EZH2的mRNA水平和蛋白表达水平均高于亲本株A549。siRNA转染48h后,与空白组(C)、Neg-siRNA阴性对照组(N)相比,转染EZH2-siRNA 01、02、03序列的A549/DDP细胞中EZH2的mRNA和蛋白表达水平均明显下降,表明转染组序列对EZH2的干扰均有效,其中02序列EZH2-siRNA沉默效果最佳,选为后续实验的干扰序列。
3.2 沉默EZH2对A549/DDP细胞凋亡的影响结果见Tab 1,EZH2-siRNA组细胞凋亡率与空白组、Neg-siRNA组相比,差异均无显著性(P>0.05)。表明沉默EZH2并没有明显诱导A549/DDP细胞发生凋亡。
Tab 1 Flow cytometric analysis on apoptosis of A549/DDP cells 48h after transfection(±s,n=3)
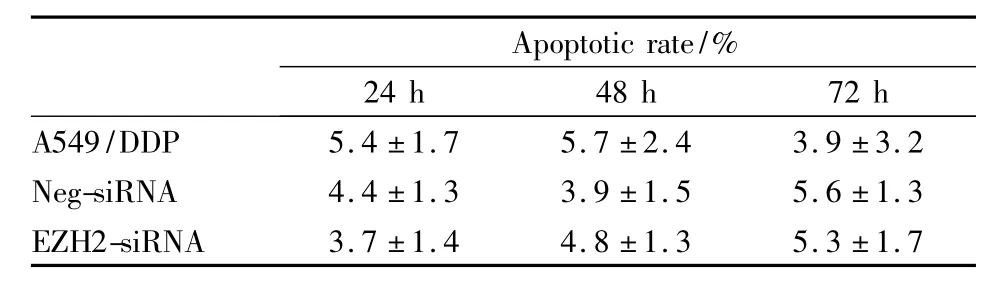
Tab 1 Flow cytometric analysis on apoptosis of A549/DDP cells 48h after transfection(±s,n=3)
Apoptotic rate/%24 h 48 h 72 h A549/DDP 5.4±1.7 5.7±2.4 3.9±3.2 Neg-siRNA 4.4±1.3 3.9±1.5 5.6±1.3 EZH2-siRNA 3.7±1.4 4.8±1.3 5.3±1.7
3.3 沉默EZH2表达后明显增强细胞对顺铂的敏感性 结果如Fig 2,与Neg-siRNA组和空白组相比,EZH2-siRNA组A549/DDP对顺铂的敏感性明显增加,IC50值由(41.2±4.3)μmol·L-1下降为(19.4±3.3)μmol·L-1(P<0.01)。
3.4 沉默EZH2诱导A549/DDP细胞周期G1/S阻滞 结果见Fig 3、Tab 2,与空白组、Neg-siRNA组相比,EZH2-siRNA作用后,G0/G1期细胞比例明显增加,S期、G2/M期细胞明显减少,表明细胞发生了G1/S期阻滞。
Tab 2 Flow cytometric analysis on cell cycle of A549/DDP cells 48h after transfection(±s,n=3)

Tab 2 Flow cytometric analysis on cell cycle of A549/DDP cells 48h after transfection(±s,n=3)
*P<0.05 compared with A549/DDP and Neg-siRNA
Cell cycle distribution/%G0/G1phase S phase G2/M phase A549/DDP 52.9±7.8 14.8±4.3 32.8±5.1 Neg-siRNA 52.4±6.6 15.3±4.6 32.3±4.4 EZH2-siRNA 83.7±8.6* 11.4±3.5* 4.7±2.1*
3.5 沉默EZH2对细胞周期相关蛋白的调节作用
实验进一步检测了沉默EZH2后,细胞周期G1/S相关调节蛋白的表达,结果如 Fig 4所示,沉默EZH2可上调P21表达,下调CDK1、CDK2的表达,提示EZH2可能通过调控上述周期相关基因的表达而影响细胞周期进程。
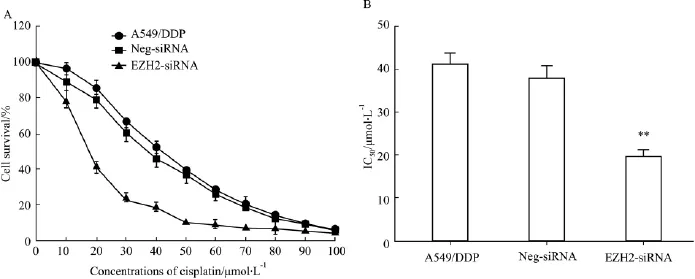
Fig 2 Effect of silencing EZH2 expression on cisplatin chemoresistance
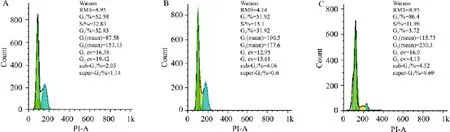
Fig 3 Effect of EZH2-siRNA on cell cycle distribution of A549/DDP cells
3.6 沉默EZH2可明显诱导A549/DDP细胞衰老
结果如 Fig 5所示,siRNA转染48 h后,镜下可见EZH2-siRNA组A549/DDP细胞出现明显的衰老形态学改变,表现为细胞体积变大、扁平、胞内颗粒增多,β-半乳糖苷酶染色呈阳性(蓝染);而空白组与Neg-siRNA组细胞未见衰老改变。
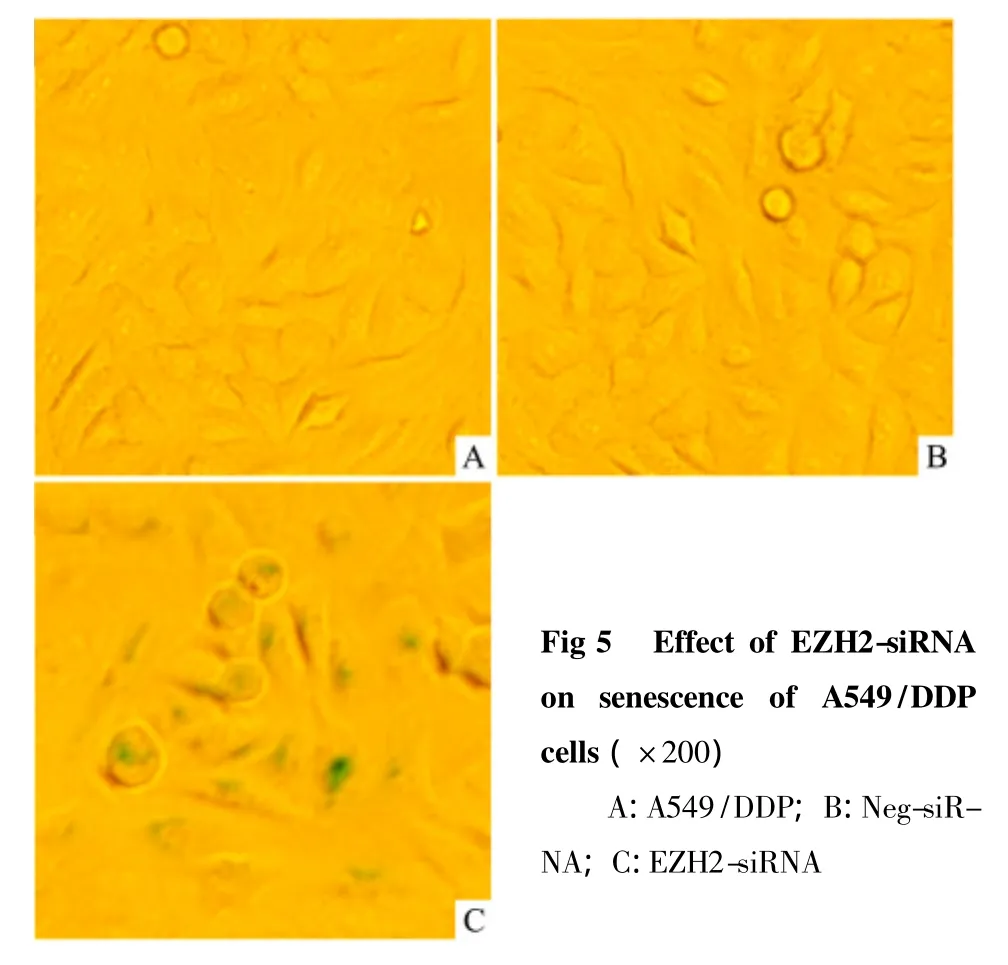
3.7 沉默EZH2对H3K27me3以及细胞衰老相关基因表达的影响 siRNA靶向沉默EZH2后,对细胞衰老通路 P14ARF、P16INK4a、P53、Rb、E2F1 及组蛋白H3K27me3表达水平有明显影响。如Fig 6所示,沉默EZH2可明显下调E2F1、H3K27me3蛋白表达,上调 P14ARF、P16INK4a、P53、Rb 蛋白表达,说明沉默EZH2可激活INK/ARF/Rb细胞衰老通路,诱导细胞衰老。

Fig 6 Effect of EZH2-siRNA transfection on expression of H3K27me3,P14ARF,P16INK4a,P53,Rb and E2F1 in A549/DDP cells
4 讨论
与一般的多药耐药不同,肿瘤对顺铂形成耐药的机制非常复杂,是一个多因素综合作用的结果,主要包括维护细胞生长的信号通路、细胞凋亡的调节通路、细胞骨架变化、DNA修复系统、细胞的外排及吸收等环节,几乎囊括了细胞生长发育的每个环节。
目前发现直接参与调节对铂类耐药的基因如HSP、GSHases、ATP7A/B、CTR1、ERCC1 等就有数10种之多。此外,还有如miR196、miR200c等10多个miRNA介入其中,它们间既有相互协同,又往往独立产生耐药作用。所以,单独作用于某一个致耐药因素并没有令人满意的效果,目前,也还没有合适的作用靶点用于逆转肺癌对铂类药物耐药性[7-8]。
近年的研究发现,抵御化疗药物诱导衰老是肿瘤细胞的一大特性,也是肿瘤细胞产生多药耐药性的重要机制之一[9]。细胞衰老是指在致衰老因素作用下,细胞周期受到阻滞,细胞丧失了对分裂原的反应,处于失去增殖分化能力的状态,是一种不可逆的生物学变化。细胞衰老后仍具有基本的代谢能力,能维持一段时间存活,但形态上和功能上会发生明显变化:细胞体积变大,可见异染色灶的形成,会出现颗粒样的“衰老色素”(溶酶体对胞内结构和亚细胞成分自吞噬后形成的残余物质)。由于衰老细胞溶酶体内容物增多,导致β-半乳糖苷酶的水平明显增高,通过染色可呈现特异的蓝色,这些特征也都是目前鉴别衰老细胞的主要标志。细胞一旦发生衰老,也就失去抵御化疗药物作用的能力。有鉴于此,对抗肿瘤多药耐药性不一定非要直接杀死肿瘤细胞,可以通过诱导细胞衰老,降低细胞对药物的抵御能力,从而产生逆转耐药的效果。
诱导细胞衰老主要有INK4a/ARF/Rb通路[10],INK4a/ARF编码两个重要的肿瘤抑制基因P16INK4a与P14ARF,分别通过调节Rb和P53产生诱导细胞衰老的作用。P16INK4a是周期素依赖性蛋白激酶CDK4、CDK6的抑制者,与CDK4、CDK6结合后使后两者发生蛋白变构,失去了与D型细胞周期蛋白结合的能力,丧失了介导Rb磷酸化的作用,致使Rb处于低磷酸化状态,促进Rb与E2F的结合,减少E2F的释放,使细胞终止在G1期,诱导细胞衰老。P14ARF通过与MDM2结合,抑制P53的泛素化,从而抑制P53降解,促进P53的作用,使P21表达增多,引起细胞周期G1/S阻滞,诱导细胞衰老。
如前所述,INK4a/ARF受PcG调节,PcG基因是一类高度保守的基因,主要作用是维持同源异形基因沉默。PcG蛋白致基因沉默是由PRC1(polycomb repressive complex 1)、PRC2(polycomb repressive complex 2)2个多聚抑制复合物完成的,PRC1核心蛋白有 Bmi1、Ring1、PH1和CBX;PRC2核心蛋白有 EZH2、eed、SUZ12和 RBAP48。首先,PRC2通过其催化亚基 EZH2的 SET结构域(在 eed、SUZ12的协同下)对核小体组蛋白H3的27号赖氨酸进行甲基化修饰,形成H3K27me3,这种甲基化作用建立起染色质和PcG蛋白质氨基端的连接点,使PRC1获得募集,通过CBX与H3K27me3相互作用使PRC1锚定在染色质上,进而Ring1、Bmi1又使组蛋白H2A-K119泛素化;H2A-K119泛素化使得染色质处于收紧状态,从而抑制转录因子与DNA的作用以及抑制转录的延伸。PRC2/PRC1对INK4a/ARF基因的沉默已被证实具有维护细胞增殖/存活,抑制细胞衰老及分化的作用。
EZH2在胚胎干细胞及肿瘤细胞中呈现高表达,而干扰抑制其表达后,会解除PcG对INK4a/ARF的抑制,引发细胞发生衰老。而在恢复PcG的功能后,也观察到衰老细胞又重新呈现幼稚化的现象。在呼吸系统、消化系统、生殖系统、血液系统及妇科肿瘤中都发现EZH2的异常高表达,现已被一些肿瘤治疗作为愈后好坏的一个重要指标[11]。
在卵巢癌中,EZH2被认为与顺铂耐药有关[12]。本研究发现,对于非小细胞肺癌,顺铂耐药株A549/DDP的EZH2的表达在mRNA和蛋白水平上均较其亲本细胞株A549有明显增高,以siRNA沉默耐药株中EZH2的表达后,能明显增强细胞对顺铂的敏感性,表明EZH2基因的过表达与肺癌顺铂耐药密切相关,EZH2是一个潜在的逆转肺癌顺铂耐药性的新作用靶点。与通常的抗肿瘤靶点不同,沉默EZH2并不能明显而快速地诱导肿瘤细胞凋亡或坏死,这一发现与在卵巢癌中观察到的现象一致,表明作用于EZH2逆转顺铂耐药性存在其它的作用机制。
鉴于沉默EZH2后G0/G1期细胞比例明显增高,S期细胞明显降低,表明细胞周期发生了G1/S期阻滞,而这一作用是通过诱导P21,下调CDK1、CDK2实现的。随后的研究证实,干扰EZH2的表达后实验组细胞发生了明显的衰老样变,表明沉默EZH2诱导了细胞衰老。
先前的研究已证实,EZH2可上调H3K27me3,抑制INK4a/ARF基因座的表达。如Fig 6所示,本研究沉默 EZH2表达,可明显下调细胞中H3K27me3和E2F1蛋白表达,上调P14ARF、P16INK4a、P53、Rb蛋白。由此推断,沉默 EZH2后激活INK4a/ARF/Rb通路,诱导细胞衰老是沉默EZH2表达后逆转A549/DDP细胞顺铂耐药性的一个重要作用机制。
[1]Deb G,Singh A K,Gupta S.EZH2:not EZHY(Easy)to deal[J].Mol Cancer Res,2014,13(4):912-20.
[2]Xu K,Wu Z J,Groner A C,et al.EZH2 oncogenic activity in castration resistant prostate cancer cells is polycomb-independent[J].Science,2012,338(6113):1465-9.
[3]Mu Z,Li H,Fernandez S V,et al.EZH2 knockdown suppresses the growth and invasion of human inflammatory breast cancer cells[J].J Exp Clin Cancer Res,2013,32(1):70-5.
[4]Holm K,Grabau D,Lövgren K,et al.Global H3K27 trimethylation and EZH2 abundance in breast tumor subtypes[J].Mol Oncol,2012,6(5):494-506.
[5]Zhang Y,Liu G,Lin C,et al.Silencing the EZH2 gene by RNA interference reverses the drug resistance of human hepatic multidrug-resistant cancer cells to 5-Fu[J].Life Sci,2013,92(17-19):896-902.
[6]Saika K,Sobue T.Cancer statistics in the world[J].Gan To Kagaku Ryoho,2013,40(13):2475-80.
[7]Shen D W,Pouliot L M,Hall M D,et al.Cisplatin resistance:a cellular self-defense mechanismResulting from multiple epigenetic and genetic changes[J].Pharmacol Rev,2012,64(3):706-21.
[8]赵小琴,符立梧.肿瘤干细胞耐药机制研究进展[J].中国药理学通报,2012,28(12):1637-42.
[8]ZHAO X Q,FU L W.Research progress in mechanisms of drug resistance in cancer stem cells[J].Chin Pharmacol Bull,2012,28(12):1637-42.
[9]Rebbaa A.Targeting senescence pathways to reverse drug resistance in cancer[J].Cancer Lett,2005,219(1):1-13.
[10]Kim W Y,Sharpless N E.The regulition of INK4a/ARF in cancer and aging[J].Cell,2006,127(2):265-75.
[11]Margueron R,Reinberg D.The Polycomb complex PRC2 and its mark in life[J].Nature,2011,469(7330):343-9.
[12]Hu S,Yu L,Li Z,et al.Overexpression of EZH2 contributes to acquired cisplatin resistance in ovarian cancer cellsin vitroandin vivo[J].Cancer Bio Ther,2010,10:788-95.
