阿魏酸预处理对阿霉素诱导H9c2心肌细胞损伤的保护作用
2014-12-07吴枝娟王瑞幸方秋娟林默君
吴枝娟,余 靖,王瑞幸,方秋娟,林默君
(福建医科大学基础医学院生理学与病理生理学系,福建福州 350108)
阿霉素(doxorubicin,DOX)是临床常用的蒽环类广谱抗肿瘤药,广泛用于急性白血病、乳腺癌、胃癌等多种恶性血液系统肿瘤和实体瘤的治疗。然而,DOX可造成不可逆的心肌损伤和心力衰竭,且无有效的防治措施,严重限制了 DOX的临床应用[1]。因此,寻找高效低毒且不影响DOX抗肿瘤作用的心脏保护剂,是DOX化疗中急待解决的问题。DOX心脏毒性的机制尚未完全明确,现有研究显示,DOX诱发的氧化应激及心肌细胞凋亡是心肌损伤的主要机制[2]。
阿魏酸(ferulic acid,FA)化学名称为4-羟-3-甲氧基肉桂酸,是阿魏、当归、川芎等多种中药的有效成分。FA具有抗血小板凝集、抗脂质过氧化、抗炎、抗肿瘤等药理作用,同时毒性很低[3-4]。近年来,FA的心脏保护作用日益受到关注。大量文献报道,FA可以减轻缺血/再灌注、铁过载等引起的心脏损伤。FA具有很强的抗氧化能力,可以清除自由基,减少心肌细胞凋亡[5-7]。但FA对DOX心肌损伤的作用未见相关报道。本文通过研究FA对DOX诱导的H9c2细胞损伤、氧化应激及细胞凋亡的影响,为FA防治DOX心脏毒性提供药理学依据。
1 材料与方法
1.1 细胞及主要试剂 H9c2(2-1)大鼠心肌细胞株、SGC-7901人胃癌细胞株、HL-60人早幼粒细胞白血病细胞株、MCF-7人乳腺癌细胞株购自中国科学院细胞库。注射用盐酸阿霉素,深圳万乐药业有限公司生产,批号:1309E1。阿魏酸标准品(纯度>98%)购自西安森卓生物科技有限公司,批号:SZ20140115。以注射用生理盐水配成1 mmol·L-1DOX和25 mmol·L-1FA储备液,-20℃保存,临用前稀释至所需浓度。高糖DMEM及RPMI 1640培养液购自Gibco公司,胎牛血清购自Hyclone公司。caspase-3、Bax、Bcl-2抗体购自 Santa Cruz公司。吖啶橙(acridine orange,AO)、溴化乙锭(ethidium bromide,EB)购自 Sigma-Aldrich公司。肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactic acid dehydrogenase,LDH)、丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自南京建成生物工程研究所。BCA蛋白浓度测定试剂盒、活性氧检测试剂盒、细胞计数CCK-8试剂盒购自碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养及处理 H9c2、SGC-7901、MCF-7细胞培养于含体积分数为0.1胎牛血清的高糖DMEM培养液,HL-60细胞培养于体积分数为0.1胎牛血清的RPMI 1640培养液。37℃、CO2体积分数0.05、饱和湿度条件下培养。细胞贴壁80%时,胰酶消化、计数、传代,每2~3天传代1次。取接种24 h对数生长期细胞进行实验,设Control、DOX和FA 10、FA 20、FA 40 预处理(Pre-treated)及共处理(Co-treated)组。对照组和DOX组分别加入相应溶剂和 1 μmol· L-1DOX 培养 24 h;FA 10、FA 20、FA 40 预处理组加入10、20、40 μmol· L-1FA 预处理2 h后,再加入DOX共培养24 h;共处理组加入10、20、40 μmol· L-1FA 与 DOX 共培养 24 h。
1.2.2 CCK-8法测定细胞生存率 取对数生长期细胞,以2×107·L-1细胞浓度接种96孔板,各实验组设4个复孔,另设无细胞培养液孔为空白对照。根据CCK-8试剂盒说明书,处理结束后每孔加入10 μl CCK-8工作液。37℃培养2 h,酶标仪(Elx800,BioTek,USA)记录450 nm波长处的吸光度。取4孔光密度(optical density,OD)的平均值,按下列公式计算细胞存活率:生存率/%=(OD处理组-OD空白组)/(OD对照组-OD空白组)×100%。实验重复3次。
1.2.3 培养液 CK、LDH 及细胞裂解液 MDA、SOD测定 取各处理组培养液上清和细胞裂解液,BCA蛋白浓度测定试剂盒测定蛋白浓度,按试剂盒说明书分别测定活性和含量。
1.2.4 DCF-DA荧光检测细胞内活性氧变化 按照活性氧检测试剂盒说明书操作。收集细胞,调整细胞浓度至 2 ×109·L-1,加入 10 μmol·L-1DCFDA,37℃孵育20 min,无血清培养液洗去未结合DCF-DA,每个样品收集1×104个细 胞,流式细胞仪 (FACSVerseflow cytometry, BD Biosciences,USA)检测荧光强度(激发波长488 nm,发射波长525 nm),FlowJo 7.6软件分析数据,计算 DCF-DA标记阳性细胞百分率。
1.2.5 AO-EB染色检测细胞凋亡 各处理组细胞,AO/EB染液孵育10 min,封片后在荧光显微镜(IX70-S8F2,Olympus,Japan)下观察。可见4种细胞:活细胞(VN),核染色质被AO染成绿色并呈正常结构;早期凋亡细胞(VA),核染色质着绿色并呈固缩状或圆珠状;晚期凋亡细胞(NVA),膜受损,核染色质被EB染成桔红色并呈固缩或圆珠状;坏死细胞(NVN),膜受损,核染色质被EB染成桔红色并呈正常结构。镜下随机取3个视野,分类计数100个细胞,凋亡率/%=(VA+NVA)/(VN+NVN+VA+NVA)×100%。
1.2.6 DNA琼脂糖凝胶电泳 各处理组收集1×106细胞,用 PBS洗两次,加入50 μl细胞裂解液(200 mmol·L-1Tris-HCl pH=7.5,1 g·L-1NP-40,20 mmol·L-1EDTA)和终浓度0.5 g·L-1蛋白酶K,50℃温育4 h。不含DNA酶的200 mg·L-1RNaseA,37 ℃消化2 h。离心去沉淀,取15 μl样品与2.5 μl上样缓冲液混和,上样于1.5%0.5 ×TBE的琼脂糖凝胶(含0.5 mg·L-1EB)样品槽上。100 V电泳30 min,凝胶成像系统(GelDoc 2000,Bio-Rad,USA)成像。
1.2.7 Western blot测定 caspase-3、Bax、Bcl-2 蛋白
收集H9c2细胞,预冷的PBS洗涤3次,RIPA全细胞裂解液冰上裂解30 min,离心取上清,BCA法进行蛋白定量。等量总蛋白SDS-PAGE分离后,转印至 PVDF膜。50 g·L-1脱脂奶粉封闭 1 h,caspase-3、Bax、Bcl-2一抗(1∶1 000稀释)4 ℃孵育过夜,TBST洗膜3次。二抗室温孵育1 h,漂洗3次,ECL显色。Image Quant LAS 4000 mini系统成像,Quantity One软件灰度分析。
2 结果
2.1 FA预处理提高 H9c2细胞生存率 运用CCK-8法测定细胞生存率。如Fig 1A所示:DOX可剂量依赖性地降低 H9c2 细胞生存,0.5、1、2 μmol·L-1DOX处理24 h细胞生存率分别为(92.37±3.73)%、(78.16±1.68)%、(71.06±2.69)%。根据以上结果并参考相关文献报道[8],以 1 μmol·L-1DOX处理24 h建立H9c2细胞损伤模型。
以前期预实验为基础,参考FA临床常用剂量的血药浓度范围,选取 10、20、40 μmol·L-13 个剂量浓度的FA处理DOX损伤的H9c2细胞,观察FA对DOX心肌损伤的作用。结果显示:10、20、40 μmol·L-1FA单用不影响H9c2细胞生存率(P>0.05)(Fig 1B)。FA预处理和共处理均使细胞生存率有不同程度提高。FA预处理组细胞生存率均高于相同剂量FA共处理组,其中低、中剂量组差别有显著性(P<0.05,Pre-treatedvsCo-treated)。20、40 μmol·L-1FA预处理组细胞生存率为(96.95±6.33)%和(99.24±4.98)%,较DOX损伤组明显升高(P<0.05),且接近正常水平(P>0.05vsControl)。以上结果说明:FA预处理的保护作用优于共处理,值得进一步研究。
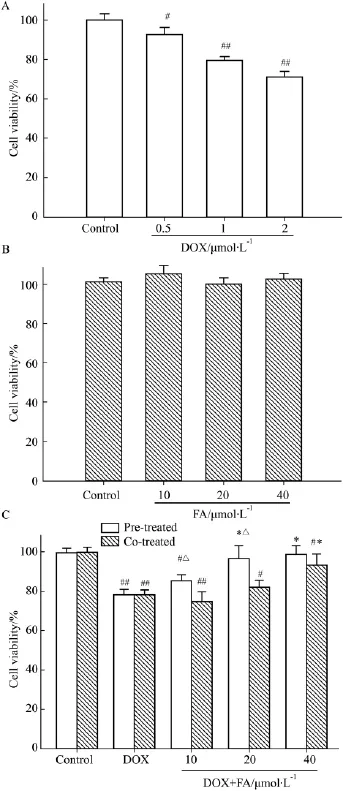
Fig 1Effect of FA on cell viability of H9c2 cells(±s,n=3)
2.2 FA预处理减轻H9c2细胞损伤
2.2.1 FA逆转DOX诱导H9c2细胞形态学变化如Fig 2所示,倒置相差显微镜观察发现:正常H9c2细胞呈梭形,排列规整,大小均一,胞核、胞质境界清楚。DOX损伤组细胞大小不规则,胞体变圆、皱缩,胞核增大,胞质有空泡出现。FA预处理组细胞大小较为均一,形态趋向正常,细胞皱缩变形和胞质空泡化减少。

Fig 2 Effect of FA on morphology of H9c2 cells injured by DOX(×200)
2.2.2 FA减少H9c2细胞培养液LDH、CK释放量
与对照组比较,DOX损伤组细胞培养液中LDH和CK的含量升高了65.43%和95.77%(P<0.01)。FA预处理组细胞培养液LDH和CK的含量有所降低,高剂量FA预处理组LDH和CK含量较DOX损伤组降低了23.57%和31.42%,差异有显著性(P<0.05)。
Tab 1 Effect of FA on LDH and CK levels in cultured fluid of DOX-injured H9c2 cells(±s,n=3)

Tab 1 Effect of FA on LDH and CK levels in cultured fluid of DOX-injured H9c2 cells(±s,n=3)
#P <0.05,##P <0.01 vs control;*P <0.05 vs DOX.
Group LDH/U·L-1 CK/U·L -1 Control 25.83 ±3.21 2.13 ±0.18 DOX 42.73 ±7.47## 4.17 ±0.62##FA 10 μmol·L -1 40.27 ±6.49# 3.77 ±0.47##FA 20 μmol·L -1 38.36 ±6.45# 3.12 ±0.31#*FA 40 μmol·L -1 32.66 ±5.21#* 2.86 ±0.25#*
2.3 FA预处理抑制DOX诱导的氧化应激
2.3.1 FA减少活性氧生成 DCF-DA荧光染色,流式细胞术比较各处理组细胞活性氧(reactive oxy-gen species,ROS)含量。结果如 Fig 3 所示,1 μmol·L-1DOX处理24 h使DCF-DA阳性率由(30.29±2.87)%升高至(47.51±2.41)%。FA预处理可对抗 DOX 诱导的 ROS 增多。10、20、40 μmol·L-1FA处理组DCF-DA阳性率降低至(39.77±2.69)%、(38.19±3.02)%和(34.59±2.62)%(P<0.05vsDOX损伤组)。

Fig 3 FA inhibits ROS generation induced by DOX in H9c2 cells(±s,n=3)
2.3.2 FA降低DOX损伤H9c2细胞MDA水平,增加SOD活性 DOX损伤组细胞内MDA水平升高,而SOD活性降低(P<0.05)。与DOX损伤组比较,低、中、高剂量FA预处理组MDA含量分别降低6.77%、26.99%和33.92%(P<0.05);中、高剂量FA处理组SOD活性升高24.94%和21.32%(P<0.05)。
2.4 FA预处理抑制DOX诱导的H9c2细胞凋亡
2.4.1 FA减少心肌细胞凋亡 AO-EB荧光染色检测心肌细胞凋亡。结果如Fig 4所示:对照组细胞凋亡率仅为(2.43±0.52)%;DOX损伤组凋亡率明显升高,达(21.81±3.17)%(P<0.01);低、中、高剂量FA预处理组,细胞凋亡率逐渐降低。中、高剂量FA预处理组细胞凋亡率较DOX损伤组降低45.76%和53.65%(P<0.05)。

Fig 4 Effect of FA on apoptosis induced by DOX in H9c2 cells(±s,n=3)
2.4.2 FA减轻DNA片段化 细胞凋亡的主要生化特征是DNA片段化。DNA琼脂糖凝胶电泳结果如Fig 5所示:DOX损伤组呈现凋亡特征性梯状图谱(DNA ladder)。FA预处理减轻DOX诱导的DNA片段化。10 μmol·L-1FA处理组仍可见较为清晰的 DNA ladder,20 和 40 μmol·L-1FA 处理组未检到典型的DNA ladder。
Tab 2 Effect of FA on MDA and SOD in DOX-injured H9c2 cells(±s,n=3)

Tab 2 Effect of FA on MDA and SOD in DOX-injured H9c2 cells(±s,n=3)
#P <0.05,##P <0.01 vs control;*P <0.05,**P <0.01 vs DOX.
Group MDA/μmol·g-1Pro SOD/U·mg-1Pro Control 33.64 ±5.93 47.38 ±3.52 DOX 64.29 ±6.82## 31.83 ±4.38#FA 10 59.94 ±3.37##* 30.28 ±2.15#FA 20 46.94 ±7.52#* 39.73 ±3.26#*FA 40 42.48 ±4.97#** 38.58 ±2.97#*

Fig 5 Agarose gel electrophoresis analysis of apoptotic DNA fragments
2.4.3 FA 抑制促凋亡蛋白 caspase-3、Bax,增加抑凋亡蛋白Bcl-2的表达 蛋白免疫印迹结果如Fig 6所示:1 μmol·L-1DOX 处理 24 h,促凋亡蛋白caspase-3和 Bax含量分别增加61.88%和150.91%;抑凋亡蛋白Bcl-2含量则减少63.04%(P<0.01)。FA预处理可以抑制上述改变。与DOX损伤组比较,中剂量FA预处理使caspase-3和Bax减少21.19%和49.51%,Bcl-2增加67.36%(P<0.05vsDOX);高剂量FA预处理caspase-3和Bax减少34.75%和63.52%,Bcl-2增加137.20%(P<0.01vsDOX)。
2.5 FA预处理不影响DOX对HL-60、SGC-7901、MCF-7细胞的细胞毒作用 有文献报道,FA具有抗肿瘤作用[9],但在本研究的心肌保护剂量范围内,FA预处理是否影响DOX抗肿瘤作用还需要实验证实。本研究选用3种对DOX敏感的人肿瘤细胞株(人早幼粒细胞白血病HL-60细胞株、人胃癌SGC-7901细胞株、人乳腺癌MCF-7细胞株)观察FA对DOX抗肿瘤作用的影响。如Fig 7所示,10、20、40 μmol·L-1FA 预处理后,与 1 μmol·L-1DOX共培养24 h,细胞生存率与DOX单用组比较差异无显著性(P>0.05)。40 μmol·L-1FA 预处理,测定 DOX对3种肿瘤细胞的半数抑制浓度(IC50),结果如Tab 3所示:经FA预处理,DOX对3种肿瘤细胞的IC50无明显改变(P>0.05)。

Fig 6 Effects of FA on expression of caspase-3,Bax and Bcl-2 induced by DOX in H9c2 cells(±s,n=3)

Fig 7 Effect of FA on viability of DOX-teated HL-60,SGC-7901,MCF-7 cells(±s,n=3)
3 讨论
心脏毒性是DOX最常见和最严重副作用,其机制尚未完全明确。氧化应激是DOX心脏毒性的主要原因。DOX在心肌细胞代谢过程中,产生大量活性氧,消耗内源性抗氧化物质,造成心肌细胞膜系统的脂质过氧化,引发一系列的生化及病理变化,导致心肌损伤[10]。心肌细胞凋亡是DOX心脏毒性的另一重要机制。DOX激活细胞凋亡通路,引起心肌细胞凋亡。研究发现:凋亡造成心肌细胞丢失,与DOX心脏毒性的心肌收缩功能障碍和心功能衰竭关系密切[11]。
Tab 3 Effect of FA on DOX's antineoplastic activity against human tumor cell lines(±s,n=3)

Tab 3 Effect of FA on DOX's antineoplastic activity against human tumor cell lines(±s,n=3)
Cells were pre-treated with 40 μmol·L -1FA for 2 h prior to DOX exposure
Cell line IC50of DOX/μmol·L -1 DOX FA+DOX HL-60 0.28 ±0.08 0.31 ±0.12 SGC-7901 7.24 ±0.66 6.93 ±0.44 MCF-7 5.87 ±0.82 6.14 ±0.59
本研究利用DOX诱导的H9c2大鼠心肌细胞损伤模型,评估FA对DOX心肌损伤的保护作用。DOX使H9c2细胞生存率降低、形态改变、心肌酶外漏,引起严重的心肌损伤。FA预处理则可提高细胞生存率,使细胞形态趋向正常,LDH和CK外漏减少。CK是特异性心肌标志物,LDH是细胞质中稳定存在的酶类。心肌细胞受损时,CK和LDH释放入培养液,其漏出量反映细胞膜损伤程度。FA预处理减少了DOX诱导的心肌细胞CK、LDH漏出,说明心肌细胞膜损伤有所减轻。此外,经FA预处理DOX对人早幼粒细胞白血病HL-60细胞株、人胃癌SGC-7901细胞株、人乳腺癌MCF-7细胞株的半数抑制浓度(IC50)无明显改变,说明在上述心肌保护剂量范围内FA不影响DOX的抗肿瘤作用。FA预处理可以减轻DOX诱导的H9c2心肌细胞损伤,同时又不影响DOX的抗肿瘤活性,有可能应用于DOX化疗的心肌保护,其心肌保护的机制值得深入研究。
FA是天然抗氧化剂,其分子结构中酚醛核及不饱和侧链可以很容易地形成共轭稳定的苯氧自由基,因此具有很强的清除活性氧的能力[12]。DOX损伤组细胞DCF-DA荧光强度和MDA水平升高。DCF-DA是活性氧的指示剂,MDA是生物体脂质氧化的天然产物。细胞氧化应激时,脂质过氧化产生大量的MDA。FA预处理使DCF-DA荧光强度和MDA水平降低,说明FA可以清除活性氧,减轻脂质过氧化,对抗DOX引起的氧化应激,减轻细胞损伤。心肌细胞内源性抗氧化酶是维持心肌细胞的氧化与抗氧化平衡的重要因素。由于心肌细胞内源性抗氧化酶含量较少,发生氧化应激时难以及时清除活性氧,造成氧化和抗氧化失平衡,使心肌细胞易受到氧化应激损伤[13]。DOX不仅诱导了活性氧生成和脂质过氧化,还能抑制心肌细胞抗氧化酶活性,破坏心肌细胞正常的氧化 -抗氧化平衡,导致细胞损伤[14]。超氧化物歧化酶(SOD)是心肌细胞的主要抗氧化酶。本实验中,DOX损伤组SOD活性明显降低,心肌细胞抗氧化能力减弱。FA预处理使SOD活性增高,心肌抗氧化能力增强,则有助于恢复心肌细胞氧化-抗氧化平衡。
本实验中,AO-EB染色和DNA琼脂糖凝胶电泳均证明DOX引起H9c2心肌细胞凋亡。FA预处理减少DOX诱导的心肌细胞凋亡,表现为凋亡特征性的DNA片段化减轻,细胞凋亡率呈剂量依赖性降低。蛋白免疫印迹显示,DOX损伤H9c2细胞凋亡诱导蛋白caspase-3和Bax表达增加,而凋亡抑制蛋白Bcl-2表达减少,上述结果与文献报道一致[15-16]。Bax是 Bcl-2 家族的促凋亡蛋白,细胞受到损伤时,Bax从胞质转位到线粒体表面,增加线粒体通透性,导致细胞色素C外漏,激活线粒体细胞凋亡途径。Bcl-2可与Bax形成异源二聚体,阻止Bax向线粒体移位,拮抗 Bax的促凋亡作用。caspase-3是细胞凋亡的执行者。凋亡早期caspase-3活化(active casapse-3),裂解相应胞质胞核底物,切割核小体间的DNA,引起细胞凋亡。FA可调节上述凋亡相关蛋白的表达。FA预处理降低DOX损伤心肌细胞促凋亡蛋白Bax和caspase-3含量,同时增加Bcl-2的表达,抑制DOX的促凋亡作用。
综上所述,本研究首次发现 FA提高DOX损伤H9c2大鼠心肌细胞的生存率,减轻心肌损伤,具有一定的心肌保护作用。FA可清除DOX产生的活性氧,增加心肌SOD酶活性,降低细胞MDA含量,减轻细胞氧化应激损伤。FA抑制促凋亡蛋白caspase-3、Bax,增加抑凋亡蛋白Bcl-2的表达,减少DOX诱导的心肌细胞凋亡。FA对DOX心肌损伤的保护作用可能与抗氧化应激和抗心肌细胞凋亡有关。
[1]Smith L A,Cornelius V R,Plummer C J,et al.Cardiotoxicity of anthracycline agents for the treatment of cancer:systematic review and meta-analysis of randomised controlled trials[J].BMC cancer,2010,10:337.
[2]Zhang Y W,Shi J,Li Y J,et al.Cardiomyocyte death in doxorubicin-induced cardiotoxicity[J].Arch Immunol Ther Exp,2009,57(6):435-45.
[3]Mancuso C,Santangelo R.Ferulic acid:pharmacological and tox-icological aspects[J].Food Chem Toxicol,2014,65:185 -95.
[4]Barone E,Calabrese V,Mancuso C.Ferulic acid and its therapeutic potential as a hormetin for age-related diseases[J].Biogerontology,2009,10(2):97 -108.
[5]Alam M A,Sernia C,Brown L.Ferulic acid improves cardiovascular and kidney structure and function in hypertensive rats[J].J Cardiovasc Pharmacol,2013,61(3):240 -9.
[6]刘季春,万 力,邵立建,等.阿魏酸钠对离体大鼠心脏的药理性预适应保护作用及机制[J].中国药理学通报,2007,23(5):618-22.
[6]Liu J C,Wan L,Shao L J,et al.Protective effects and machanisms of pharmacological preconditioning induced by sodium ferulate on isolated rat heart[J].Chin Pharmacol Bull,2007,23(5):618 -22.
[7]姜晨辉,何 欢,王 飞,等.阿魏酸钠对小鼠铁过载性心脏损伤的作用[J].南昌大学学报(医学版),2012,52(9):14 -8.
[7]Jiang C H,He H,Wang F,et al.Protective effects of sodium ferulate on heart injury in iron overload mice[J].J Nanchang Univ(Med Sci),2012,52(9):14 -8.
[8]Wang W C,Uen Y H,Chang M L,et al.Protective effect of guggulsterone against cardiomyocyte injury induced by doxorubicinin vitro[J].BMC Complement Altern Med,2012,12:138.
[9]Prabhakar M M,Vasudevan K,Karthikeyan S,et al.Anti-cell proliferative efficacy of ferulic acid against 7,12-dimethylbenz(a)anthracene induced hamster buccal pouch carcinogenesis[J].Asian Pac J Cancer Prev,2012,13(10):5207 -11.
[10]Sterba M,Popelova O,Vavrova A,et al.Oxidative stress,redox signaling,and metal chelation in anthracycline cardiotoxicity and pharmacological cardioprotection [J].Antioxid Redox Signal,2013,18(8):899-929.
[11]Shi J,Abdelwahid E,Wei L.Apoptosis in anthracycline cardiomyopathy[J].Curr Pediatr Rev,2011,7(4):329 -36.
[12]Picone P,Nuzzo D,Di Carlo M.Ferulic acid:a natural antioxidant against oxidative stress induced by oligomeric A-beta on sea urchin embryo[J].Biol Bull,2013,224(1):18 -28.
[13]Murray T V,Ahmad A,Brewer A C.Reactive oxygen at the heart of metabolism[J].Trends Cardiovasc Med,2014,24(3):113-20.
[14]Simunek T,Sterba M,Popelova O,et al.Anthracycline-induced cardiotoxicity:overview of studies examining the roles of oxidative stress and free cellular iron[J].Pharmacol Rep,2009,61(1):154-71.
[15]Wang X L,Wang X,Xiong L L,et al.Salidroside improves doxorubicin-induced cardiac dysfunction by suppression of excessive oxidative stress and cardiomyocyte apoptosis[J].J Cardiovasc Pharmacol,2013,62(6):512 -23.
[16]裴天仙,徐长庆,于 靖,等.槲皮素抗阿霉素诱导的培养心肌细胞的凋亡[J].中国药理学通报,2008,24(4):534 -8.
[16]Pei T X,Xu C Q,Yu J,et al.Effect of quercetin on rat cardiomyocyte apoptosis induced by adriamycinin vitro[J].Chin Pharmacol Bull,2008,24(4):534 -8.
