丹参酮类抗肿瘤作用与机制研究进展
2014-12-07郝文慧赵文文陈修平
郝文慧,赵文文,陈修平
(中药质量研究国家重点实验室,澳门大学中华医药研究院,澳门大学澳门特别行政区)
丹参(Salvia miltiorrhizaBunge)是中医临床上最为常用的中药之一,具有活血调经、祛瘀止痛、养血安神等传统功效。研究显示[1-2],丹参中含有数百种化学成分,主要包括水溶性酚酸类和脂溶性的丹参酮类。丹参酮类是丹参的特征性成分之一,包括丹参酮IIA(tanshinone IIA,Tan IIA)、隐丹参酮(cryptotanshinone,CPT)、丹参酮Ⅰ、二氢丹参酮Ⅰ等多种。其中Tan IIA和丹酚酸B被选为国家药典中丹参质量控制的指标性成分,具有明显的心血管保护作用。近年来,丹参酮类的抗肿瘤活性逐渐引起研究人员的重视。研究发现,Tan IIA、CPT、丹参酮Ⅰ、二氢丹参酮I(Fig 1)等多种丹参酮均具有一定的抗肿瘤活性。本文主要阐述了这几种丹参酮类的抗肿瘤活性与作用机制的最新研究进展。

图1 丹参中的主要的丹参酮类化合物
1 Tan IIA抗肿瘤作用与机制
1.1 抑制肿瘤细胞生长、增殖 Tan IIA可抑制多种肿瘤细胞株的生长,包括乳腺癌、肺癌、肝癌、白血病和胃癌细胞株等[3-6]。Tan IIA 通过下调环氧化酶 2(cyclooxygenase-2,COX-2)的表达来抑制人结肠癌细胞的血管生成,从而发挥其抗肿瘤活性[7]。Tan IIA引起前列腺癌细胞的生长抑制和凋亡,主要作用机制为抑制PI3K/AKT信号通路,继而引起线粒体依赖的凋亡[8]。基因组学研究发现,Tan IIA诱导U937细胞系(急性髓系白血病细胞株)发生凋亡,可能与激活pregnane X receptor(PXR),继而抑制了核转录因子κB(NF-κB)的活性,导致Bcl-2的表达下调有关[6]。Tan IIA 在体内、体外都可以诱导人结肠癌细胞Colo205发生凋亡,其原因可能与死亡受体通路和线粒体通路有关[9]。体外Tan IIA可以明显降低白介素6(IL-6)、信号传导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)、p-STAT3(Tyr705)、细胞核内NF-κB p65和cyclin D1蛋白的表达;体内给药可以明显降低移植肿瘤的体积和重量。因此,Tan IIA对肿瘤的抑制作用可能与IL-6/STAT3/NF-κB通路有关[10]。
在NQO1阳性的肺癌细胞A549和H596中,Tan IIA可诱导其产生大量活性氧(reactive oxygen species,ROS),发生DNA损伤及凋亡。但在NQO1阴性H596细胞中无此作用。抑制或沉默NQO1的表达和抗氧化剂NAC都可以明显逆转Tan IIA引起的凋亡。这提示NQO1可能是Tan IIA的作用靶点之一[11]。对于小细胞肺癌H146研究发现,Tan IIA增加了ROS生成和Ca2+的产生,降低了线粒体的膜电位,引起Bcl-2表达的下降和Bax表达的上升,导致细胞凋亡[12]。
Tan II A对多种白血病细胞SUP-B15(人Ph急淋白血病细胞系)、K562(慢性粒细胞白血病细胞系)、CEM(人白血病细胞系)、NB4(急性早幼粒细胞白血病细胞珠)的生长有明显的抑制作用,但对于HL-60细胞(人早幼粒白血病细胞株)的抑制作用较弱[13]。Tan IIA处理KBM-5细胞(人慢性髓白血病细胞株)引起Sub-G1期阻滞、DNA损伤、线粒体膜电位降低、线粒体中细胞色素C释放和Caspase-3,9激活。Tan IIA同时激活JNK和p38MAPK,且其诱导的凋亡可被JNK抑制剂逆转。提示Tan IIA诱导了线粒体依赖的凋亡,且与激活JNK有关[14]。体内研究发现,Tan IIA通过增强Bax、Caspase-3和减弱CD31的表达,引发肝细胞瘤J5细胞凋亡进而抑制其生长。体外实验显示,Tan IIA增强了J5细胞内钙网蛋白、Caspase-12和GADD153蛋白的表达[15]。
最新研究显示[16],Tan IIA可诱导前列腺癌细胞PC-3、多发性骨髓瘤细胞U266、肺癌细胞NCI-H460和乳腺癌细胞MDA-MB-231等细胞自噬。Tan IIA能显著诱导KBM-5细胞中自噬标志性蛋白LC3-II的表达,其作用机制可能与激活AMPK、ERK和抑制mTOR和p70S6K有关。
1.2 抑制肿瘤的侵袭和迁移 Tan IIA在体内、体外都可以抑制结肠癌细胞的侵袭和迁移,其机制与抑制NF-κB活性,继而引起酶原激活剂、基质金属蛋白酶MMP-2、MMP-9表达下调和组织基质金属蛋白酶抑制剂TIMP-1、TIMP-2表达上调有关[17]。Tan IIA抑制胃癌细胞 SGC7901的生长,引起SGC7901细胞发生凋亡和G0/G1期阻滞,降低细胞的侵袭和转移的能力[18]。Tan IIA诱导骨肉瘤细胞MG-63发生凋亡,并抑制其生长、侵袭和转移[19]。
1.3 与其它抗肿瘤药物产生协同作用 Tan IIA与顺铂联合作用于前列腺癌细胞系PC3和LNCaP,表现出协同的抗肿瘤活性:明显增强顺铂的抗增殖活性,诱导细胞S期阻滞和凋亡。体内研究发现,Tan IIA可增强5-氟脲嘧啶(5-FU)对人结肠癌的抗肿瘤作用,其机制可能与增强5-FU、下调LC3-Ⅱ和 p糖蛋白(p-glycoprotein,P-gp)的表达有关[20]。全反式维甲酸(all-trans retinoic acid,ATRA)和三氧化二砷(arsenic trioxide,ATO)对于急性早幼粒性白血病(acute promyelocytic leukemia,APL)有良好的疗效。但ATO有较大的毒副作用且容易使患者对ATRA产生耐药,影响临床疗效。在ATRA-抵抗的APL细胞系(MR2),Tan IIA和ATO联合应用可以协同增强MR2细胞的凋亡,明显下调P-gp的表达[21]。这些研究结果表明,Tan IIA可作为增强化疗药物疗效的辅助药物。丹参酮IIA的主要抗肿瘤作用与机制总结为Fig 2。
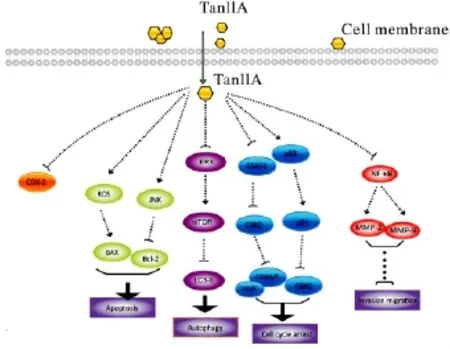
图2 TanⅡA的主要抗肿瘤机制
2 CPT的抗肿瘤作用与机制
CPT可以抑制多种肿瘤细胞的生长,是丹参酮类化合物中最有效的抗肿瘤成分之一。CPT能抑制前列腺癌DU145细胞的生长,通过抑制cyclin D1的表达和下调Rb的磷酸化,诱导DU145细胞G1期阻滞。这可能与CPT抑制mTOR信号通路有关[22]。CPT同样可以引起多药耐药慢性髓性白血病细胞K562/MDR的细胞周期阻滞和凋亡,其作用机制为CPT抑制真核细胞启动因子4E(eukaryotic translation initiation factor 4E,eIF4E)调节系统[23]。
MAPK家族蛋白在肿瘤细胞的生长和死亡中发挥重要的调节作用,其主要包括p38MAPK、JNK、ERK1/2等。CPT可以增强肿瘤坏死因子(TNF-α)诱导的慢性髓性白血病细胞KBM-5的凋亡,其作用机制与ROS依赖的Caspase-8和p38MAPK的激活有关[24]。CPT可通过引发内质网应激,促进肝癌细胞HepG2和乳腺癌细胞MCF7发生凋亡[25]。
STAT3在多种癌细胞中被激活和过量表达,是近年来广为研究的抗肿瘤靶点之一[26]。有研究显示,CPT是一个STAT3的抑制剂,抑制了STAT3(Tyr 706)位点的磷酸化,从而抑制了DU145细胞的生长与增殖[27]。
CPT还具有抑制血管生成的作用。CPT通过诱导肝癌细胞S期阻滞,导致细胞的生长抑制,同时也抑制肝脏和胃部的血管生成[28]。CPT通过抑制血管内皮生长因子受体3(VEGFR-3)活性,抑制淋巴管的生成[29]。
3 丹参酮Ⅰ和二氢丹参酮I的抗肿瘤作用与机制
丹参酮Ⅰ和二氢丹参酮I在丹参中含量很低,近年来对他们的抗肿瘤活性也有一些研究。有文献报道,丹参酮Ⅰ表现出对于肿瘤细胞系的生长抑制作用,如小细胞肺癌[30]。二氢丹参酮I使K562/ADR细胞S期阻滞,继而引起细胞发生凋亡[31]。二氢丹参酮I引起乳腺癌细胞G1期阻滞,继而诱导细胞凋亡[32]。体内、体外实验研究都表明,二氢丹参酮I还具有抗血管生成的作用[33]。二氢丹参酮I在浓度为2.5 mg·L-1时就能明显抑制结肠癌 SW480(良性)、SW620(恶性)细胞的生长。二氢丹参酮I能上调转录启动子-3(activating transcription factor,ATF-3)的表达。当过量表达ATF-3时,SW480细胞的凋亡明显增加,但不影响SW620细胞[34]。二氢丹参酮I还可通过诱导内质网应激而使前列腺癌细胞发生凋亡[35]。
4 展望
越来越多的研究表明,多数丹参酮类在体外具有一定的抗肿瘤活性。其中,对Tan IIA的抗肿瘤作用研究最为广泛和深入,这可能与其在丹参中含量最多有关。Tan IIA具有广谱的抗肿瘤活性,对于大多数的肿瘤细胞系都有效,主要诱导细胞产生周期阻滞、线粒体依赖的凋亡以及自噬等。同时,Tan IIA与多种临床常用的化疗药物,如顺铂、5-FU等的联合应用亦可以增强化疗药物的治疗作用。此外,Tan IIA对肿瘤的侵袭和迁移也具有一定的抑制作用。Tan IIA相关制剂已经在临床应用于心血管疾病治疗和辅助治疗,毒副作用较低。因此,Tan IIA在肿瘤治疗和辅助治疗方面具有较大潜力。但目前对其作用机制尤其是靶点的研究较少,这将是未来的一个研究重点。对CPT、丹参酮I、二氢丹参酮I抗肿瘤研究刚起步,但体内外初步结果提示,与Tan IIA相比,可能具有更强的药效,值得深入研究。此外,其他的丹参酮类的抗肿瘤活性尚未被研究,其中可能蕴藏着具有成药潜力的先导化合物。因此,有必要对这类化合物的抗肿瘤作用与机制进行进一步深入研究,这将有助于拓展丹参的传统功效,有助于促进基于中药的创新药物研发。
[1]Ho J H,Hong C Y.Salvianolic acids:small compounds with multiple mechanisms for cardiovascular protection[J].J Biomed Sci,2011,18:30.
[2]Gao S,Liu Z,Li H,et al.Cardiovascular actions and therapeutic potential of tanshinoneⅡA[J].Atherosclerosis,2012,220(1):3-10.
[3]Chen J,Shi D Y,Liu S L,et al.TanshinoneⅡA induces growth inhibition and apoptosis in gastric cancerin vitroandin vivo[J].Oncol Rep,2012,27(2):523-8.
[4]赵丕文,牛建昭,王继峰,等.丹参酮ⅡA抗乳腺癌细胞增殖作用研究[J].中国药理学通报,2010,26(7):903 -6.
[4]Zhao P W,Niu J Z,Wang J F,et al.Research on the inhibitory effect tanshinoneⅡA on breast cancer cell proliferation[J].Chin Pharmacol Bull,2010,26(7):903 -6.
[5]戴支凯,石京山,吴 芹,等.丹参酮ⅡA诱导人肺腺癌A549细胞凋亡[J].中国药理学通报,2010,26(11):1505 -8.
[5]Dai Z K,Shi J S,Wu Q,et al.Apoptios inducing effect of Tanshinone ⅡA on human lung adenocarcinoma A549 cells[J].Chin Pharmacol Bull,2010,26(11):1505 -8.
[6]Liu C,Li J,Wang L,et al.Analysis of tanshinoneⅡA induced cellular apoptosis in leukemia cells by genome-wide expression profiling[J].BMC Complement Altern Med,2012,12:5.
[7]Zhou L H,Hu Q,Sui H,et al.TanshinoneⅡ-a inhibits angiogenesis through down regulation of COX-2 in human colorectal cancer[J].Asian Pac J Cancer Prev,2012,13(9):4453 -8.
[8]Won S H,Lee H J,Jeong S J,et al.TanshinoneⅡA induces mitochondria dependent apoptosis in prostate cancer cells in association with an inhibition of phosphoinositide 3-kinase/AKT pathway[J].Biol Pharm Bull,2010,33(11):1828 -34.
[9]Hou L L,Xu Q J,Hu G Q,et al.Synergistic antitumor effects of tanshinoneⅡA in combination with cisplatin via apoptosis in the prostate cancer cells[J].Acta Pharm Sin,2013,48(5):675 -9.
[10]Lin C,Wang L,Wang H,et al.TanshinoneⅡA inhibits breast cancer stem cells growthin vitroandin vivothrough attenuation of IL-6/STAT3/NF-κB signaling pathways[J].J Cell Biochem,2013,114(9):2061-70.
[11]Liu F,Yu G,Wang G,et al.An NQO1-initiated and p53-independent apoptotic pathway determines the anti-tumor effect of tanshinone ⅡA against non-small cell lung cancer[J].PLoS One,2012,7(7):e42138.
[12]Won S H,Lee H J,Jeong S J,et al.Activation of p53 signaling and inhibition of androgen receptor mediate tanshinoneⅡA induced G1 arrest in LNCaP prostate cancer cells[J].Phytother Res,2012,26(5):669 -74.
[13]Shan Q Q,Gong Y P,Guo Y,et al.Anti-tumor effect of tanshinoneⅡ A,tetrandrine,honokiol,curcumin,oridonin and paeonol on leukemia cell lines[J].J Sichuan Univ(Med Sci Ed),2012,43(3):362-6.
[14]Yun S M,Jeong S J,Kim J H,et al.Activation of c-Jun N-terminal kinase mediates tanshinoneⅡA-induced apoptosis in KBM-5 chronic myeloid leukemia cells[J].Biol Pharm Bull,2013,36(2):208-14.
[15]Cheng C Y,Su C C.TanshinoneⅡA inhibits Hep-J5 cells by increasing calreticulin,caspase 12 and GADD153 protein expression[J].Int J Mol Med,2010,26(3):379-85.
[16]Yun S M,Jung J H,Jeong S J,et al.TanshinoneⅡA induces autophagic cell death via activation of AMPK and ERK and inhibition of mTOR and p70 S6K in KBM-5 leukemia cells[J].Phyto-ther Res,2014,28(3):458 -64.
[17]Shan Y F,Shen X,Xie Y K,et al.Inhibitory effects of tanshinoneⅡ-A on invasion and metastasis of human colon carcinoma cells[J].Acta Pharmacol Sin,2009,30(11):1537 - 42.
[18]Xu M,Cao F L,Li N Y,et al.TanshinoneⅡA reverses the malignant phenotype of SGC7901 gastric cancer cells[J].Asian Pac J Cancer Prev,2013,14(1):173 -7.
[19]Zhang Y,Wei R X,Zhu X B,et al.TanshinoneⅡA induces apoptosis and inhibits the proliferation,migration,and invasion of the osteosarcoma MG-63 cell linein vitro[J].Anticancer Drugs,2012,23(2):212-9.
[20]Su C C.TanshinoneⅡA potentiates the efficacy of 5-FU in Colo205 colon cancer cellsin vivothrough downregulation of P-gp and LC3-Ⅱ[J].Exp Ther Med,2012,3(3):555 -9.
[21]Li L,Zhang Z H,Zhao W D.Apoptosis of MR2 cells induced by TanshinoneⅡ A combined with arsenic trioxide[J].J Sichuan Univ(Med Sci Ed),2009,40(5):812-6.
[22]Chen W X,Luo Y,Liu L,et al.Cryptotanshinone inhibits cancer cell proliferation by suppressing mammalian target of rapamycinmediated cyclin D1 expression and Rb phosphorylation[J].Cancer Prevent Res,2010,3(8):1015 -25.
[23]Ge Y Q,Cheng R B,Zhou Y H,et al.Cryptotanshinone induces cell cycle arrest and apoptosis of multidrug resistant human chronic myeloid leukemia cells by inhibiting the activity of eukaryotic initiation factor 4E[J].Mol Cell Biochem,2012,368(1 -2):17 -25.
[24]Kim J H,Jeong S J,Kwon T R,et al.Cryptotanshinone enhances TNF-alpha-induced apoptosis in chronic myeloid leukemia KBM-5 cells[J].Apoptosis,2011,16(7):696 -707.
[25]Park I J,Kim M J,Park O J,et al.Cryptotanshinone induces ER stress-mediated apoptosis in HepG2 and MCF7 cells[J].Apoptosis,2012,17(3):248 -57.
[26]Zhao M,Jiang B,Gao F H.Small molecule inhibitors of STAT3 for cancer therapy[J].Curr Med Chem,2011,18(26):4012 -8.
[27]Shin D S,Kim H N,Shin K D,et al.Cryptotanshinone inhibits constitutive signal transducer and activator of transcription 3 function through blocking the dimerization in DU145 prostate cancer cells[J].Cancer Res,2009,69(1):193 - 202.
[28]Lee W Y,Chiu L C,Yeung J H.Cytotoxicity of major tanshinones isolated from Danshen(Salvia miltiorrhiza)on HepG2 cells in relation to glutathione perturbation[J].Food Chem Toxicol,2008,46(1):328-38.
[29]Luo Y,Chen W X,Zhou H Y,et al.Cryptotanshinone inhibits lymphatic endothelial cell tube formation by suppressing VEGFR-3/ERK and small GTPase pathways[J].Cancer Prevent Res,2011,4(12):2083-91.
[30]Lee C Y,Sher H F,Chen H W,et al.Anticancer effects of tanshinoneⅠ in human non-small cell lung cancer[J].Mol Cancer Therap,2008,7(11):3527 -38.
[31]Lee D S,Lee S H.Biological activity of dihydrotanshinone I:effect on apoptosis[J].J Biosci Bioeng,2000,89(3):292 - 3.
[32]Tsai S L,Suk F M,Wang C I,et al.Anti-tumor potential of 15,16-dihydrotanshinone I against breast adenocarcinoma through inducing G1 arrest and apoptosis[J].Biochem Pharmacol,2007,74(11):1575-86.
[33]Bian W,Chen F,Bai L,et al.Dihydrotanshinone I inhibits angiogenesis bothin vitroandin vivo[J].Acta Biochim Biophys Sin(Shanghai),2008,40(1):1-6.
[34]Suk F M,Jou W J,Lin R J,et al.15,16-Dihydrotanshinone I-induced apoptosis in human colorectal cancer cells:involvement of ATF3[J].Anticancer Res,2013,33(8):3225 -31.
[35]Chuang M T,Ho F M,Wu C C,et al.15,16-Dihydrotanshinone I,a compound of salvia miltiorrhiza bunge,induces apoptosis through inducing endoplasmic reticular stress in human prostate carcinoma cells[J].Evid Based Complement Alternat Med,2011,2011:865435.
