寻常型天疱疮患者抗原特异性Th细胞的研究
2014-12-04董娟王颖朱海琴许人超郑捷潘萌
董娟 王颖 朱海琴 许人超 郑捷 潘萌
寻常型天疱疮患者抗原特异性Th细胞的研究
董娟 王颖 朱海琴 许人超 郑捷 潘萌
目的探讨寻常型天疱疮(pemphigus vulgaris,PV)患者抗原特异性Th1和Th2细胞在不同疾病阶段的变化,进一步了解自身反应性T细胞在疾病中的作用。方法收集24例PV患者资料,合成桥粒芯糖蛋白抗原肽段DG3(96~112)。体外用该肽段分别刺激患者的外周血单一核细胞(PBMC),用酶联免疫斑点(ELISPOT)方法检测干扰素(IFN)-γ+Th1细胞和白介素(IL)-4+Th2细胞的数量,以及记忆性B细胞的数量。用t检验或单因素方差分析(one-way ANOVA)对各组数值进行比较,用Pearson相关系数对Th细胞、记忆性B细胞及抗桥粒芯糖蛋白3(Dsg3)抗体滴度进行相关性分析。结果24例PV患者男女比例1.67∶1,平均年龄(56.59±14.66)岁。5×105个PBMC中,PV患者特异性IFN-γ+Th1细胞绝对数为420.18±350.29,高于健康对照145.12±86.56,差异有统计学意义(P<0.05)。PV患者特异性IL-4+Th2的细胞数(366.76±192.44)与健康对照(335.88±164.96)之间差异无统计学意义。PV患者外周血中特异性IL-4+Th2占总Th2细胞的百分率为37.03%±23.44%,特异性IFN-γ+Th1细胞为23.62%±16.77%;7例患者进行了治疗前后的自身对照比较。特异性IL-4+Th2细胞的数量在治疗后(241.68±160.60)较治疗前(452.82±199.29)明显下降,差异有统计学意义(t=2.48,P<0.05)。特异性Th细胞、记忆性B细胞及抗Dsg3抗体滴度之间无统计学相关性(均P>0.05)。结论抗原肽段DG3(96~112)含有被PV患者特异性Th细胞识别的致病性抗原表位;特异性IFN-γ+Th1细胞和IL-4+Th2细胞均在疾病中发挥一定的作用;特异性IL-4+Th2细胞在疾病活动中可能起到了更重要的致病作用。
天疱疮;Th1细胞;Th2细胞;表位,T淋巴细胞;ELISPOT
寻常型天疱疮(PV)是一种自身免疫性大疱性皮肤病,其自身抗原成分是角质形成细胞(KC)间桥粒结构中的桥粒芯糖蛋白3(desmoglein3,Dsg3)。对自身抗原免疫耐受的丧失是自身免疫病产生的前提条件,Th细胞与B细胞之间存在一种正反馈的相互调节作用[1]。已有多种研究对Dsg3特异性Th1及Th2细胞进行检测[2-7],但是研究方法的不同,所检测的Th细胞类型及其所分泌的细胞因子也不尽相同。Lin等[2]研究发现PV患者外周血T细胞体外经Dsg3胞外肽段刺激后有增殖反应,主要是CD4+T细胞,产生白介素(IL)-1、IL-6等Th2类细胞因子。Veldman等[3]利用磁珠分选(MACS)方法在急性期、慢性活动期及缓解期PV患者外周血中均检测到自身反应性干扰素(IFN)-γ+Th1及IL-4+Th2细胞,Th2细胞在不同疾病阶段无差异,而Th1细胞主要出现在慢性活动期,抗体滴度与自身反应性Th1/Th2的比值直接相关。Rizzo等[4]发现,急性期患者外周血中特异性Th2细胞较缓解期明显增多,但是Th1/Th2的比值与疾病活动度及抗体滴度无关。我们通过流式细胞仪发现患者中存在Th1与Th2的失衡,细胞免疫应答向Th2型偏移[5]。但该研究是对细胞在外周血中总的比例的分析,未进一步对抗原特异性的免疫活性细胞进行研究。为了更好地揭示活性Th细胞在疾病中的作用,本研究在前期工作的基础上用酶联免疫斑点(ELISPOT)方法在免疫活性细胞的水平对抗原特异性的自身反应性Th1、Th2细胞进行分析,并进一步明确这些免疫活性细胞在PV发病中的作用。
对象和方法
一、对象
1.PV患者及健康对照:24例我院收治的经临床、组织病理、免疫荧光检测确诊的PV患者,均含有高滴度的抗Dsg3抗体。根据病程及治疗情况,将所有患者分为3组,即未治疗组、治疗组和复发组。未治疗组是指初发患者,未经过任何治疗;治疗组是指已接受系统糖皮质激素或其他免疫抑制剂治疗;复发组是指病情稳定1个月以上,又出现新发皮损或黏膜损害。健康对照为10例健康体检者。本研究经过医院伦理委员会批准,患者均签署知情同意书。治疗前采集所有患者及健康对照外周血,治疗后病情好转时(注:患者大约每2周随访1次,随访时1周内无新发皮损,原有皮损逐渐愈合视为好转,治疗后平均约1个月)再次采集7例患者外周静脉血,利用Ficoll淋巴细胞分离液分离出PBMC,暂时液氮中冻存备用。
2.肽段:根据文献[8],选取 Dsg3 抗原特异性肽段DG3(96~112),及对照肽段DG3(730~750),送上海吉尔生化公司合成。
3.主要试剂:IFN-γ/IL-4 precoated ELISPOT试剂盒购自北京达科为生物技术有限公司,人IgG B细胞ELISPOT试剂盒购自荷兰U-CyTech biosciences,RPMI 1640细胞培养基、胎牛血清(FBS)购自美国Gibco公司,96孔板购自美国Millipore公司。
二、方法
1.ELISPOT检测PBMC中Th细胞:将冻存的细胞复苏。在预包被板中加入200 μl/孔RPMI 1640培养基,室温静置10 min后将其移除,加入100 μl/孔的细胞悬液,使最终细胞数为0.5~2×105/孔。空白对照孔中不加任何处理因素,阳性对照孔中加入终浓度为20 mg/L的PHA,实验孔内加入终浓度10 mg/L的肽段DG3(96~112)或DG3(730~750)。盖好板盖,于100%湿度、37℃ 5%CO2培养箱中培养20 h。1×洗涤缓冲液洗涤5次后,加入生物素标记的抗IFN-γ或IL-4的一抗工作液,100 μl/孔,37℃孵育1 h,洗涤后加入辣根过氧化物酶(HRP)标记的二抗工作液100 μl/孔,37℃孵育1 h,洗涤后加入3-氨基-9-乙基咔唑(AEC)显色液 100 μl/孔,室温避光静置15~45 min。终止显色,置室温阴凉处自然晾干,行斑点计数。
2.ELISPOT检测PBMC中记忆性B细胞:用新鲜的含10%FBS的RPMI 1640培养基制备(0.5~2)×106/ml的细胞悬液,加入圆底48孔板中。空白对照孔中不加任何处理因素,阳性对照孔加入终浓度10 mg/L的B细胞刺激物,实验孔加入终浓度10 mg/L的肽段DG3(96~112),混匀后置100%湿度、37℃5%CO2培养箱中5 d。收集培养板中的细胞,制备细胞悬液。在96孔millipore板中加入70%乙醇25 μl/孔,室温放置1 min后将其移除,用PBS-I洗涤2次。加入包被抗体50 μl/孔,4℃孵育过夜。PBS-I洗涤3次后,加入1×封闭缓冲液R 200 μl/孔,37 ℃孵育 1 h。弃去孔内液体,加入 100 μl细胞悬液,使细胞数为(0.2~2)×105/孔,置100%湿度、37℃5%CO2培养箱中培养7 h。弃去孔内液体,用PBS-I溶液洗涤2次。用1×洗涤缓冲液洗涤5次,加入生物素标记的检测抗体100 μl/孔,37℃孵育1 h。洗涤后加入辣根过氧化物酶标记链霉亲和素(streptavidin-HRP)溶液 100 μl/孔,37 ℃孵育1 h。洗涤后加入AEC底物溶液100 μl/孔,室温避光孵育45 min,用去离子水冲洗,以终止显色反应,置室温下自然晾干,斑点计数。
3.统计学处理:用SPSS 13.0统计软件对数据进行分析,数据用±s表示,各组间比较用t检验或单因素方差分析(one-way ANOVA)方法进行分析。用Pearson相关系数进行相关性分析。P<0.05表示差异有统计学意义。
结 果
一、临床资料
24例PV患者,男15例,女9例,男∶女为1.67∶1,发病年龄19~78岁,平均(56.59±14.66)岁,病程2个月至7年。根据病程及治疗情况,将患者分为未治疗组7例,治疗组10例,复发组7例。各组之间年龄、性别差异均无统计学意义。
二、PBMC抗原特异性Th细胞的数目及比例
PBMC经肽段刺激培养后,Th1及Th2细胞分别被活化并分泌相应的细胞因子。如图1所示,每个点代表一个产生相应细胞因子的细胞。PV患者及健康对照PBMC中均检测到肽段DG3(96~112)特异性IFN-γ+Th1细胞和IL-4+Th2细胞。两组均未检测出肽段DG3(730~750)特异性细胞。
5×105个PBMC中,患者DG3(96~112)特异性IFN-γ+Th1细胞绝对数为420.18±350.29,高于健康对照组145.12±86.56,差异有统计学意义(t=3.25,P<0.05);未治疗组IFN-γ+Th1细胞绝对数为351.85±170.83,治疗组为383.26±269.81,复发组为312.96±182.40,3组细胞数均较健康对照组明显升高,但未治疗组、治疗组和复发组三者之间差异无统计学意义。PV患者特异性IL-4+Th2的细胞数为366.76±192.44,与健康对照(335.88±164.96)之间,差异无统计学意义(t=0.44,P>0.05)。
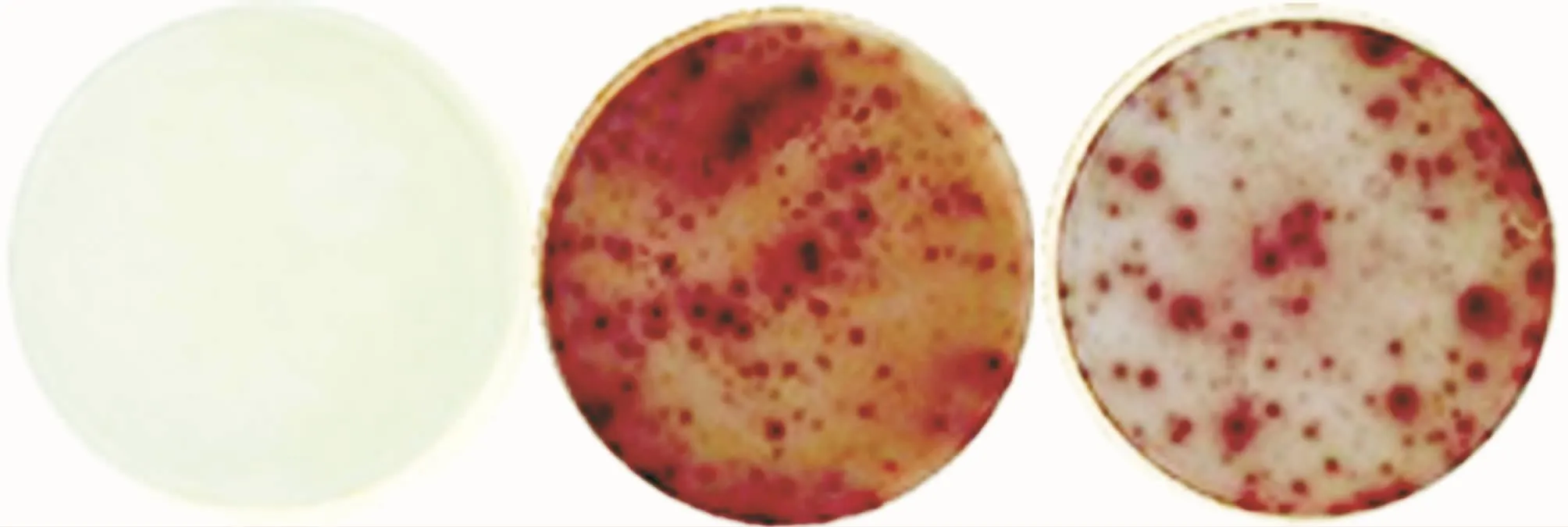
图1 干扰素(IFN)-γ+Th1细胞和白介素(IL)-4+Th2细胞的酶联免疫斑点(ELISPOT)分析图示 1a:空白对照;1b:产生IFN-γ的Th1细胞;1c:产生IL-4的Th2细胞
我们分析PV患者中特异性IFN-γ+Th1细胞和IL-4+Th2细胞各占总Th1和Th2细胞的百分比。患者特异性IL-4+Th2细胞的比例为37.03%±23.44%,特异性IFN-γ+Th1细胞比例为23.62% ±16.77%,差异有统计学意义(t=2.28,P<0.05)。
7例患者进行了治疗前后的自身对照比较,治疗后病情较前均有所缓解。PV患者单位数量(5×105)PBMC中,DG3(96~112)特异性IFN-γ+Th1细胞的数量在治疗前(483.00±409.01)与治疗后(512.33±319.47)差异无统计学意义(t=0.17,P>0.05);特异性IL-4+Th2细胞数量在治疗后(241.68±160.60)较治疗前(452.82±199.29)明显下降,差异有统计学意义(t=2.48,P<0.05)。
三、PBMC抗原特异性记忆性B细胞的数量
10例PV患者均检测到DG3(96~112)特异性记忆性B细胞[(4.21~197.86)个/5×105PBMC)],5例健康对照检测到记忆性B细胞(<20.00个/5×105PBMC),PV患者特异性记忆性B细胞数(83.70±63.90)较健康对照(12.03±18.81)有所升高,但差异无统计学意义(t=1.02,P>0.05)。
四、免疫细胞及抗体滴度之间的相关性分析
对特异性IFN-γ+Th1细胞,IL-4+Th2细胞,记忆性B细胞,抗Dsg3抗体滴度四者之间的相关性进行分析。特异性IL-4+Th2细胞与抗Dsg3抗体滴度之间(R=0.376,P>0.05),特异性Th1/Th2比值与抗Dsg3抗体滴度之间(R=0.114,P>0.05),特异性Th细胞与记忆性B细胞之间(R=0.203,P>0.05),记忆性B细胞与抗Dsg3抗体滴度之间(R=0.268,P>0.05)相关性均无统计学意义。
讨 论
在自身免疫性疾病中,免疫细胞对自身抗原免疫耐受的丧失是疾病产生的前提条件,最终引起细胞免疫或体液免疫应答,导致组织破坏[9]。目前,越来越多的研究发现,PV是一种主要以自身抗体发挥致病作用的疾病,而T细胞尤其是Th细胞在疾病的发生和发展中也起重要的作用[2,5-10]。Veldman 等[8]通过体外培养PV自身反应性T细胞,发现绝大部分T细胞克隆可识别肽段DG3(96~112),该肽段含有能被自身反应性T细胞识别的特殊结构。因此本文主要应用肽段DG3(96~112)检测外周血特异性Th细胞。结果显示PV患者外周血中存在DG3(96~112)特异性Th细胞,但未检测到结构特性与其相似的胞内肽段DG3(730~750)特异性的Th1或Th2细胞,从而证实肽段DG3(96~112)是该病重要的致病位点,发挥免疫原性和免疫反应性。
有文献报道,PV患者体内存在特异性Th1细胞和 Th2 细胞,两者共同参与 PV 的发生和发展[3-4,11-12]。对于两种细胞及其分泌的细胞因子在疾病发生发展中所起作用的大小,不同的研究结果不同。我们利用ELISPOT方法,在特异性活性细胞的水平,研究IFN-γ+Th1细胞和IL-4+Th2细胞在疾病中的作用。区别于免疫吸附法等其他手段,ELISPOT具有特异性高、灵敏度高的优势。我们发现PV患者特异性IFN-γ+Th1细胞的数量较健康对照明显升高,可能与皮损部位的炎症反应有关。Th1细胞可辅助增强细胞毒性T细胞(Tc细胞)、巨噬细胞等的反应,参与诱导角质形成细胞凋亡等,而PV患者皮疹较重,可表现为大面积的糜烂渗出,伴有严重的炎症反应,使主要介导炎症反应的Th1细胞免疫应答增强。目前免疫学研究提示,IFN-γ+Th1亦可辅助自身反应性B细胞产生相应的抗体及其他炎症因子[3,13-14]。我们的研究发现,虽然PV患者特异性IL-4+Th2细胞的绝对值和健康对照差异不大,进一步分析后发现此类细胞占总的IL-4+Th2细胞的百分比较高,高于特异性Th1细胞的百分比。另外,对部分患者进行治疗前后的比较发现,特异性IL-4+Th2细胞在治疗后明显下降,进一步证明特异性Th2细胞在疾病中发挥重要的致病作用,而且与疾病的严重度相平行。但是,在相关性的分析中,无论是Th1细胞还是Th2细胞与记忆性B细胞及抗体滴度间均无明显的相关性,究其原因,可能和样本数量偏小有关,我们需要在今后的工作中积累更多的病例,进行深入研究。
综上所述,在PV的发病过程中,特异性IFN-γ+Th1细胞和IL-4+Th2细胞发挥了不同的作用,而特异性IL-4+Th2细胞在疾病活动中可能起了重要的致病作用,其数值变化可作为指导治疗、评判疗效的重要指标。
[1]Shlomchik MJ,Craft JE,Mamula MJ.From T to B and back again:positive feedback in systemic autoimmune disease[J].Nat Rev Immunol,2001,1(2):147-153.
[2]Lin MS,Swartz SJ,Lopez A,et al.Development and characterization of desmoglein-3 specific T cells from patients with pemphigus vulgaris[J].J Clin Invest,1997,99(1):31-40.
[3]Veldman C,Stauber A,Wassmuth R,et al.Dichotomy of autoreactive Th1 and Th2 cell responses to desmoglein 3 in patients with pemphigus vulgaris(PV)and healthy carriers of PV-associated HLA class II alleles[J].J Immunol,2003,170(1):635-642.
[4]Rizzo C,Fotino M,Zhang Y,et al.Direct characterization of human T cells in pemphigus vulgaris reveals elevated autoantigenspecific Th2 activity in association with active disease[J].Clin Exp Dermatol,2005,30(5):535-540.
[5]Zhu H,Chen Y,Zhou Y,et al.Cognate Th2-B cell interaction is essential for the autoantibody production in pemphigus vulgaris[J].J Clin Immunol,2012,32(1):114-123.
[6]Wucherpfennig KW,Yu B,Bhol K,et al.Structural basis for major histocompatibility complex(MHC)-linked susceptibility to autoimmunity:charged residues of a single MHC binding pocket confer selective presentation of self-peptides in pemphigus vulgaris[J].Proc Natl Acad Sci U S A,1995,92(25):11935-11939.
[7]Hertl M,Riechers R.Analysis of the T cells that are potentially involved in autoantibody production in pemphigus vulgaris[J].J Dermatol,1999,26(11):748-752.
[8]Veldman CM,Gebhard KL,Uter W,et al.T cell recognition of desmoglein 3 peptides in patients with pemphigus vulgaris and healthy individuals[J].J Immunol,2004,172(6):3883-3892.
[9]Choe S,Rizzo C,Ravitskiy L,et al.The role of T cells in cutaneous autoimmune disease[J].Autoimmunity,2005,38(4):303-317.
[10]Nishifuji K,Amagai M,Kuwana M,et al.Detection of antigenspecific B cells in patients with pemphigus vulgaris by enzymelinked immunospot assay:requirement of T cell collaboration for autoantibody production [J].J Invest Dermatol,2000,114(1):88-94.
[11]Hertl M,Amagai M,Sundaram H,et al.Recognition of desmoglein 3 by autoreactive T cells in pemphigus vulgaris patients and normals[J].J Invest Dermatol,1998,110(1):62-66.
[12]Eming R,Büdinger L,Riechers R,et al.Frequency analysis of autoreactive T-helper 1 and 2 cells in bullous pemphigoid and pemphigus vulgaris by enzyme-linked immunospot assay[J].Br J Dermatol,2000,143(6):1279-1282.
[13]Bhol K,Natarajan K,Nagarwalla N,et al.Correlation of peptide specificity and IgG subclass with pathogenic and nonpathogenic autoantibodies in pemphigus vulgaris:a model for autoimmunity[J].Proc Natl Acad Sci U S A,1995,92(11):5239-5243.
[14]Spaeth S,Riechers R,Borradori L,et al.IgG,IgA,IgE autoantibodies against the ectodomain of desmoglein 3 in active pemphigus vulgaris[J].Br J Dermatol,2001,144(6):1183-1188.
2013-01-05)
(本文编辑:尚淑贤)
Antigen-specific helper T cells in patients with pemphigus vulgaris
Dong Juan,Wang Ying,Zhu Haiqin,Xu Renchao,Zheng Jie,Pan Meng*.*Department of Dermatology,Ruijin Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai 200025,China
Pan Meng,Email:panmeng@medmail.com.cn
ObjectiveTo study the changes of antigen-specific T helper type 1(Th1)cells and Th2 cells in patients with pemphigus vulgaris(PV)at different stages,so as to better understand the roles of autoreactive T cells in PV.MethodsThe DG3(96-112)peptide was synthesized.Twenty-four patients with PV and 10 health checkup examinees were included in this study.Peripheral blood mononuclear cells(PBMCs)were obtained from the health checkup examinees and all the patients before treatment and seven patients about one month after treatment,and stimulated with the DG3 peptide of 10 mg/L for different durations.Then,enzyme-linked immunospot(ELISPOT)assay was performed to count the number of DG3-specific IFN-γ+Th1 cells,IL-4+Th2 cells and memory B cells.One-way analysis of variance(ANOVA)andttest were done to compare the number of cells between different groups,and Pearson correlation coefficient was used to evaluate the correlation among Th cells,memory B cells and anti-desmoglein 3(Dsg3)antibody titers.ResultsIn these patients,the male to female ratio was 1.67∶1,and the average age was(56.59 ± 14.66)years.Compared with the health check-up examinees,the patients with PV showed a higher absolute number of DG3-specific IFN-γ+Th1 cells(420.18 ± 350.29 vs.145.12 ±86.56,t=3.25,P< 0.05),but a similar absolute number of specific IL-4+Th2 cells(366.76 ± 192.44 vs.335.88 ±164.96,P>0.05)per 5×105PBMCs.The percentage of DG3-specific IL-4+Th2 cells in Th2 cells was 37.03% ±23.44%,and the percentage of IFN-γ+Th1 cells was 23.62% ± 16.77%in peripheral blood of patients with PV.The number of DG3-specific IL-4+Th2 cells per 5×105PBMCs significantly decreased from 452.82±199.29 before treatment to 241.68±160.60 after treatment in seven patients(t=2.48,P<0.05).There was no significant correlation between specific Th cells,memory B cells and anti-Dsg3 antibody titers(allP> 0.05).ConclusionsThe peptide DG3(96-112)has pathogenic epitopes which could be recognized by specific Th cells of patients with PV.Both antigen-specific IFN-γ+Th1 cells and IL-4+Th2 cells play certain roles in the pathogenesis of pemphigus vulgaris,and IL-4+Th2 cells appear to be more important.
Pemphigus;Th1 cells;Th2 cells;Epitopes,T-lymphocyte;ELISPOT
10.3760/cma.j.issn.0412-4030.2014.01.004
国家自然科学基金(81171499);上海市科委基础研究重点项目(10JC1410600)
200025上海交通大学医学院附属瑞金医院皮肤科[董娟(现在郑州大学第一附属医院皮肤科,450052)、朱海琴、许人超、郑捷、潘萌];上海市免疫学研究所(王颖)
潘萌,Email:panmeng@medmail.com.cn
