国内外不同厂家马来酸依那普利片在4种溶出介质中溶出曲线的比较
2014-12-03姜建国宋更申张西如河北省药品检验研究院石家庄050011
孙 婷,姜建国,宋更申,张西如(河北省药品检验研究院,石家庄 050011)
考察在多种pH溶出介质中的溶出曲线是评价口服固体制剂内在质量的一种重要手段。该试验可用于评估不同来源的同一品种制剂内在质量的差异[1]。马来酸依那普利片系血管紧张素转换酶抑制剂,是一种非处方药,临床上主要用于各期原发性高血压、肾性高血压、充血性心力衰竭等的治疗。大量的临床研究证明,马来酸依那普利片在减轻左心室肥厚及胰岛素抵抗方面优于其他部分降压药物,其已被公认为对靶器官有保护作用[2]。基于以上优点,目前国内市场上生产马来酸依那普利片仿制药的企业较多,而不同企业生产的仿制药产品质量可能存在一定的差异,导致临床疗效反应不一。这种疗效的差异与药物生物利用度紧密相关[3],而溶出度是反映药物生物利用度最直接的方式。
本试验参考有关文献[4-6],采用高效液相色谱(HPLC)法,按照《中国药典》2010年版二部附录ⅩC第二法(桨法)进行操作[7],比较了市售3个国内企业生产的马来酸依那普利片与国外原研药在4种不同pH溶出介质中的溶出曲线,以期为仿制药质量一致性评价工作开展以及该制剂生产工艺提高提供参考。
1 材料
RC12A型溶出仪(天津天大天发科技有限公司);Agilent 1260型HPLC仪,包括G1311C四元泵、G1329B自动进样器、G1316A柱温箱、G1314紫外可变波长检测器等(美国Agilent公司);XS105型十万分之一电子天平(瑞士梅特勒-托利多公司)。
马来酸依那普利对照品(中国食品药品检定研究院,批号:100705-200902,质量分数:99.8%);马来酸依那普利片(国内A企业,批号:11081511,规格:每片5mg;国内B企业,批号:120401,规格:每片5mg;国内C企业,批号:12060802,规格:每片5mg;国外D企业——美国默沙东公司,批号:120849,规格:每片5mg);磷酸二氢钾、氢氧化钠、马来酸和盐酸均为分析纯,试验用水为去离子纯净水。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Zorbax Eclipse XDB-C8(150m×4.6mm,5μm);流动相:0.01mol/L磷酸二氢钾溶液(用磷酸调pH至2.2)-乙腈(75∶25,V/V);流速:1.0ml/min;检测波长为215 nm;进样量:50μl,柱温:50℃。
2.2 溶液的制备
2.2.1 4种溶出介质的制备 pH 1.0盐酸溶液:取盐酸9.0ml,加水稀释至1000ml,摇匀,即得。pH 4.5磷酸盐缓冲液:取0.2mol/L磷酸二氢钾溶液250ml,加水稀释至1000ml,摇匀,即得。pH 6.8磷酸盐缓冲液:取0.2mol/L磷酸二氢钾溶液250ml,与0.2mol/L氢氧化钠溶液112ml混合后,加水稀释至 1000ml,摇匀,即得。水:为去离子纯净水(经测定pH为6.5)。上述4种溶出介质用水均采用脱气装置经40℃脱气40 min后立即使用。
2.2.2 对照品溶液的制备 精密称取马来酸依那普利对照品约10mg,以甲醇溶解于100ml量瓶中,并稀释至刻度。精密量取上述溶液适量,分别加相应的“2.2.1”项下4种不同pH溶出介质定量稀释制成每1ml中约含5µg的溶液,作为对照品溶液。
2.2.3 供试品溶液的制备 取样品适量,按照《中国药典》2010年版(二部)附录ⅩC第二法(桨法),分别采用“2.2.1”项下4种不同pH溶出介质,溶出介质体积900ml,溶出温度(37.0±0.5)℃,转速50r/min,依法操作,经时30min,取溶出液适量,滤过,作为供试品溶液。
2.2.4 空白对照溶液的制备 精密称取马来酸约10mg,以甲醇溶解于100ml量瓶中,稀释至刻度。精密量取上述溶液适量,分别加相应的“2.2.1”项下4种不同pH溶出介质定量稀释制成每1ml中约含5µg的溶液,作为空白对照溶液。
2.3 系统适用性考察
取“2.2”项下对照品溶液、供试品溶液、空白对照溶液各适量(溶出介质为水),按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可见,马来酸依那普利峰保留时间约为6.0min,理论板数按马来酸依那普利峰计算不低于900,拖尾因子应不大于2.0;在该色谱条件下,待测成分峰与溶剂及其他杂质峰分离良好。
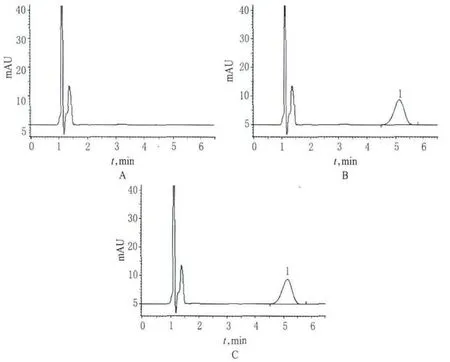
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.4 线性关系考察
精密称取马来酸依那普利对照品约10mg,置于100ml量瓶中,加甲醇适量使溶解并稀释至刻度,摇匀,分别精密量取1、2、5、10、15、20ml,置于100ml量瓶中,分别加“2.2.1”项下4种不同pH溶出介质稀释至刻度,摇匀,分别量取50μl注入HPLC仪,记录色谱。以马来酸依那普利的质量浓度(x,μg/ml)为横坐标,峰面积(y)为纵坐标,进行线性回归,回归方程分别为 y=99.27×105x+23.24×105(r=0.9999)、y=99.22×105x-10.34×105(r=0.9999)、y=99.23×105x-10.36×105(r=0.9999)、y=99.22×105x-10.35×105(r=0.9999)。结果表明,马来酸依那普利检测质量浓度在1.0~20μg/ml范围内与峰面积积分值呈良好的线性关系。
2.5 精密度试验
取“2.2.2”项下4种对照品溶液各适量,分别按“2.1”项下色谱条件连续进样6次,测定峰面积。结果,马来酸依那普利峰面积的RSD分别为0.04%(pH 1.0盐酸溶液)、0.02%(pH 4.5磷酸盐缓冲液)、0.02%(pH 6.8磷酸盐缓冲液)、0.03%(水),表明仪器的精密度良好。
2.6 稳定性试验
取按“2.2.3”项下方法制备的供试品溶液(D企业样品,批号:120849)适量,于室温下放置,在12h内每隔2h进样1次,测定峰面积。结果,马来酸依那普利峰面积的RSD分别为0.66%(pH 1.0盐酸溶液)、0.04%(pH 4.5磷酸盐缓冲液)、0.23%(pH 6.8磷酸盐缓冲液)、0.14%(水),表明供试品溶液在室温放置12h稳定性良好。
2.7 回收率试验
根据D企业样品(批号:120849)处方,按处方量50%、80%、100%精密称取马来酸依那普利对照品,辅料按处方量100%称取,每个水平各3份,置于不同的900ml量瓶中,分别用“2.2.1”项下4种不同pH溶出介质稀释制成4种待测溶液,按“2.1”项下色谱条件进样测定并计算回收率,结果见表1。
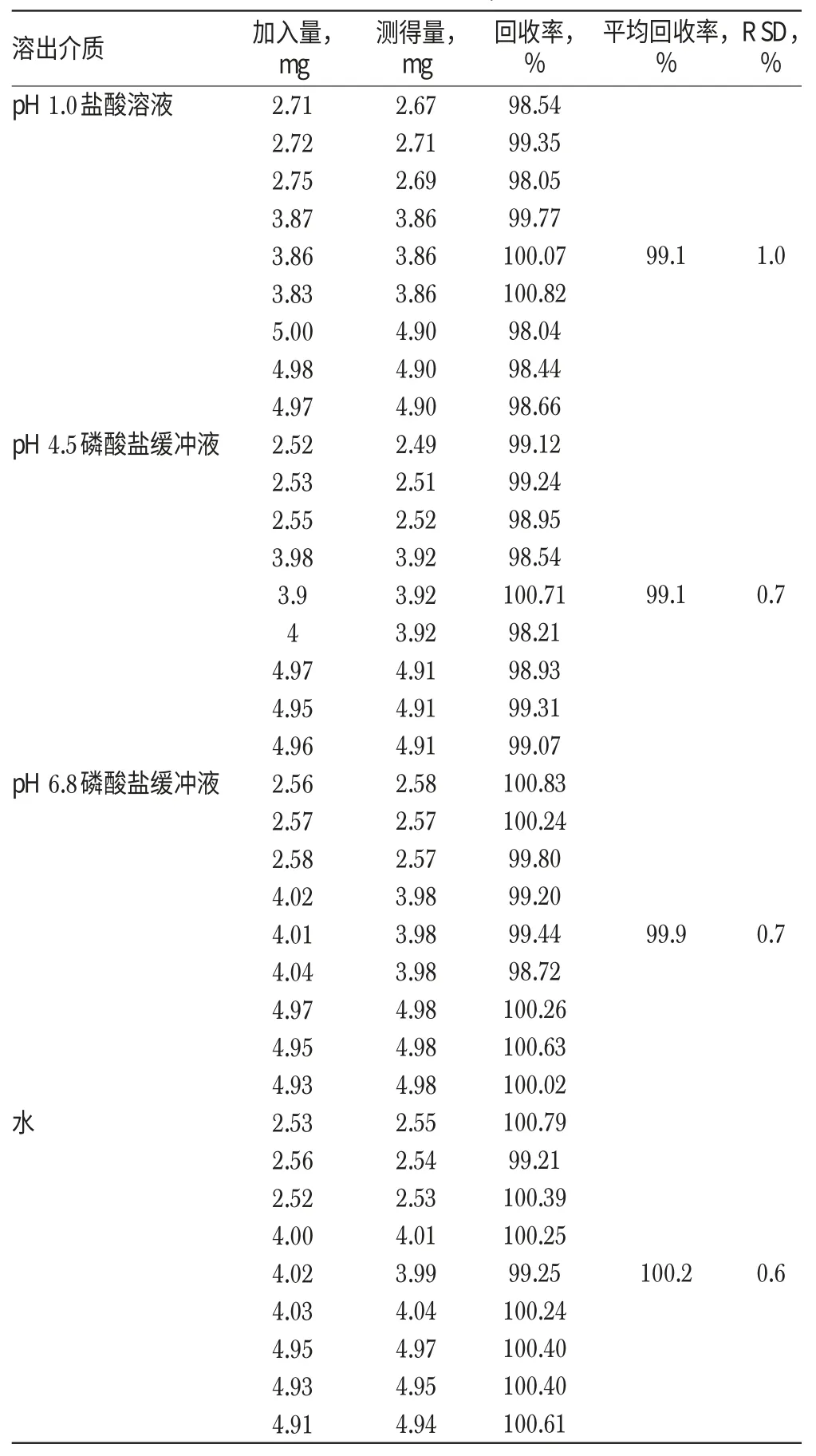
表1 回收率试验结果(n=9)Tab 1 Results of recovery tests(n=9)
2.8 溶出曲线的绘制
取样品12片,按《中国药典》2010年版(二部)附录ⅩC第二法(桨法),分别采用“2.2.1”项下4种不同pH溶出介质,溶出介质体积900ml,溶出温度(37.0±0.5)℃,转速50r/min,依法操作,分别于5、10、15、20、30、45、60、90、120min时取溶出液适量(3~5ml),滤过(具备在线过滤功能的溶出仪无需重复滤过),取续滤液作为供试品溶液,并即时补充相同温度相同体积的溶出介质,继续试验(当连续两点的累积溶出率达85%以上,且差值在5%以内时,试验可以提前结束)。另取马来酸依那普利对照品适量,精密称定,加甲醇溶解并稀释制成每1ml中约含100µg的溶液。精密量取上述溶液适量,分别加相应的“2.2.1”项下4种不同pH溶出介质定量稀释制成每1ml中约含5µg的溶液,作为对照品溶液。精密量取上述供试品溶液和对照品溶液各50μl,分别注入HPLC仪,记录色谱,按外标法以峰面积计算每片在不同时间点的累积溶出率。以12片的平均累积溶出率(%)为纵坐标,时间(min)为横坐标,绘制溶出曲线,结果见图2。
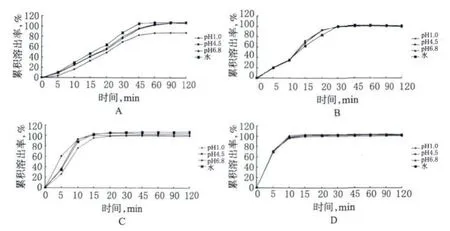
图2 4种马来酸依那普利片在不同溶出介质中的溶出曲线Fig 2 Dissolution curves of 4 kinds of enalaprilmaleate tab⁃lets in different mediums
2.9 溶出曲线的评价
采用美国食品与药品管理局(FDA)推荐使用的f2相似因子法来评价国内企业仿制药(试验药品)与国外原研药(对照药品)体外溶出曲线的相似性,以考察其内在质量的差异。f2计算公式如下:
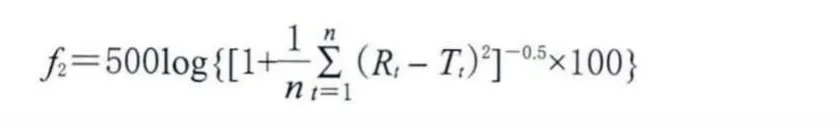
式中,Rt为t时点对照药品的溶出度;Tt为t时点试验药品的溶出度;n为取样点的个数。f2从统计学上度量了两条溶出曲线之间的相似性,f2值越大,说明两条溶出曲线差异越小,若50≤f2≤100,可以推断两条溶出曲线相似;完全相同的两条溶出曲线,其f2=100。选择合适的时间点进行国产马来酸依那普利片在4种溶出介质中的溶出曲线的f2值计算,结果见表2。
3 讨论
3.1 转速的选择
对国内A、B、C企业以及国外D企业样品分别在“2.2.1”项下4种不同pH溶出介质中进行50r/min和75r/min转速对比。结果,50r/min和75r/min转速下,样品溶出曲线无显著差异,参考USP35、《日本药局方》16版马来酸依那普利片溶出度测定的方法和转速,同时考虑本品多数为中老年患者使用,而中老年患者通常胃蠕动较为缓慢,因此将转速选定为50r/min。

表2 4种溶出介质中国产马来酸依那普利片的溶出曲线的f2值Tab 2 The f2 factors of the dissolution curves of domestic Enalaprilmaleate tablets in 4 kinds of dissolution medium
3.2 方法的耐用性
对国内A、B、C企业和国外D企业样品,分别采用Agilent ZORBAX XDB-C8(150mm×4.6mm,5μm)和Waters Sym⁃metry Shield RP C18(150mm×4.6mm,5μm)进行测定并对结果进行比较。结果表明,采用不同色谱柱所达到的理论板数基本一致,说明“2.1”项下色谱条件具有良好的耐用性。
3.3 溶解度的考察
精密称取国外D企业样品(批号:120849)共4份,每份约0.1g,分别加入到“2.2.1”项下不同pH溶出介质(3ml)中,置于(37.0±0.5)℃水浴中加热24h(前2h,每30min振摇一次,每次约1min),24h后分别取上清液;同时取马来酸依那普利对照品配制成15μg/ml的对照品溶液,同法操作。取上述两种溶液分别按“2.1”项下色谱条件进样测定。结果,马来酸依那普利在4种pH溶出介质中的溶解度分别为29、36、35、36mg/ml,说明选择上述不同pH溶出介质进行溶出试验具有可行性。
3.4 色谱条件的选择
3.4.1 色谱柱的选择 USP35、《日本药局方》16版、《中国药典》2010年版均选用C8柱测定马来酸依那普利片的溶出度。通过以上耐用性试验考察可知,采用C18柱与C8柱测定其溶出度,无明显区别。因各国药典均采用C8柱,具有一定的普遍性,因此本次试验仍选用C8柱测定。
3.4.2 流动相的选择 USP35、《日本药局方》16版、《中国药典》2010年版均采用了磷酸盐溶液(用磷酸调pH至2.2)-乙腈作为流动相,不同之处是,USP35、《日本药局方》16版采用磷酸二氢钠,而《中国药典》2010年版采用磷酸二氢钾。钾的离子强度大于钠,离子强度增加将使得色谱柱理论板数增加,同时还会缩短马来酸依那普利的保留时间,因此本试验选择采用磷酸二氢钾。
3.5 试验结果探讨
本试验结果表明,在《中国药典》2010年版规定的溶出介质水中,3家国内企业生产的马来酸依那普利片与国外企业生产的原研药均可在30min时达到溶出标示量75%以上。然而,就“2.2.1”项下4种不同pH溶出介质中总体的溶出曲线而言,3家国内企业仿制药样品与国外原研药样品比较,仅有1家具有相似性。A企业样品在4种溶出介质中均比原研药样品释放速率慢,到达平台期时间较长,且其自身在4种溶出介质中的溶出曲线亦存在差异;B企业样品虽然到达平台期的时间有所提前,但却在上升期出现拐点,仍与原研药样品存在差异;C企业样品与原研药样品的溶出曲线基本相似,但其自身在4种溶出介质中的溶出曲线仍存在一定差异。
3.6 思考与建议
溶出度试验技术是评价口服固体制剂内在质量的一种重要手段,该试验不仅可为建立其体内外相关性提供基础数据,而且有望成为通过体外试验评价其质量的简易、有效、可行的方法。日本自1998年开始实施“药品品质再评价工程”[8],陆续出版了《医部用医药品品质情报集》[即日本参比制剂目录(橙皮书)],其中详细罗列了所收载制剂的4条标准溶出曲线。美国FDA药品审评中心的仿制药办公室属下的生物等效部也于2004年1月起,在其官方网站上推出了“固体制剂溶出曲线数据库”[9]。目前我国虽未推出“溶出曲线数据库”,但对口服固体制剂多条溶出曲线的测定已愈发受到关注与重视。我国于2012年开始实施“仿制药质量一致性评价”工程。马来酸依那普利片属于非处方药,即患者自主用药。若各个厂家生产的制剂与疗效较好的原研制剂存在较大差异,则患者容易在不知情的情况下遭受血压的过度波动及过度变异,从而可能使重要器官受到损害。
由本试验结果可见,用单点单一溶出介质检测药物体外溶出度,各样品的最终溶出度结果都符合标准规定要求,而采用多种pH溶出介质时部分国内仿制药样品溶出曲线与原研药样品相比却存在较大差异。因此,通过多pH溶出介质进行溶出试验更能全面、准确地反映药品的体外释药情况和内在质量,特别是反映了同一厂家不同批次同一样品、不同厂家同一样品间的质量差异,可为仿制药质量一致性评价工作开展提供参考。因此,临床应用时应多加注意,有必要加强对其多pH溶出曲线的实时监控,确保药品质量的有效性、均一性和稳定性,以保障人民群众用药的安全性和有效性。
[1]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946.
[2]何敏,王秋海,孙爱国.抗高血压药物应用进展[J].临床实践,2005,23(3):103.
[3]谢沐风.改善溶出度评价方法,提高固体制剂水平[J].中国医药工业杂志,2005,36(7):447.
[4]刘红,张关敏,张艳华.不同厂家枸橼酸他莫昔芬片的体外溶出度考察[J].中国医院药学杂志,2012,32(6):436.
[5]赵霓.不同厂家卡托普利片在4种溶出介质中的溶出曲线比较研究[J].中国药师,2012,15(6):845.
[6]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308.
[7]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录ⅩC.
[8]Pascual E,Sivera F,Yasothan U,et al.Febuxostat[J].Nat Rev Drug Discov,2009,8(3):191.
[9]Perez-Ruiz F,Dalbeth N,Schlesinger N.Febuxostat,a noveldrug for the treatment of hyperuricemia of gout[J].Future Rheumatol,2008,3(5):421.
