人胆固醇酯水解酶对泡沫细胞的影响及相关机制的研究
2014-12-03关宁王超霍晓川顾立学罗俊生
关宁,王超,霍晓川,顾立学,罗俊生
(辽宁医学院附属第一医院神经外科,辽宁 锦州 121001)
胆固醇脂水解酶(human cholesteryl ester hydro⁃lase,hCEH)存在于人体的各种组织中(肝脏、心脏、肺脏、小肠、脾脏等),以肝脏中含量最多,主要用于水解胆固醇酯为游离胆固醇,并通过细胞表面通道蛋白将游离释放,减少胆固醇酯在细胞内的蓄积,而ATP结合盒转运蛋白A1(ATP⁃binding cassette transporter A1,ABCA1)和ATP结合盒转运蛋白G1(ATP⁃binding cassette transporter G1,ABCG1)是细胞膜上两种主要的转运蛋白,其中ABCA1能促进胆固醇和磷脂从细胞释放到载脂蛋白A⁃Ⅰ(apolipopro⁃tein A⁃Ⅰ,apoA⁃Ⅰ),而ABCG1可以促进胆固醇外流至细胞外高密度脂蛋白(high density lipoprotein,HDL)受体[1],从而借助受体蛋白将肝外游离胆固醇运送回肝脏进行最终的清除。本实验通过先前构建的hCEH重组腺病毒载体[2],转染RAW 264.7小鼠单核巨噬细胞,观察hCEH对泡沫细胞的影响及hCEH上调ABCA1和ABCG1表达的相关作用机制。
1 材料与方法
1.1 材料
RAW 264.7小鼠单核巨噬细胞株购自中国医学科学院基础医学研究所,Lenti⁃hCEH⁃IRES⁃EGFP慢病毒载体由本实验室构建,DMEM培养基购自美国GIBCO公司,氧化型低密度脂蛋(ox⁃LDL)购自北京协生生物科技有限公司,RIPA裂解液、BCA、PMSF蛋白浓度测定试剂盒,内参照β⁃actin购自Santa Cruz公司,ABCA1兔多克隆一抗、ABCG1兔多克隆一抗、羊抗人CEH一抗均购自Abcam公司。
1.2 单核巨噬细胞培养与慢病毒转染
将RAW 264.7小鼠单核巨噬细胞株置于无菌培养瓶中培养,加入含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2培养箱中贴壁培养。将处于对数生长期的RAW 264.7细胞进行胰酶消化,制成细胞悬液接种于24孔培养板中,37℃、5%CO2培养箱培养,待细胞融合度达80%分别加入100 μL目的及对照病毒液,同时加入终浓度为8 μg/mL的佛波酯促进感染。同时设立hCEH组(vector组)作为对照。
1.3 细胞泡沫化
取转染后的细胞进行实验,将细胞密度调整为1×106/mL,加入6孔培养板中培养。加入ox⁃LDL,浓度为100 mg/L,与单核巨噬细胞共同孵育,诱导其泡沫化。
1.4 油红O染色和脂质染色的半定量分析
分别于4 h、8 h、12 h和16 h用10%甲醛将细胞固定细胞,再用油红O方法染色10 min,苏木素染色5 min,1%HC1分色及返蓝后,水洗5 min水性封片剂封片并照相。按Wads[3]方法进行脂质染色的半定量分析,即细胞内脂滴面积<细胞核面积记为“-”,细胞内脂滴面积≥细胞核面积记为“+”,每孔计数100个细胞。
1.5 高效液相色谱(high performance liquid chro⁃matography,HPLC)法
各组细胞处理结束后去除培养基,PBS液冲洗3遍,反复冻融细胞,并在冰浴中用超声裂解。胆固醇使用外标法峰面积定量细胞蛋白(mg/g)。色谱条件为色谱柱:C18;流动相:异丙醇∶正庚烷∶乙腈(35∶12∶52,v/v),非梯度洗脱,流速为1 mL/min;检测波长为210 nm,检测到第8分钟,柱温保持20℃。用CEH水解胆固醇酯得总胆固醇量,以HPLC测定胆固醇并定量,以“总胆固醇量-游离胆固醇量”代表胆固醇酯的含量(mg/g)。
1.6 Western blot检测CEH、ABCA1、ABCG1蛋白质的表达
经泡沫化处理后,将细胞用细胞刮刀刮下,收集至EP管内。用TBS漂洗后加入RIPA缓冲液(1%NP40,0.5%脱氧胆酸钠,0.1%SDS,0.1%PMSF)裂解细胞。于4℃离心10 min,弃除沉淀,用BCA法进行蛋白质定量。加热使蛋白质变性,SDS聚丙烯酰胺凝胶电泳,转膜,丽春红染色观察转移效果,并确定蛋白质分子量标准位置。5%脱脂奶粉封闭过夜,分别加入1∶200稀释的羊抗人CEH一抗、1∶500 ABCA1兔多克隆一抗、1∶2 500 ABCG1兔多克隆一抗,β⁃actin作为内参,4℃培育过夜。TBST洗膜后加入FITC一标记的羊抗兔二抗或辣根过氧化物酶标记的驴抗羊二抗。温育l h,TBST洗膜后进行BCIP/NBT显色,采用Chemi⁃genius凝胶成像系统分析目的蛋白的表达量。
1.7 统计学处理
2 结果
2.1 hCEH在RAW 264.7小鼠单核巨噬细胞中的表达
Lenti⁃hCEH⁃IRES⁃EGFP慢病毒转染RAW 264.7小鼠单核巨噬细胞后,在24 h便可以观察到少量的细胞有荧光表达,48 h后明显增加,72 h接近50%,荧光细胞数最多。我们应用Western blot技术检测慢病毒转染后hCEH mRNA在巨噬细胞的表达,结果可见,hCEH蛋白大量表达,而vector组无条带(图1)。
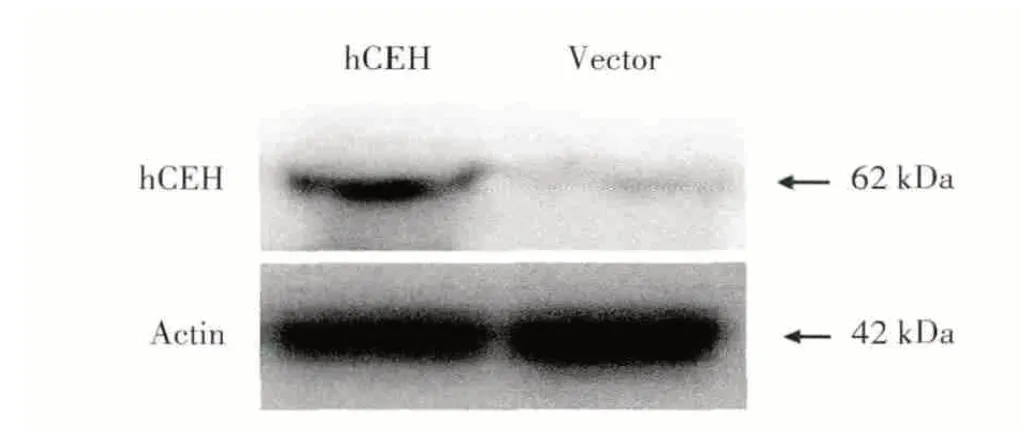
图1 Western blot分析hCEH蛋白质的表达Fig.1 Protein expression of hCEH by Western blot
2.2 hCEH对细胞胆固醇代谢的影响
油红O染色结果显示:0 h,阳性染色细胞遍布,细胞质红染,细胞核呈蓝染,且细胞体积增大,呈圆形或不规则形;4 h,胞质红染变淡;8 h,油红O染色阳性细胞大量减少,细胞核蓝染,随后阳性细胞越来越少,逐渐消失,见图2。油红O染色0 h、4 h、8 h、12 h、16 h阳性细胞分别为(86.70±3.19)%、(46.50±1.62)%、(15.64±2.57)%、(13.68±2.60)%、(12.73±1.47)%。与4 h比较,8 h、12 h和16 h阳性细胞差异有统计学意义(P<0.05);而12 h和16 h比较阳性细胞差异无统计学意义(P>0.05)。

图2 油红O染色示不同时间段ABCA1和ABCG1表达对巨噬细胞泡沫化的影响 ×400Fig.2 The change of foam cells were detected at 0,4,8,12,16 hour after the formation of foam cell,Oil Red O stain was used to visualize lipid droplets in foam cells×400
HPLC检测结果显示:随着时间增加细胞内胆固醇酯、游离胆固醇和总胆固醇含量逐渐下降,与4 h比较,8 h、12 h、16 h胆固醇酯、游离胆固醇和总胆固醇含量下降,差异均有统计学意义(P<0.05),而12 h、16 h指标比较差异无统计学意义(P>0.05),见表2。

表2 高效液相色谱分析不同时间段游离胆固醇、胆固醇酯和总胆固醇含量(mg/g)Tab.2 The cellular free cholesterol,total cholesterol and cholesterol ester by HPLC(mg/g)
2.3 ABCA1和ABCG1对细胞胆固醇代谢的影响
Western blot结果显示:ABCA1和ABCG1表达逐渐增加,8 h达高峰,之后逐渐减少,见图3。
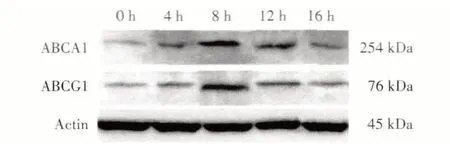
图3 Western blot分析不同时间段ABCA1和ABCG1蛋白质的表达Fig.3 Protein expression of ABCA1 and ABCG1 by Western blot
3 讨论
动脉粥样硬化的防治从宏观角度看,胆固醇逆行转运(reverse cholesterol transport,RCT)过程将肝外游离胆固醇运送回肝脏并最终清除;从微观角度看,细胞表面通道蛋白(如ABCA1和ABCG1)的表达,在不同程度上也促进了RCT的进程。然而,胆固醇稳态的维持是通过许多途径来调节的,清道夫受体CD36和SR⁃A相关联的胆固醇内流起到很重要的作用,但维持这种稳态最重要的途径是胆固醇外流,包括水溶扩散和细胞膜微溶解,内生的载脂蛋白E,细胞外胆固醇受体apoA⁃Ⅰ和HDL,ATP结合盒转运体ABCA1和ABCG1均有效地增加了胆固醇外流[4]。这种胆固醇摄取和排出的平衡一旦打破,泡沫细胞就会在动脉粥样硬化斑块的发生发展中大量产生[5]。
ABCA1和ABCG1都是LXR转录因子的作用靶点,均需要消耗ATP作为能量运输血脂和其他代谢产物。有研究表明,用米非司酮(ABCA1的激动剂)处理转染ABCA1细胞后,胆固醇的流出会显著增加,而没有加入apoA⁃Ⅰ或者未经过米非司酮处理的细胞胆固醇流出无明显增加[6],说明ABCA1通过apoA⁃Ⅰ发挥作用。OX⁃LDL能使巨噬细胞内胆固醇的流出增多,而HDL是清除过多胆固醇的重要受体。使用3H⁃胆固醇与转染ABCG1的细胞和血浆胆固醇共孵育,发现这一过程中,胆固醇不是流出到apoA⁃Ⅰ,而是流出到HDL上[7,8],说明ABCG1是通过HDL起作用。
ABCA1和ABCG1在巨噬细胞的RCT过程中起重要的作用。增加巨噬细胞的ABCA1和ABCG1蛋白表达水平后,在粪便和血浆中的胆固醇有明显增加。用药物抑制ABCAl介导的胆固醇流出途径,胆固醇流出量下降了40%;检测敲除ABCG1基因的小鼠,胆固醇流出量比正常下降 15%[9,10]。
本实验成功将hCEH转染入RAW 264.7小鼠单核巨噬细胞,应用Western blot技术检测到转染Lenti⁃hCEH⁃IRES⁃EGFP后hCEH蛋白在小鼠单核巨噬细胞的表达。泡沫化的hCEH组随着时间增加油红O染色阳性细胞比例逐渐减少,HPLC显示细胞内胆固醇酯、游离胆固醇和总胆固醇含量逐渐下降,在8 h,游离胆固醇含量由4 h的(27.46±1.32)mg/g降至(19.59±2.96)mg/g,胆固醇酯含量由4 h的(31.31±4.26)mg/g降至(9.34±1.35)mg/g,差异有统计学意义(P<0.05),说明在8 h,胆固醇酯降解、游离胆固醇流出增加。然而,Western blot结果显示:在8 h,AB⁃CA1和ABCG1的表达显著增加,说明ABCA1和ABCG1可以有效减少胆固醇酯在细胞内聚集并加强游离胆固醇的流出,抑制细胞泡沫化。
本实验表明,ABCA1和ABCG1是炎症和RCT之间的分子基础,而hCEH mRNA的表达对这一过程起到了激活作用,不断促进胆固醇外流,抑制动脉粥样硬化的形成,从而减少心脑血管梗死的发生。
[1]Fitzgerald ML,Mujawar Z,Tamehiro N,et al.ABC transporter,ath⁃erosclerosis and inflammation[J].Atherosclerosis,2010,211(2):361-370.
[2]关宁,罗俊生,霍晓川,等.hCEH基因慢病毒载体构建及鉴定[J].军医进修学院学报,2012,33(12):1303-1305.
[3]Wada Y,Sugiyama A,Yamamoto T,et al.Lipid accumulation in smooth muscle cells under LDL loading is independent of LDL re⁃ceptor pathway and enhanced by hypoxic conditions[J].Arterio⁃scler Thromb Vasc Biol,2002,22(10):1712-1719.
[4]Meurs L,Lammers B,Zhao Y,et al.The effect of ABCG1 deficiency on therosclerotic lesion development in LDL receptor knockout mice depends on the stage of atherogenesis[J].Atherosclerosis,2012,221(1):41-47.
[5]Williams KJ,Feig JE,Fisher EA.Rapid regression of atherosclero⁃sis:insights from the clinical and experimental literature[J].Nat Clin Pract Cardiovasc Med,2008,5(2):91-102.
[6]Vedhachalam C,Liu L,Nickel M,et a1.Influence of ApoA⁃I struc⁃ture on the ABCA1.Mediated efflux of cellular lipids[J].J Biol Chem,2004,279(48):49931-49939.
[7]Xu M,Zhou H,Tan KC,et a1.ABCG1 mediated oxidized LDL⁃de⁃rived oxysterol efflux from macrophages[J].Biochem Biophys Res Commun,2009,390(4):1349-1354.
[8]Wang N,Lan D,Chen W,et a1.ATP⁃binding cassette transporters G1 and G4 mediate cellular cholesterol efflux to high⁃density lipo⁃pr0teins[J].Proc Natl Acad Sci USA,2004,101(26):9774-9779.
[9]郭赘婧,曹进.ABCA1和ABCG1在胆固醇逆转运中作用的研究进展[J].国外医学医学地理分册,2012,33(3):213-217.
[10]Wang X,Collins HL,Ranalletta M,et a1.Macrophage ABCA1 and ABCG1,but not SR⁃BI,promote macrophage reverse cholesterol transport in vivo[J].J Clin Invest,2007,117(8):2216-2224.
