窦房结细胞钾离子通道结构及电生理研究进展
2014-12-02汪艳丽刘如秀刘金凤
汪艳丽,刘如秀,刘金凤
窦房结是心脏活动的正常起搏点,在心脏传导系统中自律性最高,窦房结细胞自发性动作电位是其自律性产生的基础。钾离子通道种类多,结构复杂,相应钾电流对窦房结细胞自律性的维持发挥重要作用,现就近年国内外对窦房结细胞钾离子通道及电生理特性研究进展作一综述。
1 窦房结细胞的电生理特性
自上世纪80年代心肌细胞电生理领域的兴起,有关窦房结(SAN)自律性离子基础的争议就开始存在,周期性的被各种新的理论所完善或替代[1,2]。SAN主要生理功能是控制并维持心率在一个稳定的水平,SAN中央区可触发动作电位(AP)上升支的舒张期自动去极化,兴奋的动作电位通过窦房结周围的区域扩散到界嵴及心房肌。窦房结细胞(SNC)有最高自律性,产生不同于周围心房肌细胞的自发性动作电位,这一独特电生理特性使SAN能产生节律性心脏搏动。SNC的正常生理功能对正常心脏电生理至关重要[3]。
SNC属于慢反应电位的节律性活动细胞,其AP幅度小,没有稳定的静息电位,AP中没有平台期,只有0、3、4期,4期不稳定,在复极完毕后,能够自动地、缓慢地除极,使膜电位逐渐减小,即4期自动除极(图1)。当除极达到阈电位水平(约-40mV)时即可暴发AP,因此,4期自动除极是形成SNC自律性的基础。该除极过程是通过细胞膜上各种离子流的参与实现的[4]。SNC电兴奋的产生与细胞膜上的各种离子通道直接相关[5]。经典的电生理理论认为参与SNC 4期自动除极的离子流包括超极化激活环核苷酸门控阳离子电流(If)、延迟整流钾电流(IK)、内向钙电流(ICa)等[6,7]。SNC的复极过程保证了SAN自发兴奋性的循环,这种固有的内在循环使SAN为心脏的正常起搏服务[8,9]。
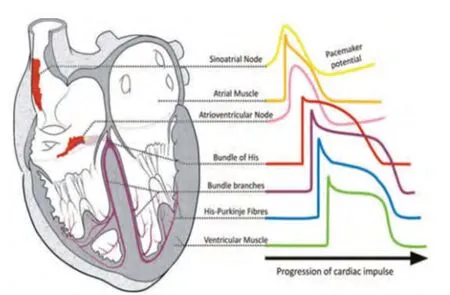
图1 -1 心脏传导系统

图1 -2 窦房结细胞动作电位
早在上世纪50年代,细胞膜兴奋理论认为,细胞膜离子通道的综合作用是心脏起搏的主要机制(Membrane clock,膜钟)。近年来研究发现,SNC的起搏取决于细胞内的Ca2+循环(Ca2+clock,Ca2+钟),SNC肌浆网通过膜上兰尼碱受体释放钙离子,激活钠钙交换,Ca2+钟引发膜钟从而爆发动作电位[10],膜离子通道的循环激活和失活、肌浆网节律性自发释放钙离子共同调节SAN自律性,即Ca2+钟和膜钟共同调控着SNC的起搏功能[3]。因此,产生SNC舒张期去极化的主要机制有:L型钙电流ICaL和T型钙电流ICaT的激活;延迟整流钾电流(IK)的失活;超极化激活环核苷酸门控阳离子通道电流(If)的发展;肌浆网自发性释放钙离子从而激活Na+-Ca2+交换电流(INCX)[10-15]。Brahmajothi[9]认为不同种族中离子通道表达的模式可能也是复杂而变化的。
2 窦房结细胞钾离子通道研究进展
钾离子通道是SNC膜上重要离子通道之一,在SNC自发性动作电位复极过程中发挥重要作用,钾离子通道种类繁多,特征各异。
2.1 钾离子通道的种类和结构 心脏钾离子通道是心肌细胞膜蛋白,该通道亚型多、分布广、作用复杂(图2),其中最大一组是电压门控性钾通道(Kv)家族,主要包括瞬时外向钾电流(Ito)通道、快激活延迟整流钾电流(IKr)通道、慢激活延迟整流钾电流(IKs)通道及超速激活延迟整流钾电流(IKur)通道等。还有一组是配体门控性钾通道,主要有内向整流钾通道(Kir)家族,包括内向整流钾通道(IK1)、乙酰胆碱敏感钾通道(IKACh)、ATP敏感钾通道(IKATP)等。它决定SNC静息膜电位、动作电位形态和时程。钾离子通道表达的区域性不同,决定了从窦房结和心房到心室肌细胞(甚至心室肌内膜到中层到心包膜)动作电位形态和时程的不同[16]。钾离子通道由4个亚单位组成,每个亚单位都由六个跨膜片段(S1~S6)构成、电压感受器S4、存在于S5和S6之间的执行孔道(P)区,每个通道的四个亚单位可以相同也可不同[16]。主要参与组成电压敏感性钾通道(Ito、IKur、IKr、IKs)(图3)。
Brahmajothi等[9]采用免疫荧光法测定出了最接近人类窦房结的雪貂窦房结K离子通道亚单位特征性表达情况,研究了20种来自不同家族的电压门控K通道α亚单位(Kv1.1-Kv1.6,Kv2.1和Kv2.2,Kv3.1-Kv3.4,Kv4.1-Kv4.3,Kv7.1,Kv10.1,Kv11.1-Kv11.3)及3种K通道辅助亚单位(minK,Kv5.1, Kv6.1)。研究发现,在窦房结Kv1通道转染中,高度表达Kv1.1,Kv1.4,Kv1.5,Kv1.1主要集中在SAN中央区,Kv1.4和Kv1.5在整个结区都有表达。提示,窦房结Kv1.1,Kv1.4,Kv1.5亚单位在钾离子通道正常功能中发挥重要作用(图3)。这些研究对理解雪貂正常生理起搏活动具有重要意义,也为人类SNC功能异常的病理生理学研究做出巨大贡献。在窦房结Kv4通道转染中,Kv4.2,Kv4.3和Kv1.4参与瞬时外向钾电流,Kv7.1和Kv11.1分别参与缓慢激活和快速激活的延迟整流钾电流,表明IKs在雪貂窦房结中的作用较小。
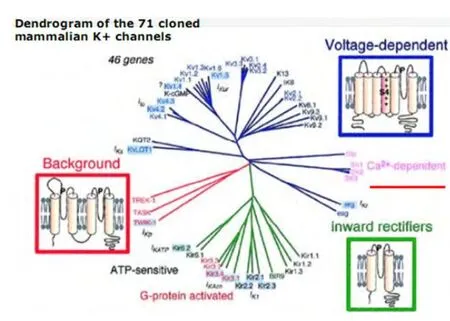
图2 钾离子通道家族结构图
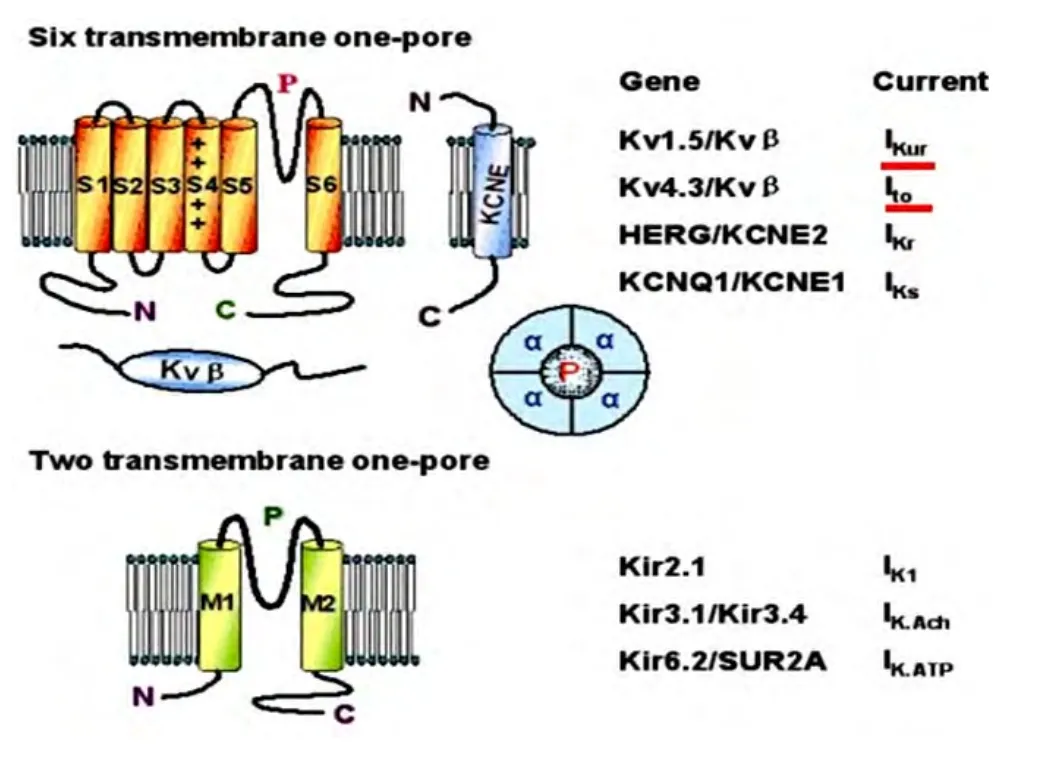
图3 钾离子通道结构示意图
2.2 钾离子通道电流 在SNC中,多种离子流参与其AP不同时相的形成和舒张期自动去极化[9],因此,任何一种离子流发生变化,都可能会使AP发生改变,进而影响整个心脏活动。钾离子电流是心肌细胞去极化后的复极电流,因而对AP时程具有重要意义。钾离子电流种类很多,目前确定至少有四种电压依赖性钾电流(Ito、IKr、IKs、IKur),还有相对于心室肌细胞较少的内向整流钾电流IK1,在SAN起搏过程中各自发挥着不同的作用[17-20]。
2.2.1 瞬时外向钾电流(Ito) Ito是心肌细胞膜上较早发现的一种离子流,是钾通道电流的重要亚型之一,首先在浦肯野细胞上发现,呈电压依赖快速激活和失活,在去极化早期被激活,是SNC动作电位的第一个复极电流,形成快速复极相(1相)[21]。Ito作为复极的主要电流,其电流值和门控动力学特征的改变,影响着动作电位、动作电位时程(APD)及有效不应期。Ito受到细胞微环境(缺氧、PH值变化、代谢产物堆积等)及激素的调控,Ito通道阻滞剂可以使动作电位和不应期延长而发挥抗心律失常作用,因此Ito的异常可能是某些心脏疾病的电生理基础,提示Ito可能作为防治心脏疾病的重要靶点[16,22]。
Ito分两类[23],一类是快成分Ito,fast,是构成AP复极相的主要电流,对4-氨基吡啶(4-AP)敏感,广泛分布于哺乳动物心肌细胞中;另一类是慢成分Ito,slow,又称依赖性氯电流,对4-AP不敏感。Ito通道是一个大分子蛋白复合物,每一个Ito通道由四个α亚单位组成,每个α亚单位都由六个跨膜α螺旋(S1-S6)构成,其中Kv4.2,Kv4.3的表达与Ito,fast通道特性一致,Kv1.4的表达与Ito,slow通道特性一致[16]。由于Ito,slow情况复杂,目前研究甚少,尚不能确定人心房肌细胞是否存在Ito,slow。Kv4.3被认为是人SNC Ito的主要通道[21]。Ito在不同种属、同一种属动物不同部位中的分布存在差异,这种异质性与心脏正常电信号传导及心脏疾病的发生都密切相关。人类从幼儿到成年的过程中,心房细胞Ito的通道蛋白表达呈增加趋势[24]。在心衰、心肌肥厚、心律失常等疾病中,Ito的通道蛋白表达下调,导致APD的延长[25,26]。
2.2.2 延迟整流钾电流(IK) 在心肌上发现的这种离子流激活缓慢,且在充分开放时,电流电压关系呈整流性质,故称为延迟整流钾电流(IK)。“延迟”是IKr通道激活门缓慢开放和关闭一起的;“内向整流”现象是由于IKr通道快速失活引起的。SNC起搏原理中IKr外向离子流的衰减不是由其通道失活引起,而是由于去激活引起[27]。IK是参与AP复极过程的主要电流,对调节APD起着重要的作用,根据激活时间长短分为:超速激活延迟整流钾电流(IKur)、快速激活延迟整流钾电流(IKr)和缓慢激活延迟整流钾电流(IKs)3种。
IKur存在于人、狗及鼠的心房中,在人类的心房肌发挥作用[28],在AP平台期迅速激活,它的激活速度比IKr快并且接近Ito,在AP过程中与Ito部分重叠,具有外向整流特性且失活非常缓慢,对4-AP高度敏感,被认为是抗心律失常药物很有前景的作用靶点[29]。Chandler等[21]在人SNC研究中发现,IKur、IKr、IKs分别由KV1.5、ERG(ether-a-go-go-related gene)和KvLQT1编码。
IKr在AP过程中激活快,失活也快,有内向整流特性,在AP复极3期发挥作用,是第Ⅲ类抗心律失常药物的作用靶点;IKs激活缓慢,激活后几乎不失活,在心肌细胞AP复极2期发挥作用。IKATP和IKACh也参与窦房结细胞的起搏活动。
3 结语
窦房结细胞钾通道种类复杂而繁多,参与SNC除极和复极不同过程,钾离子通道及电流在心脏起搏活动中起着重要的作用,它的失衡可能是病态窦房结综合征(SSS)发生的主要离子基础,也是各种新的抗心律失常药物的可能作用靶点。窦房结细胞钾离子通道结构和电流的病理和生理机制研究,可为今后药物研究提供理论基础。
[1] Lakatta EG,Maltsev VA,Bogdanov KY,et al. Cyclic variation of intracellular calcium: A critical factor for cardiac pacemaker cell dominance[J]. Circ Res,2003,92(3):e45-50.
[2] Baruscotti M,Barbuti A,Bucchi A. The cardiac pacemaker current[J].J Mol Cell Cardiol,2010,48(1):55-64.
[3] Joung B,Chen PS,Lin SF. The role of the calcium and the voltage clocks in sinoatrial node dysfunction[J]. Yonsei Med J,2011,52(2):211-9.
[4] Alboni P,Gianfranchi L,Brignole M. Treatment of persistent sinus bradycardia with intermittent symptoms: Are guidelines clear[J]Europace,2009,11(5):562-4.
[5] Pan Z,Yamaguchi R,Doi S. Bifurcation analysis and effects of changing ionic conductances on pacemaker rhythm in a sinoatrial node cell model[J]. Biosystems,2011,106(1):9-18
[6] Adan V,Crown LA. Diagnosis and treatment of sick sinus syndrome[J]. Am Fam Physician,2003,67(8):1725-32.
[7] Lyashkov AE,Juhaszova M,Dobrzynski H,et al. Calcium cycling protein density and functional importance to automaticity of isolated sinoatrial nodal cells are independent of cell size[J]. Circ Res,2007,100(12):1723-31.
[8] Yerra L,Reddy PC. Effects of electromagnetic interference on implanted cardiac devices and their management[J]. Cardiol Rev,2007,15(6):304-9.
[9] Brahmajothi MV,Morales MJ,Campbell DL,et al. Expression and distribution of voltage-gated ion channels in ferret sinoatrial node[J].Physiol Genomics,2010,42A(2):131-40.
[10] Lakatta EG,Maltsev VA,Vinogradova TM. A coupled system of intracellular Ca2+clocks and surface membrane voltage clocks controls the timekeeping mechanism of the heart's pacemaker[J]. Circ Res,2010,106(4):659-73.
[11] Yanagihara K,Noma A,Irisawa H. Reconstruction of sino-atrial node pacemaker potential based on the voltage clamp experiments[J]. Jpn J Physiol,1980,30(6):841-57.
[12] Noble D. The surprising heart: A review of recent progress in cardiac electrophysiology[J]. J Physiol,1984,353:1-50.
[13] Barbuti A,DiFrancesco D. Control of cardiac rate by "funny" channels in health and disease[J]. Ann N Y Acad Sci,2008,1123:213-23.
[14] Maltsev VA,Lakatta EG. Synergism of coupled subsarcolemmal Ca2+clocks and sarcolemmal voltage clocks confers robust and flexible pacemaker function in a novel pacemaker cell model[J]. Am J Physiol Heart Circ Physiol,2009,296(3):H594-615.
[15] Lakatta EG,Vinogradova TM,Maltsev VA. The missing link in the mystery of normal automaticity of cardiac pacemaker cells[J]. Ann N Y Acad Sci,2008,1123:41-57.
[16] Li GR,Dong MQ. Pharmacology of cardiac potassium channels[J].Adv Pharmacol,2010, 59:93-134.
[17] Ono K,Ito H. Role of rapidly activating delayed rectifier K+current in sinoatrial node pacemaker activity[J]. Am J Physiol,1995,269(2):H453-62.
[18] Lei M,Honjo H,Kodama I,et al. Heterogeneous expression of the delayed-rectifier K+currents iK,rand iK,sin rabbit sinoatrial node cells[J]. J Physiol,2001,535(3):703-14.
[19] Clark RB,Mangoni ME,Lueger A,et al. A rapidly activating delayed rectifier K+current regulates pacemaker activity in adult mouse sinoatrial node cells[J]. Am J Physiol Heart Circ Physiol,2004,286(5):H1757-66.
[20] Niwa N,Nerbonne JM. Molecular determinants of cardiac transient outward potassium current (Ito) expression and regulation[J]. J Mol Cell Cardiol,2010,48(1):12-25.
[21] Chandler NJ,Greener ID,Tellez JO,et al. Molecular architecture of the human sinus node: Insights into the function of the cardiac pacemaker[J]. Circulation,2009,119(12):1562-75.
[22] Bett GC,Rasmusson RL. Inactivation and recovery in Kv1.4 K+channels: Lipophilic interactions at the intracellular mouth of the pore[J]. J Physiol,2004,556(1):109-20.
[23] Zicha S,Xiao L,Stafford S,et al. Transmural expression of transient outward potassium current subunits in normal and failing canine and human hearts[J]. J Physiol,2004,561(3):735-48.
[24] Crumb WJ,Clark CW,Pigott JD,et al. Comparison of ito in young and adult human atrial myocytes: Evidence for developmental changes[J].Am J Physiol,1995,268(3):H1335-42.
[25] Oudit GY,Kassiri Z,Sah R,et al. The molecular physiology of the cardiac transient outward potassium current Itoin normal and diseased myocardium[J]. J Mol Cell Cardiol,2001,33(5):851-72.
[26] Shieh CC,Coghlan M,Sullivan JP,et al. Potassium channels: Molecular defects, diseases, and therapeutic opportunities[J]. Pharmacol Rev,2000,52(4):557-94.
[27] Matsuura H,Ehara T,Ding WG,et al. Rapidly and slowly activating components of delayed rectifier K+current in guinea-pig sino-atrial node pacemaker cells[J]. J Physiol,2002,540(3):815-30.
[28] Li GR,Feng J,Yue L,et al. Evidence for two components of delayed rectifier K+current in human ventricular myocytes[J]. Circ Res,1996,78(4):689-96.
[29] Tamargo J,Caballero R,Gomez R,et al. I(kur)/kv1.5 channel blockers for the treatment of atrial fibrillation[J]. Expert Opin Investig Drugs,2009,18(4):399-416.
