内皮素-1在肝纤维化和肝硬化中的变化及意义
2014-12-01张小华
张小华
(武汉大学基础医学院,湖北 武汉430071;公安县人民医院普外科,湖北 公安434300)
黄玉荣,杨娟
(公安县人民医院普外科,湖北 公安434300)
内皮素(ET)是近年来发现的重要血管活性物质,其对肝硬化患者肝损害和门脉血流动力学的影响受到广泛关注[1-3]。我们通过检测患者血清ET-1、透明质酸酶(HA)、Ⅲ型前胶原(PⅢP)、Ⅳ型胶原(Ⅳ-C)、层粘连蛋白(LN)水平,探讨ET-1在肝硬化形成中的意义,并分析ET-1与门脉血流动力学的关系,为疾病的治疗提供依据。
1 对象与方法
1.1 对象
选取我院2013年1月至2014年1月收治的肝炎肝硬化患者60例(观察组)和慢性肝炎患者20例(对照组)。观察组中男36例、女24例,年龄19~71(42±11)岁。均符合2000年西安第10次全国传染病与寄生虫病会议修订的 《病毒性肝炎防治方案》中肝硬化诊断标准,肝功能Child-Pugh分级A级20例、B级22例、C级18例。对照组中男13例、女7例,年龄21~68(36±12)岁。所有患者均无原发性心、肺、肾疾病和糖尿病、高血压等内分泌系统疾病及其他炎性疾病。观察组与对照组一般情况比较,差异无统计学意义(P>0.05)。
1.2 方法
所有患者采血前3d停用血管活性剂、利尿剂等,禁食12h后自肘静脉采血3ml注入装有10g/dl EDTA-Na2和抑肽酶的聚苯乙烯试管中混匀,4℃离心,分离血浆-20℃保存待测;进行彩色多普勒超声检查,观察门静脉主干血流方向,用脉冲多普勒在门静脉官腔中取样,取样角度<60°,并测量门静脉宽度(Dpv)、门静脉血流速度(Vpv),根据血管面积和流速计算门静脉血流量(Qpv)。
主要仪器:GC-1500型γ放射免疫计数器(安徽中科中佳科学仪器有限公司)、EOS-880半自动生化分析仪(意大利)、HP-M2410型彩色多普勒超声仪(日本)。主要试剂及药盒:北京东亚免疫技术研究所制造的ET测定试剂盒、10g/dl EDTA-Na2、抑肽酶,上海海军医学生物技术中心制造的 HA、Ⅳ-C、LN试剂盒,芬兰Orion Diagnostica公司制造PⅢP试剂盒。
1.3 统计学分析
采用SPSS19.0统计软件进行统计分析。计量资料均以(±s)表示,计量资料组间比较采用t检验,计数资料组间比较采用χ2检验及直线相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 肝硬化患者血清ET-1和HA、PⅢP、Ⅳ-C、LN水平及其与肝功能分级的关系
观察组患者血清ET-1和HA、PⅢP、Ⅳ-C、LN水平均明显高于对照组,差异具有统计学意义(P<0.05);血清ET-1、HA、PⅢP、Ⅳ-C、LN水平呈现出肝功能C级>B级>A级,且均明显高于对照组,差异具有统计学意义(P<0.05)。见表1。
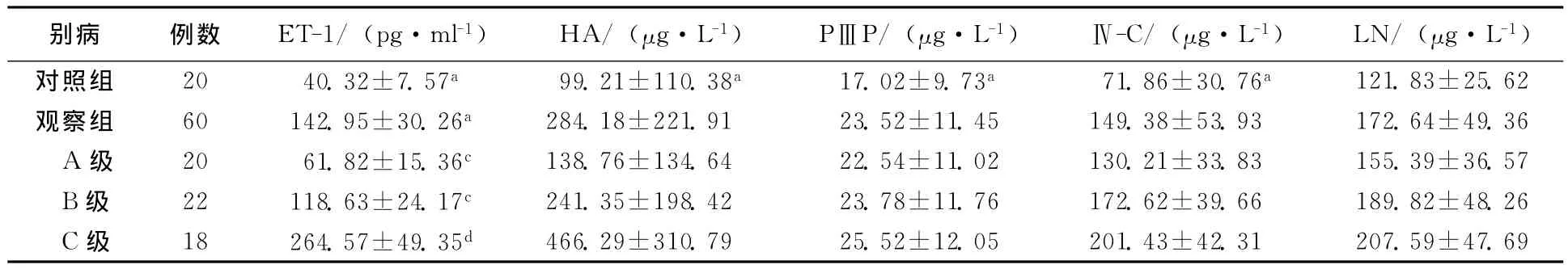
表1 肝硬化患者血清ET-1和HA、PⅢP、Ⅳ-C、LN水平及其与肝功能分级的关系
2.2 肝硬化患者血清ET-1与HA、PⅢP、Ⅳ-C、LN的相关性分析
肝硬化患者血清ET-1与HA、PⅢP、Ⅳ-C、LN呈现明显正相关。见表2。

表2 肝硬化患者血清ET-1与HA、PⅢP、Ⅳ-C、LN的相关性
2.3 不同肝功能状态下血清ET-1与Dpv、Vpv、Qpv的关系
观察组患者血清ET-1、Dpv、Vpv、Qpv均明显高于对照组,差异具有统计学意义(P<0.05);与肝功能分级同步,Dpv呈现C级>B级>A级,且与A级比较,B级明显升高,差异具有统计学意义(P<0.05),与B级比较,C级明显升高,差异具有统计学意义(P<0.05)。Vpv、Qpv均呈现A级>B级>C级,且与A级比较,B级明显升高,差异具有统计学意义(P<0.05),与B级比较,C级明显升高,差异具有统计学意义(P<0.05)。见表3。

表3 不同肝功能状态下血清ET-1与Dpv、Vpv、Qpv的关系
由表3知,患者血清ET-1与Dpv呈现强正相关(r=0.837,P<0.05),与Vpv、Qpv呈明显负相关(r=-0.752、-0.714,P<0.05)。
3 讨论
肝硬化是临床上常见的慢性肝病,肝功能损害、门脉高压是其突出表现[4]。内皮素(ET)来源于内皮细胞,由21个氨基酸残基构成,具有广泛的病理生理作用,对机体多种组织、器官产生复杂的生物学效应[5-8]。ET家族认为由3个血管活性肽构成,在ET-1、ET-2、ET-3中,ET-1具有最强的缩血管作用[9-10],肝脏为机体ET来源的主要场所之一,而ET-1和其受体作为病原因素和诱发因子在肝脏疾病中被广泛研究[11-12]。
肝硬化时ET-1水平表现为肝功能C级>B级>A级>对照组,表明肝硬化患者血清ET-1升高与肝功能损害程度有关。肝功能越差,ET-1升高越明显,提示ET-1对肝硬化形成和发展起重要作用。肝脏合成ET-1部位主要在间质细胞及胆道上皮细胞[13-14]。正常人肝脏间质细胞及胆道上皮细胞ET-1弱表达,ET-1受体在肝内广泛分布于肝细胞、窦状隙内皮细胞、门静脉、中央静脉,故肝硬化内皮细胞、胆道上皮细胞ET-1合成明显升高[15-16]。ET-1能调节肝脏微循环,促使肝血窦收缩,导致肝血窦血流减少甚至完全停止,细胞供氧减少,从而发生缺血、缺氧性损伤及慢性纤维化等[17-19]。同时肝脏是ET-1清除场所之一,肝硬化患者清除ET-1能力下降,血清ET-1会明显升高。肝硬化时肝细胞变性坏死外,同时部分肝细胞增生,肝内血管重建,增生的血管内皮合成分泌ET-1,肝功能减退对ET-1灭活能力降低[20]。随着ET-1水平增高,引起肝内小血管、肝窦、门静脉收缩而导致门脉血流动力学改变,血管壁对切应力的感应变化进一步刺激ET-1释放增加,加重门脉高压,构成恶性循环[21]。
HA、PⅢP、Ⅳ-C、LN可以反映胶原生成及纤维化情况。本研究中患者血清ET-1和HA、PⅢP、Ⅳ-C、LN均明显高于对照组,并且肝硬化患者血浆中ET-1水平随Child-PughA、B、C级呈递增变化,B级与A级、C级与B级ET-1水平差异明显,表明ET-1与肝硬化的严重程度呈明显正相关性。
门静脉宽度(Dpv)、门静脉血流速度(Vpv)和门静脉血流量(Qpv)反映了门脉血流动力学的变化。本研究中比较了不同肝功能状态下门静脉宽度(Dpv)、门静脉血流速度(Vpv)和门静脉血流量(Qpv)水平与血清ET-1水平相关性,呈现血清ET-1与Dpv呈现强正相关,与Vpv、Qpv呈明显负相关,反映了ET-1对门脉血流动力学的影响。
综上所述,肝硬化者血浆ET-1水平反映了肝硬化的严重程度,并对肝硬化门脉血流动力学造成紊乱,在门脉高压的形成及发展中起重要作用。
[1]魏常胜,王宇,张忠涛,等.内皮素-1受体拮抗剂PD142893对肝硬化大鼠肝脏Ⅰ型胶原、Ⅲ型胶原表达的影响以及和肝纤维化关系 [J].中华肝胆外科杂志,2007,13(5):335-336.
[2]Michalski L,Kleniewska P,Goraca A,et al.The role of endothelin-1and its receptor bilckers on the liver function [J].Gen Physiol Biophys,2012,31(4):383-388.
[3]林菊生,程元桥,廖家智.内皮素-1基因Tag1多态性与肝硬化门静脉高压的相关性研究 [J].中华医学杂志,2003,83(6):463-466.
[4]Kardum D,Fabijanic D,Lukic A,et al.Correlation of endothelin-1concentration and angiotensin-converting enzyme activity with the staging of liver fibrosis [J].Coll Antropol,2012,36(2):413-418.
[5]Ling L,Kuc RE,Maguire JJ,et al.Comparison of endothelin receptors in normal versus cirrhotic human liver and in the liver from endothelial cell-specific ETB knockout mice [J].Life Sci,2012,91(13/14):716-722.
[6]Hocher B,Heiden S,Rahnenfuhre J,et al.Dual endothelin-converting enzyme/neutral endopeptidase blockade in rats with D-galactosamine-induced liver failure [J].Eur J Med Res,2011,16(6):275-279.
[7]Hoepermm.Liver toxicity:the Achilles'heel of endothelin receptor antagonist therapy?[J].Eur Respir J,2009,34(3):529-530.
[8]Lanchuk PI,Rusinchuk Lal,Tieriekhov AA.Effect of endothelin-1on the liver oxygen balance and heat production [J].Fiziol Zh,2008,54(6):38-41.
[9]Heiden S,Pfab T,von Websky K,et al.Tissue specific activation of the endothelin system in severe acute liver failure[J].Eur J Med Res,2008,13(7):327-329.
[10]Fukui R,Nishimori H,Hata F.Inhibitory effect of endothelin A receptor blockade on tumor growth and liver metastasis of a human gastric cancer cell line[J].Gastric Cancer,2007,10(2):123-128.
[11]Kitamura Y,Hayashi K.Imbalance between expression of endothelin receptors A and B in terminal liver cirrhosis due to hepatitis C viral infection:immunohistochemical study of autopsy cases[J].J Gastroenterol Hepatol,2008,23(82):451-456.
[12]Yokomori H,Yoshimura K,Ohshima S,et al.The endothelin-1receptor-mediated pathway is not involved in the endothelin-1-induced defenestration of liver sinusoidal endothelial cells [J].Liver Int,2006,26(10):1268-1276.
[13]Zhang WH,Li JY,Zhou Y.Melatonin abates liver ischemia/reperfusion injury by improving the balance between nitric oxide and endothelin [J].Hepatobiliary Pancreat Dis Int,2006,5(4):574-579.
[14]Lattmann T,Ortmann J,Horber S,et al.Upregulation of endothelin converting enzyme-1in host liver during chronic cardiac allograft rejection[J].Exp Biol Med(Maywood),2006,231(6):899-901.
[15]Hei ZQ,Luo CF,Li SR,et al.Changes in hemodynamics and nitric oxide/endothelin-1during liver transplantation in patients with cirrhosis[J].Zhongguo Weizhongbing Jijiu Yixue,2005,17(10):592-594.
[16]Hetz H,Bauer M,Lahner D,et al.Endothelin activation and postoperative renal failure after human liver transplantation[J].Liver Transpl,2005,11(10):1201-1206.
[17]Nagata T,Kudo H,Nishino T,et al.Increased immunoreactivities against endothelin-converting enzyme-1and monocyte chemotactic protein-1in hepatic stellate cells of rat fibrous liver induced by thioacetamide [J].Med Mol Morphol,2005,38(3):161-172.
[18]Tang C,Ma B.Glycosidation of an endothelin ET(A)receptor antagonist and diclofenac in human liver microsomes:aglycone-dependent UDP-sugar selectivity[J].Drug Metab Dispos,2005,33(12):1796-1802.
[19]van Giersbergen PL,Popescu G,Bodin F,et al.Influence of mild liver impairment on the pharmacokinetics and metabolism of bosentan,a dual endothelin receptor antagonist [J].J Clin Pharmacol,2003,43(1):15-22.
[20]Gao M,Guan Y,Zhong D,et al.Activation of liver X receptor attenuates endothelin-1expression in vascular endothelial cells[J].Int J Biochem Cell Biol,2012,44(12):2299-2307.
[21]Bahde R,Kapoor S,Bandi S,et al.Directly acting drugs prostacyclin or nitroglycerine and endothelin receptor biocker bosentan improve cell engraftment in rodent liver [J].Hepatology,2013,57(1):320-330.
