姜黄素对泡沫细胞胆固醇流出及ABCA1表达的影响
2014-12-01周娟
周娟
(南华大学医学院,湖南 衡阳421001)
张大棣
(岳阳市第一人民医院,湖南 岳阳415900)
蔡恒玲
(南华大学医学院,湖南 衡阳421001)
动脉粥样硬化(atherosclerosis,As)是冠心病发生及严重并发症发生的主要原因。泡沫细胞的形成作为As发生的关键环节和典型的病理特征,其贯穿于形成的动脉粥样斑块整个过程,直接关系AS的发生发展[1-2]。蓄积于血管内皮下的氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)被巨噬细胞或者平滑肌细胞吞噬是形成泡沫细胞的主要阶段[3]。胆固醇逆转运(reverse cholesterol transport,RCT)是外周组织清除过多胆固醇防治脂质蓄积抑制动脉粥样硬化的核心机制,而斑块中巨噬细胞胆固醇流出是RCT的重要环节之一,因此促进巨噬细胞胆固醇的流出,可以抑制泡沫细胞的形成,防止斑块的进展,降低冠心病的发生率[4-5]。ATP 结合盒转运蛋白 A1(ATP-binding cassette transporter A1,ABCA1)是调节巨噬细胞胆固醇转运的重要转运蛋白,其表达的下调会引起细胞胆固醇流出的减少,导致胆固醇酯在细胞蓄积,形成泡沫细胞[6]。因此ABCA1是抑制泡沫细胞形成重要靶标。
姜黄素是从姜黄中提取的一种酚类物质,为姜黄的最要活性成分。近年来大量的研究显示,姜黄素具有抗氧化、抗炎、抗凝、降血脂及抑制肿瘤生长等作用[7-8]。而且研究已经证实姜黄素对于大肠癌、乳腺癌、阿尔茨海默病(Alzheimer’s disease,AD)和肝病等具有很好的疗效[9-10]。此外,最近有研究发现姜黄素可以通过调节过氧化体增殖物激活型受体γ(peroxisome proliferator activated receptorγ,PPAR-γ),抑制RAW264.7巨噬细胞白介素(Interleukin1,IL1)和6(Interleukin1,IL1)及单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)表达调节炎症反应,并且还可通过调节MAPK通路从而抑制巨噬细胞CD36表达,发挥抗As的作用[11]。然而姜黄素对RCT作用及其机制尚不明清楚。
本实验以人单核细胞株THP-1源性巨噬细胞为研究的对象,观察姜黄素对ox-LDL诱导THP1巨噬细胞源性泡沫细胞形成的影响,并对其机制进行初步探讨。
1 材料与方法
1.1 材料与试剂
THP-1人单核细胞购于中国科学院上海细胞生物学研究所细胞库;总RNA提取试剂盒(TRIzol)购置北京康为世纪生物科技有限公司;氧化低密度脂蛋白(ox-LDL)购于上海沪尚生物科技有限公司;姜黄素、佛波酯(phorbol myristate acetate,PMA)购于美国 Sigma公司;辣根过氧化物酶(horseradishperioxidase,HRP)标记的羊抗兔二抗、羊抗人ABCA1抗体购于武汉博士德生物工程有限公司;Real Time-PCR逆转录试剂盒购于Toyobo公司;无噬菌体胎牛血清购于四季青生物有限公司,RPMI-1640培养基购于Hyclone,引物是由上海生物技术有限公司设计及合成,其余试剂均为进口或国产分析纯。
1.2 方法
1.2.1 细胞培养 THP-1细胞用含有10%无噬菌体FBS的 RPMI 1640培养液(另加入1.0×105μg/L青霉素和100μg/L链霉素),置于含5%CO2、37℃培养箱中静置培养。实验前预先用160nmol/L PMA处理细胞24h,诱导其分化为巨噬细胞。
1.2.2 实验分组 分5组:对照组(正常巨噬细胞)、模型组(即泡沫细胞组)、姜黄素(1×10-6、1×10-5、1×10-4mol/L)处理组。对照组只加入RPMI1640培养液,模型组在RPMIl640培养液另加入50mg/L ox-LDL共同孵育48h;姜黄素处理组在RPMIl640培养液中加入不同浓度姜黄素(1×10-6、1×10-5、1×10-4mol/L)和50mg/L ox-LDL孵育细胞48h。
1.2.3 油红O染色 参考文献 [12]的方法。
1.2.4 高效液相色谱法测定细胞内胆固醇酯含量 参考文献 [13]的方法。
1.2.5 胆固醇流出测定 参考文献 [13]的方法。胆固醇和磷脂流出率(%)=[培养液中3H/总3H(培养液+细胞内)]×100%。
1.2.6 Western blot 收集各组细胞,加入细胞裂解液,提取细胞的总蛋白,并用BAC试剂盒(按说明书操作)测定蛋白质浓度,用鼎国生物技术公司的SDS-PAGE凝胶试剂盒按说明书配置5%浓缩胶和8%分离胶进行电泳,每孔的上样量50μg,条件恒压80V20min,150V60min,电泳完毕后根据mark显示,切取相应胶带进行转膜,转膜前PVDF膜甲醇浸泡15min,转膜条件为恒流220mA 2h,随后用5%牛奶(TBST配置)封闭6h,加一抗(1∶2000)过夜,后TBST洗膜3遍,每次10min;辣根过氧化物酶标记二抗(1∶2000)室温1.5h,PBS清洗3遍,每次10min。后用Tanon ECL荧光检查仪,对结果进行检测。结果用AlphaImager 2200图像分析软件进行分析,将各组细胞的ABCA1光密度值分别与内参β-actin光密度值进行比较,所得比值代表ABCA1蛋白的表达水平。
1.2.7 Real time-PCR 收集各组细胞,按康为的Trizol试剂盒说明书提取总RNA,分光光度计法标化RNA(A260/A280),按照逆转录试剂盒步骤,每20μl取1.5μg总RNA逆转录合成cDNA,反应条件为:35℃,10min,70℃,8s;再取2.5μl逆转录产物进行实时定量PCR,反应体系为25μl,以β-actin为内参。引物如下:ABCA1的引物序列:上游5'-TCC AGG CCA GTA CGG AAT TC-3',下游5'-ACT TTC CTC GCC AAA CCA GTA G-3',引物长度71bp。PCR 反应条件:50℃ 3min,95℃6min,95℃15s,55℃25s,75℃30s,共40个循环。用ΔΔCt来计算基因的表达水平,计算公式如下:ΔCt=目的基因Ct值-β-actin基因Ct值;ΔΔCt=实验组ΔCt-对照组ΔCt;实验组相对于对照组基因表达水平的倍数=2-ΔΔCt。
1.3 统计学分析
2 结果
2.1 姜黄素对THP1巨噬细胞泡沫化的影响
用油红O染色后,显微镜下观察显示,与对照组相比,泡沫细胞组由于细胞摄取大量的ox-LDL导致胞内脂质堆积,油红O染色阳性细胞遍布视野,脂点呈花环状位于细胞核周,而1×10-5mol/L及1×10-4mol/L姜黄素处理组,油红O染色阳性细胞比细胞模型组明显减少;而10-6mol/L姜黄素处理组的细胞与模型组相比无明显差异(见图1)。
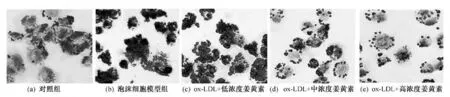
图1 FGF21对泡沫细胞形成的影响(×400)
2.2 姜黄素对THP1巨噬细胞源性泡沫细胞内游离胆固醇及胆固醇酯含量的影响
与对照组相比,模型组细胞内TC、FC和CE含量明显增高(P<0.05),CE/TC值为63.93%,与对照组有明显的统计学意义(P<0.05)。与模型组相比,1×10-5mol/L及1×10-4mol/L姜黄素处理组细胞内TC、FC、CE含量及CE/TC均有明显差异(P<0.05)。而1×10-6mol/L姜黄素处理组TC、FC、CE以及CE/TC与模型组相比无明显统计学意义(P>0.05)。见表1。
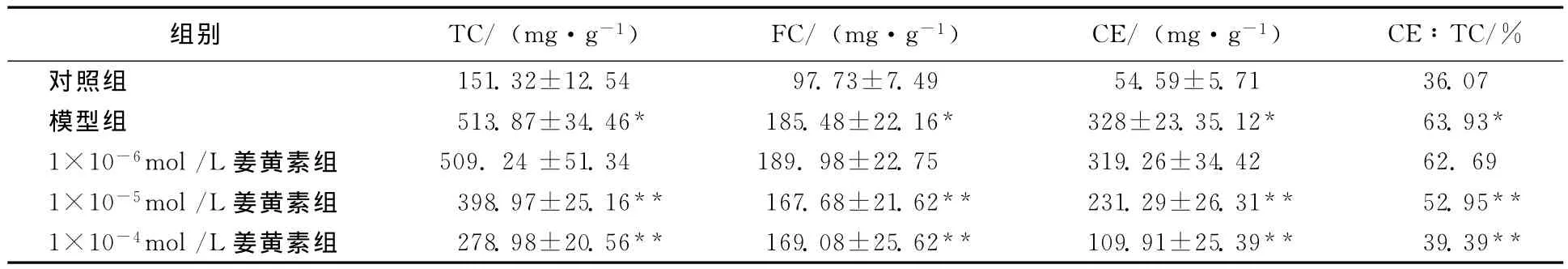
表1 姜黄素对THP1巨噬细胞源性泡沫细胞内游离胆固醇及胆固醇酯含量的影响
2.3 姜黄素对THP1源性巨噬细胞胆固醇流出的影响
为了进一步证明姜黄素对THP1巨噬细胞源性泡沫细胞胆固醇代谢的影响,我们检测了各组细胞的胆固醇流出率。与对照组(9.52%±1.94%)相比,模型组细胞(19.75%±1.85%)的胆固醇流出率明显增加,具有统计学差异(P<0.05)。与模型组相比,1×10-5mol/L(32.07%±2.86%)及1×10-4mol/L(42.56±2.76%)姜黄素处理组细胞的胆固醇流出率明显增加(P<0.01),而1×10-4mol/L姜黄素组与模型组相比胆固醇流出率并无明显差别;1×10-6mol/L姜黄素处理组细胞的胆固醇流出率为(20.93%±2.73%),与模型组细胞无统计学差异(P>0.05)。
2.4 姜黄素对THP1源性巨噬细胞ABCA1mRNA和蛋白表达的影响
Real time-PCR及Western blot结果显示,与对照组相比,泡沫化的巨噬细胞ABCA1mRNA及蛋白表达明显增高(见图2)。与模型组相比,1×10-5mol/L和1×10-4mol/L姜黄处理组细胞内的ABCA1的mRNA和蛋白表达显著增加(均P<0.05),而1×10-6mol/L姜黄素处理组与模型组相比,ABCA1的mRNA和蛋白表达无明显差异。
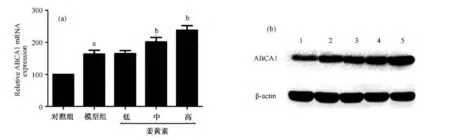
图2 姜黄素对THP1源性巨噬细胞ABCA1表达的影响
3 讨论
As的发生和进展是引起各种心脑血管疾病重要的病理生理基础,防止动脉粥样硬化的发生对预防各种心脑血管疾病具有重要的意义[14]。泡沫细胞的形成作为AS发生的核心环节,关系到斑块的稳定和急性临床事件的发生。因此,预防泡沫细胞的形成成为了预防AS发生进展的主要策略[2]。胆固醇的逆转运作为外周组织转运细胞多余胆固醇主要途径,是防止脂质在外周组织蓄积的重要手段,是对抗AS发生的重要机制。ABCA作为调控胆固醇逆向转运的重要蛋白,其表达的上调可以促进泡沫细胞胆固醇的代谢,脂质流出,抑制泡沫细胞形成[2,15]。
姜黄素是从姜黄中提取出来的天然色素,具有抗炎、抗氧化、降脂等作用[7-8]。现有的国内外研究证明,姜黄素不仅对心肌有保护作用,同时也能通过上调ABCA1表达调控小鼠的认知功能,这表明姜黄素具备改善AD的潜能[16-17]。而最新的研究显示姜黄素可以抑制动脉粥样硬化的进展,但是具体的机制不明。Hasan等研究显示在LDLR-/-小鼠中姜黄素可以抑制脂肪酸结合蛋白以及CD36表达,继而抑制动脉粥样硬化斑块的的进展。Siddiqui等发现姜黄素可以通过调控NF-κB信号通路抑制炎症因子(如IL-6、IL-8、MCP1、TNFα)等的表达[18]。此外,姜黄素还可以通过影响PPARγ的表达降低单核细胞趋化蛋白-1(MCP-1)、内皮素、血管细胞黏附分子-1(VCAM-1)的表达,抑制白细胞介素-6(IL-6)释放,并抑制了NF-κB的活性等发挥拮抗慢性炎症的作用,从而抑制As的进展[19]。而Jain科研团队在糖尿病动物模型及相关的细胞模型实验中也表明了姜黄素具有抗炎作用[20]。这些研究结果表明姜黄素具有抗动脉粥样硬化的潜能,而这也得到了广泛研究的证实,但是关于姜黄素在泡沫细胞胆固醇逆转运中的作用,尚未见研究报道。基于此,我们对姜黄素对泡沫细胞形成及其内胆固醇代谢进行研究,从AS发生的核心环节上,观察姜黄素的作用,为姜黄素在防治AS的研究提供新的理论依据。
通过实验,我们可以看出,姜黄素可以减少THP1巨噬细胞源性泡沫细胞胆固醇的流出,减少胆固醇的蓄积。此外,我们的结果还显示姜黄素可以上调ABCA1表达,而ABCA1作为调节细胞内胆固醇流出的重要蛋白,其表达的上调可以促进泡沫细胞内游离胆固醇的流出,抑制泡沫细胞的形成。LXRα、PPARγ、cAMP作为调节ABCA1表达的重要因子,它们对ABCA1表达的调控已经得到广泛的认同,因此通过调控LXRα、PPARγ、cAMP表达可以调节ABCA1从而促进巨噬细胞胆固醇的流出,防止斑块的进展[21]。而最近研究显示,在脂肪细胞中姜黄素可以通过PPARγ-LXRα-ABCA1途径促进脂肪细胞的胆固醇的流出,这表明姜黄素确实可以激活PPARγ-LXRα通路[22]。在本研究中我们只是初步的确探讨黄素素对泡沫细胞的影响及机制,而关于姜黄素是否通过激活PPARγ-LXRα通路调节ABCA1表达的工作目前正在开展。通过目前我们的研究结果表明,姜黄素可以明显的上调巨噬细胞源性泡沫细胞ABCA1的表达,从而介导细胞内胆固醇的流出,抑制泡沫细胞形成和发展。因此,通过本实验研究我们得出姜黄素可以上调THP1源性巨噬细胞泡沫细胞内ABCA1表达,促进细胞内胆固醇的外流,抑制泡沫细胞的形成。而这为姜黄素在心血管领域的运用及AS药物的研究提供新的方向。
[1]Randolph GJ.Mechanisms that regulate macrophage burden in atherosclerosis [J].Circ Res,2014,114(11):1757-1771.
[2]Yu XH,Fu YC,Zhang DW,et al.Foam cells in atherosclerosis [J].Clin Chim Acta,2013,424:245-252.
[3]Tian L,Luo N,Klein RL,et al.Adiponectin reduces lipid accumulation in macrophage foam cells [J].Atherosclerosis,2009,202(1):152-161.
[4]Iizuka M,Ayaori M,Uto-Kondo H,et al.Astaxanthin enhances ATP-binding cassette transporter A1/G1expressions and cholesterol efflux from macrophages [J].J Nutr Sci Vitaminol(Tokyo),2012,58(2):96-104.
[5]Yvan-Charvet L,Wang N,Tall AR.Role of HDL,ABCA1,and ABCG1transporters in cholesterol efflux and immune responses[J].Arterioscler Thromb Vasc Biol,2010,30(2):139-143.
[6]Lee J,Park Y,Koo SI.ATP-binding cassette transporter A1and HDL metabolism:effects of fatty acids [J].J Nutr Biochem,2012,23(1):1-7.
[7]Dulbecco P,Savarino V.Therapeutic potential of curcumin in digestive diseases [J].World J Gastroenterol,2013,19(48):9256-9270.
[8]Brietzke E,Mansur RB,Zugman A,et al.Is there a role for curcumin in the treatment of bipolar disorder?[J].Med Hypotheses,2013,80(5):606-612.
[9]Monroy A,Lithgow GJ,Alavez S.Curcumin and neurodegenerative diseases [J].Biofactors,2013,39(1):122-132.
[10]Vyas A,Dandawate P,Padhye S,et al.Perspectives on new synthetic curcumin analogs and their potential anticancer properties[J].Curr Pharm Des,2013,19(11):2047-2069.
[11]Chen F,Guo N,Cao G,et al.Molecular analysis of curcumin-induced polarization of murine RAW264.7macrophages [J].J Cardiovasc Pharmacol,2014,63(6):544-552.
[12]欧阳新平,周寿红,田绍文,等.槟榔碱对泡沫细胞胆固醇流出和ABCA1表达的影响 [J].中国动脉硬化杂志,2012,20(4):289-294.
[13]Liu XY,Lu Q,Ouyang XP,et al.Apelin-13increases expression of ATP-binding cassette transporter A1via activating protein kinase Cαsignaling in THP-1macrophage-derived foam cells [J].Atherosclerosis,2013,226(2):398-407.
[14]Hansson GK.Inflammation,atherosclerosis,and coronary artery disease [J].N Engl J Med,2005,352(16):1685-1695.
[15]de la Llera-Moya M,Drazul-Schrader D,Asztalos BF,el at.The ability to promote efflux via ABCA1determines the capacity of serum specimens with similar high-density lipoprotein cholesterol to remove cholesterol from macrophages [J].Arterioscler Thromb Vasc Biol,2010,30(4):796-801.
[16]高秋,杨松,陈燕春,等.姜黄素对阿霉素致大鼠心脏毒性的保护作用及机制探讨 [J].山东医药,2014,54(16):27-29.
[17]滕志朋,王晨,张雄,等.姜黄素对APP/PS1双转基因鼠海马ABCA1、apoA1的表达和血清TC、HDL含量的影响 [J].重庆医科大学学报,2014,39(2):146-149.
[18]Hasan ST,Zingg JM,Kwan P,et al.Curcumin modulation of high fat diet-induced atherosclerosis and steatohepatosis in LDL receptor deficient mice [J].Atherosclerosis,2014,232(1):40-51.
[19]Siddiqui AM,Cui X,Wu R,et al.The anti-inflammatory effect of curcumin in an experimental model of sepsis is mediate d by up-regulation of peroxisome proliferator-activated receptor-γ [J].Crit Care Med,2006,34(7):1874-1882.
[20]Jain SK,Rains J,Croad J,et al.Curcumin supplementa-tion lowers TNF-α,IL-6,IL-8,and MCP-1secretion in high glucose-treated cultured monocytes and blood levels of TNF-alpha,IL-6,MCP-1,glucose and glycosylated hemoglobin in diabetic rats[J].Antioxid Redox Signal,2009,11(2):241-249.
[21]Schmitz G,Langmann T.Transcriptional regulatory networks in lipid metabolism control ABCA1expression a [J].Biochim Biophys Act,2005,1735(1):1-19.
[22]Dong SZ,Zhao SP,Wu ZH,et al.Curcumin promotes cholesterol efflux from adipocytes related to PPARgamma-LXRalpha-ABCA1 passway [J].Mol Cell Biochem,2011,358(1/2):281-285.
