利用骨科电锯建立兔桡骨骨折模型的研究
2014-12-01李长雷
李长雷
(江汉大学医学院,湖北 武汉430056)
马宝苗
(江汉大学武汉生物医学研究院,湖北 武汉430056)
陈晓青,杨友华,易卉玲,黄丽霞,黄丹
(江汉大学医学院,湖北武汉430056)
钟守昌
(江汉大学教务处,湖北 武汉430056)
骨折愈合是一个非常复杂的骨再生过程,涉及到多种细胞及细胞间质,大量蛋白质、成千上百种基因的表达。他们相互协调、共同作用,导致了骨结构的完整性和骨强度的恢复[1]。
研究骨折愈合的机制和促进骨折愈合的方法,建立理想的动物骨折模型是非常必要的。模型制备是否科学合理直接关系到实验结果的科学性、可靠性及可重复性[2-3]。经过前人长期的探索与总结,目前在科研中作为建模对象的动物有很多,如犬[4]、牛[5]、鼠[6-7]、猪[8]及兔等,实验兔桡骨骨折模型就是其中一类[9-11]。制作兔桡骨骨折模型的方法有很多种,与传统方法中使用钝器直接猛烈敲击预造模部位以达到骨折的目的相比较,利用骨科电锯制作的兔桡骨骨折模型成功率高,机体所受创伤小。在此基础上,为了检测低频电磁场和低强度超声波治疗在单独和联合作用情况下对骨折损伤修复效果和对修复疗效建立评价体系,研究人员利用骨科电锯,选取兔建立一个理想的桡骨骨折模型。
1 材料与方法
1.1 实验动物
普通级成年健康日本大耳白兔30只(实验动物质量合格证编号:NO.42010000000194),平均体质量2~2.5kg,雌雄各半,常规单笼饲养,自由进食和饮水,饲料为全价颗粒料。实验过程在江汉大学实验动物中心完成 [实验动物使用许可证编号:SYXK(鄂)2007-0042]。
对实验动物的处理方法均严格遵守国家科技部颁发的 《关于善待实验动物的指导性意见》之规定[12]。
1.2 试剂与仪器
PX-100CLK型移动式医用诊断X射线机(东芝/上海医疗器械厂有限公司);小型骨科电锯(江汉大学附属医院提供);戊巴比妥钠:含量≥99.0%,25g/瓶,批号:WS20120112,即配即用,江汉大学医学院药理教研室提供。
1.3 模型制作
兔适应性饲养1周后,随机分为7d、14d和21d三组,每组10只。造模过程:兔经耳缘静脉注射浓度为2.5% 的戊巴比妥钠(1ml/kg),麻醉后,放置经消毒后的外科手术台,在双前肢内侧桡骨中段处剪毛、消毒、备皮,再经活力碘消毒,无菌条件下,通过手术方式切开皮肤,剥离周围软组织和血管,露出桡骨。用直径为2cm、厚度为0.2cm的小型骨科电锯沿桡骨垂直方向造成中段不完全横断骨折,骨折处宽度为0.2cm,深度为桡骨的2/3,止血、清创、缝合皮肤,不予固定(图1a~d)。兔术后分笼饲养,每只动物每日1次经耳缘静脉注射青霉素40万U预防感染,共持续3d。
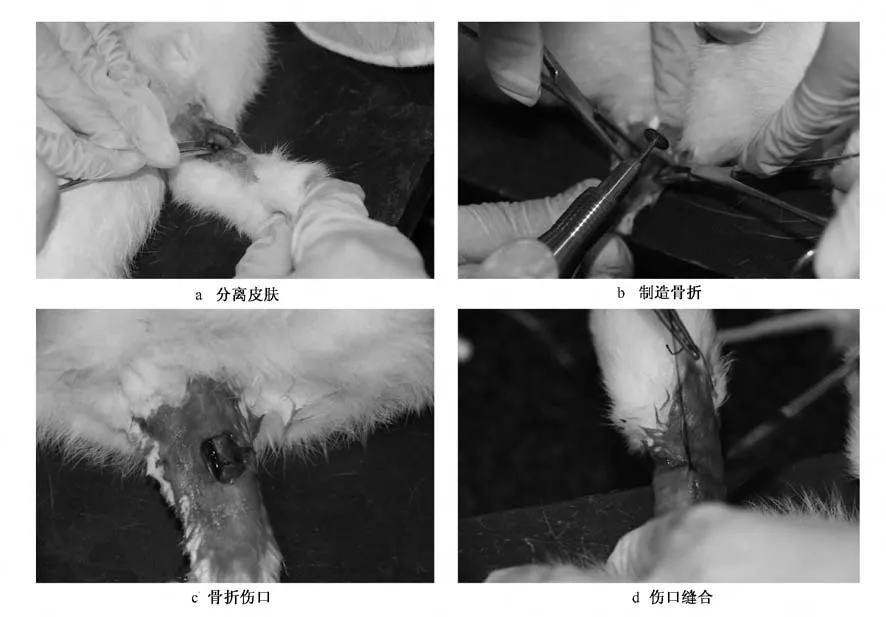
图1 桡骨骨折模型制作过程
1.4 观察指标
造模总时长为21d。在造模后分别对7d、14d和21d组兔造模部位桡骨进行X光照射取片,之后取材造模部位桡骨进行组织病理学检查,在动态的情况下观察不同时段骨折自行修复的情况。
1.4.1 X光照射取片 用PX-100CLK型移动式医用诊断X射线机进行X光摄片,采用的电压为55KV,电流量为125mA,焦距为81cm,曝光时间为1.1ms。在麻醉状态下进行X光拍片,每一个前肢拍摄一张X光片,观察兔骨折后的自行修复状况。
1.4.2 组织病理学检测 在对全部兔骨折部位进行X光照射取片后,处死家兔,立即以双前肢桡骨骨折处为中心,取材长度为2cm的一段为标本,经10%甲醛溶液固定,再置于5%EDTA液中脱钙,彻底冲洗,酒精梯度脱水,二甲苯透明,石蜡包埋,平行于桡骨纵轴经桡骨中央过骨髓腔及两侧皮质切取厚约5mm的长轴切片3张作苏木精-伊红染色(HE染色),做组织病理学检测,分析骨折造模效果[13]。
2 结果
2.1 X光照射结果
造模后观察7d组,2只为骨折处完全断裂,移位明显,有小块骨碎片(图2a)。8只兔前肢桡骨中段显示为不完全横断骨折,且骨折断端横截面较整齐,边缘较清晰(图2b)。无明显骨膜反应;观察14d组,大多数兔骨折断端边缘逐渐模糊不清,并伴有轻度骨膜反应,有少量骨痂(图2c);观察第21d组,兔骨折断端边缘已基本接近消失,但仍可疑似观察到,伴有较深骨膜反应,骨痂量增多,但未填满缺损部位(图2d)。

图2 术后第7天、14天、21天动物骨折处X射线片
2.2 组织病理学检测
造模后观察7d组,骨折断端部位淤血肿块较大,形成少量肉芽肿;观察14d组,骨折断端部位淤血肿块基本被吸收,有较多纤维及成纤维细胞连接,小血管增生尚不明显。形成较多的肉芽肿;观察21d组,纤维结缔组织增生,软骨细胞生成,小血管增生较多。
3 讨论
在制作兔桡骨骨折模型的众多方法中,传统方法固然可以建立骨折模型,但是造模的效果较差:会出现骨折部位不准确、骨折范围过大、骨碎片过多、伤及其他部位等现象;可能引发其他并发症,对机体本身造成较大的伤害,不利于骨折的治疗与分析。而利用骨科电锯制作的兔桡骨骨折模型成功率高,定位准确,伤口范围小,出血量少,易于缝合、消毒、观察和治疗,避免感染带来的并发症,机体易于恢复健康,有助于骨折治疗方法的探索与研究。
本次实验共使用兔30只,从拍摄的桡骨X光片和组织病理学结果分析,全部造模动物均发生了骨折现象,其中2只因不符合造模要求外,其余兔桡骨骨折模型均取得成功。说明利用骨科电锯制作兔桡骨骨折模型的方法具有很高的成功率。在造模后3周内,动态的观察兔在骨折后的不同时段,均发生了自行修复现象。但这类现象发生的时间有先后,这属于动物个体差异性的表现。
与其它动物相比,用兔建立骨折模型有以下优点更适于造模:①兔的四肢属于长骨,长骨通常是指上肢桡骨或者下肢胫骨,其骨质结构与人类相似度较高[14]。相比较与胫骨,桡骨只有皮肤和少量筋膜覆盖,少血管,桡骨头周缘有环状关节面,下方光滑;下端特别膨大,近似立方形;更容易分离和暴露;且对机体造成的损伤较小,减少对骨折愈合的影响。②兔的骨骼转化速度快,约达到了人类的3倍,可以在短期内观察骨折愈合时骨组织的变化[15]。③兔应用广泛,可以用合理的时间、工作和成本得到更有价值的数据;造模操作简便,成功率高,可以减少实验时间,降低外来影响因素对动物模型的影响[2]。因此选择兔的上肢桡骨制作骨折模型,研究低频电磁场和低强度超声波治疗在单独和联合作用情况下对人类骨伤研究与治疗,骨折的再生与修复,是一种较为理想的方法。
动物模型是否科学合理,是否适用于人类疾病的模拟治疗,需要从多方面进行评估。第一,动物模型的建立是否符合临床诊断与治疗的实际要求。因为建立动物模型的目的是用于对人类疾病的认识、探索与研究,只有最大程度的满足于临床的实际需要,才能使实验的结果具有最大程度的科学性和可信度。如果动物模型与相关的人类疾病出现较大的差异,那么模型就失去了意义。兔桡骨骨折模型虽然可以很好的模拟人类桡骨骨折时的病理状态,但毕竟动物不同于人类,两者在解剖学和生物学等方面有一定程度的差异,而且骨折的修复与再生是一个涉及全局性的过程,所以即使在动物模型上取得较好的实验结果,也需要在临床上进行验证和评估[15-18];第二,建立动物模型的方法必须具有稳定性和可重复性。开展动物实验需要严格遵守重复的原则,才能使实验结果真实有效。因此需要的动物模型都必须具有相同的稳定的疾病模拟状态;第三,建立动物模型的方法要有较强的易操作性。实验过程中需要大量的样本,动物模型需要重复建造,如果造模难度过大,则会造成较大的工作量,也延长了每批次实验间隔的时间,增加了诸多不稳定因素,可控性降低。
骨折动物模型在研究人类骨折中起到非常重要的作用,采用合适的动物模型可以对疾病研究起到事半功倍的效果[19]。一方面,出现骨折有较大的随机性,而在临床诊断和治疗过程中还会不断面临新的问题,因此需要对临床实践问题进行归纳和总结,以期建立符合实践要求的动物模型;另一方面,对已经建立的动物模型,既可以在此基础上进行多方位深层次的研究,也可以根据新情况不断完善与改良。
[1]张保中.低强度超声波在骨折愈合中的作用 [J].中国骨与关节外科,2008,1(1):67-71.
[2]赵震宇,邵林,刘建宇,等.外固定方法制作的大鼠股骨骨折模型 [J].中国组织工程研究与临床康复,2011,15(24):4387-4390.
[3]徐自胜,李孝林,任伯绪.兔胫骨骨折模型的不同固定方法 [J].中国组织工程研究与临床康复,2011,15(33):6103-6106.
[4]张敦伟,李守军,曾宪斌,等.犬股骨远端髁间T型骨折内固定实验模型的建立 [J].动物医学进展,2010,31(3):76-78.
[5]Wilke HJ,Krischak S,Claes L.Biomechanical comparison of calf and human spines [J].J Orthop Res,1996,14(3):500-503.
[6]王维彬,韩大成,陈建海,等.兔胫骨平台骨折愈合的生物力学变化规律 [J].中国组织工程研究与临床康复,2010,14(39):7277-7280.
[7]张连方,齐进,王晋申,等.小鼠闭合性股骨骨折模型的建立与评估 [J].中国矫形外科杂志,2010,18(2):143-146.
[8]Yingling VR,Callaghan JP,McGill SM.The porcine cervical spine as a model of the human lumbar spine:an anatomical,geometric,and functional comparison [J].J Spinal Disord,1999,12(5):415-423.
[9]张万强,杨丽平,宋庆慧,等.外用白脉软膏对家兔桡骨骨折模型愈合过程及骨痂组织结构的影响 [J].中国中医基础医学杂志,2012,18(2):170-172.
[10]蔡羽中,何爱咏,王欣文,等.辛伐他汀与BMP-2促进兔桡骨骨折愈合的对比观察研究 [J].生物医学工程与临床,2011,15(1):10-14.
[11]杨成芳,张均智,梁荣感.白花丹对家兔骨折愈合的影响 [J].中国组织工程研究与临床康复,2009,13(2):296-299.
[12]中华人民共和国科学技术部.关于善待实验动物的指导性意见 [Z].2006-09-30.
[13]陈希聪,陈志维,黎惠萍,等.骨宝丸对兔桡骨骨折愈合影响的实验研究 [J].中国医药指南,2012,10(12):91-94.
[14]袁兵,卞俊,任锐,等.家兔胫骨骨折模型的建立 [J].海军医学杂志,2012,33(4):222-223.
[15]汤译博,赵亮,苏佳灿.骨折动物模型的研究进展 [J].中国骨伤,2011,24(1):91-93.
[16]O'Loughlin PF,Morr S,Bogunovic L,et al.Selection and development of preclinical models in fracture-healing research [J].J BoneJoint Surg Am,2008,90(Suppl 1):79-84.
[17]Holstein JH,Matthys R,Histing T,et al.Development of a stable closed femoral fracture model in mice [J].J Surg Res,2009,153(1):71-75.
[18]Shirley D,Marsh D,Jordan G,et al.Systemic recruitment of osteoblastic cells in fracture healing [J].J Orthop Res,2005,23:1013-1021.
[19]Zachos TA,Bertone AL,Wassenaar PA,et al.Rodent models for the study of articular fracture healing [J].J Invest Surg,2007,20(2):87-95.
